دوره 13، شماره 1 - ( بهار 1397 )
جلد 13 شماره 1 صفحات 27-16 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Behjati Ardakani A, Qassemian A, Koushki M, Shakour E, Mehrez A. The Effect of a Resistance Training Course on Blood Pressure and Nitric Oxide Levels in Elderly Women. Salmand: Iranian Journal of Ageing 2018; 13 (1) :16-27
URL: http://salmandj.uswr.ac.ir/article-1-1166-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-1166-fa.html
بهجتی اردکانی علیرضا، قاسمیان احمد، کوشکی مریم، شکور الهام، محرز احمد. تأثیر یک دوره تمرین مقاومتی بر فشار خون و نیتریکاکساید در زنان سالمند. سالمند: مجله سالمندی ایران. 1397; 13 (1) :16-27
علیرضا بهجتی اردکانی1 
 ، احمد قاسمیان*2
، احمد قاسمیان*2 
 ، مریم کوشکی3
، مریم کوشکی3 
 ، الهام شکور3
، الهام شکور3 
 ، احمد محرز3
، احمد محرز3 


 ، احمد قاسمیان*2
، احمد قاسمیان*2 
 ، مریم کوشکی3
، مریم کوشکی3 
 ، الهام شکور3
، الهام شکور3 
 ، احمد محرز3
، احمد محرز3 

1- گروه علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه شهرکرد، شهرکرد، ایران.
2- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه شیراز، شیراز، ایران. ،ahmadqassemian@gmail.com
3- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه شیراز، شیراز، ایران.
2- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه شیراز، شیراز، ایران. ،
3- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم تربیتی و روانشناسی، دانشگاه شیراز، شیراز، ایران.
متن کامل [PDF 2453 kb]
(4856 دریافت)
| چکیده (HTML) (11364 مشاهده)
مقدمه
یکی از جدیترین مشکلاتی که جامعه جهانی را نگران کرده، چگونگی تأمین مراقبتهای بهداشتی از افراد سالمند است. از جمله مشکلات دوران سالمندی بیماریهای قلبیعروقی است. مهمترین دلیل بیماریهای عروق کرونری را آترواسکلروز میدانند [1]. تغییرات پاتولوژیک آترواسکلروز از دوران کودکی آغاز میشود و در چند مرحله در سنین بالاتر بروز میکند [1].
تغییرات بیماریزایی آترواسکلروز با افزایش سن پیشرفت میکند و درنهایت منجر به مرگ در دوران سالمندی میشود؛ بنابراین شناخت عوامل مؤثر در پیدایش بیماریهای قلبیعروقی در پیشگیری از پیشرفت بیماری نقش مهمی دارد [2]. سن، جنس، LDL-C بالا، مصرف سیگار، پُرفشاری خون، دیابت و بیتحرکی، دلیل ابتلا به همه بیماریهای قلبیعروقی و شناختهشدهترین عوامل مرگ در این بیماریها محسوب میشوند [3]. یائسگی و به دنبال آن کاهش هورمونهای استروئیدی جنسی و افزایش چربی بدن، بهویژه چربی شکمی، امکان ابتلا به بیماریهای قلبیعروقی و متابولیکی را در زنان افزایش میدهد [4]. به طور کلی، عوامل خطرزای بیماریهای قلبیعروقی با افزایش سن و چاقی تشدید میشوند [5]. کمتحرکی و چاقی میتواند فرد را در معرض خطر ابتلا به سندرمهای متابولیک، از جمله افزایش فشار خون قرار دهد [6].
اندوتلیوم عروق، نقش حیاتی و پیچیدهای در تنظیم جریان خون و تولید مواد شیمیایی مانند نیتریکاکساید، پروستاسیکلین و اندوتلین دارد. علاوه بر عوامل عصبی و هومورال، اندوتلیوم عروق پوست را نیز کنترل میکند [7]. تمرینات فیزیکی منظم ممکن است به عنوان عامل غیرفارماکولوژیک، باعث کاهش یا تأخیر در ایجاد اختلال در عملکرد اندوتلیال افرادِ پیر و برگشت عملکرد اندوتلیال در افراد آترواسکلروزیس شود. ورزش با افزایش جریان خون، تنش برشی را در عروق افزایش میدهد و در صورت سالم بودن اندوتلیال منجر به گشادی عروق میشود [8]. با توجه به اینکه هنگام ورزش، با افزایش درجه حرارت مرکزی، جریان خون پوست برای تسهیل انتقال حرارت از مرکز به پوست افزایش مییابد، ممکن است افزایش جریان خون پوست هنگام ورزش در اثر تغییرات مکانیکی با ایجاد جریان پالسی به تغییر عملکرد اندوتلیال یا افزایش حساسیت در عوامل شلکننده مشتق از اندوتلیوم در عروق پوست منجر شود [9]. تمرین مقاومتی میتواند فوایدی حتی فراتر از تمرینات استقامتی برای بهبود نیمرخ متابولیکی در افراد پرخطر داشته باشد [10]. مشخص شده است انقباضهای ایزومتریک تأثیراتی شبهانسولینی بر برداشت گلوکز در عضله اسکلتی دارند [12 ،11].
اخیراً به نیتریکاکساید در قالب ماده واسطهای مهمی در انواع اََعمال فیزیولوژیک، مانند انتقال جریانات عصبی، تنظیم فشار خون، گشادشدن رگها، فعالیت ایمنی و دفاعی توجه فراوان شده است [13]. نیتریکاکساید ناشی از اندوتلیوم، با ایجاد تون گشادکننده مداوم در بستر عروق، موجب خونرسانی بهتر به اندامها میشود [14]. eNOS NOS-III اولینبار در سلولهای اندوتلیال عروق یافت شد. eNOS NOS-III متصل به غشای سلولی است و باعث انبساط عروق میشود و در تنظیم فشار خون نقش دارد [15].
سلولهای اندوتلیال عروقی با تولید مواد فعالکننده عروق، مانند اندوتلین و نیتریکاکساید، نقش مهمی در تنظیم فعالیتهای عروقی برعهده دارند [16]. عامل رشد اندوتلیال عروقی موجب آزادسازی نیتریکاکساید وابسته میشود [17] که این به دلیل افزایش کلسیم سیتوزولی و سنتز نیتریکاکساید اندوتلیالی است [18]. رگهای خونی پیر، سنتز نیتریکاکساید آندوتلیالی کمتری نشان میدهند [19] که باعث تولید نیتریکاکساید کمتری میشود [20]، کاهش تولید نیتریکاکساید میتواند با افزایش فعالیت پلاکتهای خونی و ترومبوس شریانی [21]، همچنین با افزایش آرتروژنز همراه باشد [22]. از طرفی میان کاهش فعالیت زیستی نیتریکاکساید و شیوع بیماریهای قلبیعروقی در زنان یائسه ارتباطی قوی گزارش شده است [24 ،23]. برخی مطالعات، اثر اجرای تمرینات ورزشی منظم را در بهبود اندوتلیال عروق زنان یائسه نشان دادهاند. ورزش با افزایش جریان خون، موجب تحریک مکانیکی در عروق میشود و در صورت سالم بودن اندوتلیال به افزایش تولید و رهایش نیتریکاکساید منجر میشود [25].
هاروی و همکاران در تحقیق خود به نقش درمانی تمرینات ورزشی به عنوان مداخله جایگزین هورموندرمانی برای بهبود عملکرد اندوتلیال زنان یائسه اشاره کردند [26]. همچنین نتایج تحقیق زاوروس و همکاران در سال 2009 نشان داد فشار خون سیستول و دیاستول پس از 6 ماه تمرین ورزشی به طور معنیداری کاهش یافت که البته این کاهش همراه با افزایش سطح متابولیتهای نیتریکاکساید بود [27]. بنابراین با توجه به اینکه زنان یائسه بخش بزرگی از جامعه هستند و یائسگی رویدادی فیزیولوژیک است که در زندگی تمام زنان پدیدار میشود و به تغییرات نامطلوب در عملکرد اندوتلیوم عروقی منجر میشود و همچنین با توجه به تحقیقات محدود درباره تأثیر فعالیت بدنی در این دوره زمانی، این مطالعه با هدف بررسی تأثیر یک دوره تمرین مقاومتی بر غلظت نیتریکاکساید زنان سالمند انجام شد.
روش مطالعه
این تحقیق از نوع نیمهتجربی است و در قالب طرح تحقیق دوگروهی به صورت پیشآزمون و پسآزمون اجرا شد. 24 زن سالمند (با میانگین سن 37/02±67/6 سال، قد 8/12±153/02سانتیمتر، وزن 1278/30±65کیلوگرم، شاخص توده بدن Kg/m2 16/4±26/87، و نسبت کمر به باسن 0/4±0/92) به طور داوطلبانه در تحقیق شرکت کردند.
اندازهگیری نیتریکاکساید
48 ساعت قبل و بعد از هشت هفته تمرین مقاومتی، از هر داوطلب 5 سیسی خون از ورید قدامی بازویی گرفته شد. خونگیری رأس ساعت 8 صبح و پس از 12 ساعت، در حالی که آزمودنیها ناشتا بودند، در اتاق پزشک سرای سالمندان انجام شد. نمونهخونهایی که قبل از شروع برنامه تمرین مقاومتی، گرفته شده بودند، بلافاصله به آزمایشگاه فرستاده شدند و مطابق دستورالعمل کیت تخصصی استفادهشده، پلاسمای آنها با سانتریفیوژ جداسازی و در دمای منهای 70 درجه سانتیگراد فریز شد. پس از گرفتن نمونه خونها در 8 هفته تمرین مقاومتی، و جداسازی پلاسمای آن، نمونهها برای تجزیهوتحلیل، به صورت یکجا به آزمایشگاه تشخیص طبی ارسال شد تا غلظت نیتریکاکساید را با استفاده از کیت الایزا (ساخت شرکت گلوریِ آمریکا) با دقت یکدهم میکرومول بر لیتر (µmol/L) اندازهگیری شود.
برنامه تمرین مقاومتی
پس از ارزیابی سطح آمادگی بدنی آزمودنیها، گروه تجربی 8 هفته، هر هفته سه جلسه و در هر جلسه حدود 60 دقیقه در تمرینهای مقاومتی شرکت کردند. برنامۀ تمرین شامل 10 دقیقه گرمکردن با انواع حرکات کششی و نرمشی و سپس انجام 10 حرکت ایستگاهی به صورت دایرهای در 30 تا 40 دقیقه بود. در انتها نیز 10 دقیقه سردکردن در نظر گرفته شد. ایستگاهها شامل 10 نوع تمرین مقاومتی (پرس پا، پرس سینه، پرس شانه، جلوبازو، پشتبازو، لتپول، اکستنشن زانو (چهارسر ران)، خمکردن زانو (سرینی و همسترینگ)، بلندشدن روی پاشنه (تقویت عضله دوقلو)، و درازنشست بود. برنامۀ تمرین در هر جلسه شامل3 دور با 12 تکرار و با شدت 40 تا 65 درصد یک تکرار بیشینه بود. زمان استراحت بین ایستگاهها، 45 تا 60 ثانیه و زمان استراحت بین هر دور 90 ثانیه در نظر گرفته شد. اصل اضافهبار به گونهای طراحی شد که بعد از هر شش جلسه تمرین، یک آزمون یک تکرار بیشینه برای هر فرد در هر ایستگاه انجام شد و 5 درصد وزنه به آن اضافه شد [29 ،28]. برای تعیین یک تکرار بیشینه از فرمول زیر استفاده شد [29]:
متن کامل: (10012 مشاهده)
مقدمه
یکی از جدیترین مشکلاتی که جامعه جهانی را نگران کرده، چگونگی تأمین مراقبتهای بهداشتی از افراد سالمند است. از جمله مشکلات دوران سالمندی بیماریهای قلبیعروقی است. مهمترین دلیل بیماریهای عروق کرونری را آترواسکلروز میدانند [1]. تغییرات پاتولوژیک آترواسکلروز از دوران کودکی آغاز میشود و در چند مرحله در سنین بالاتر بروز میکند [1].
تغییرات بیماریزایی آترواسکلروز با افزایش سن پیشرفت میکند و درنهایت منجر به مرگ در دوران سالمندی میشود؛ بنابراین شناخت عوامل مؤثر در پیدایش بیماریهای قلبیعروقی در پیشگیری از پیشرفت بیماری نقش مهمی دارد [2]. سن، جنس، LDL-C بالا، مصرف سیگار، پُرفشاری خون، دیابت و بیتحرکی، دلیل ابتلا به همه بیماریهای قلبیعروقی و شناختهشدهترین عوامل مرگ در این بیماریها محسوب میشوند [3]. یائسگی و به دنبال آن کاهش هورمونهای استروئیدی جنسی و افزایش چربی بدن، بهویژه چربی شکمی، امکان ابتلا به بیماریهای قلبیعروقی و متابولیکی را در زنان افزایش میدهد [4]. به طور کلی، عوامل خطرزای بیماریهای قلبیعروقی با افزایش سن و چاقی تشدید میشوند [5]. کمتحرکی و چاقی میتواند فرد را در معرض خطر ابتلا به سندرمهای متابولیک، از جمله افزایش فشار خون قرار دهد [6].
اندوتلیوم عروق، نقش حیاتی و پیچیدهای در تنظیم جریان خون و تولید مواد شیمیایی مانند نیتریکاکساید، پروستاسیکلین و اندوتلین دارد. علاوه بر عوامل عصبی و هومورال، اندوتلیوم عروق پوست را نیز کنترل میکند [7]. تمرینات فیزیکی منظم ممکن است به عنوان عامل غیرفارماکولوژیک، باعث کاهش یا تأخیر در ایجاد اختلال در عملکرد اندوتلیال افرادِ پیر و برگشت عملکرد اندوتلیال در افراد آترواسکلروزیس شود. ورزش با افزایش جریان خون، تنش برشی را در عروق افزایش میدهد و در صورت سالم بودن اندوتلیال منجر به گشادی عروق میشود [8]. با توجه به اینکه هنگام ورزش، با افزایش درجه حرارت مرکزی، جریان خون پوست برای تسهیل انتقال حرارت از مرکز به پوست افزایش مییابد، ممکن است افزایش جریان خون پوست هنگام ورزش در اثر تغییرات مکانیکی با ایجاد جریان پالسی به تغییر عملکرد اندوتلیال یا افزایش حساسیت در عوامل شلکننده مشتق از اندوتلیوم در عروق پوست منجر شود [9]. تمرین مقاومتی میتواند فوایدی حتی فراتر از تمرینات استقامتی برای بهبود نیمرخ متابولیکی در افراد پرخطر داشته باشد [10]. مشخص شده است انقباضهای ایزومتریک تأثیراتی شبهانسولینی بر برداشت گلوکز در عضله اسکلتی دارند [12 ،11].
اخیراً به نیتریکاکساید در قالب ماده واسطهای مهمی در انواع اََعمال فیزیولوژیک، مانند انتقال جریانات عصبی، تنظیم فشار خون، گشادشدن رگها، فعالیت ایمنی و دفاعی توجه فراوان شده است [13]. نیتریکاکساید ناشی از اندوتلیوم، با ایجاد تون گشادکننده مداوم در بستر عروق، موجب خونرسانی بهتر به اندامها میشود [14]. eNOS NOS-III اولینبار در سلولهای اندوتلیال عروق یافت شد. eNOS NOS-III متصل به غشای سلولی است و باعث انبساط عروق میشود و در تنظیم فشار خون نقش دارد [15].
سلولهای اندوتلیال عروقی با تولید مواد فعالکننده عروق، مانند اندوتلین و نیتریکاکساید، نقش مهمی در تنظیم فعالیتهای عروقی برعهده دارند [16]. عامل رشد اندوتلیال عروقی موجب آزادسازی نیتریکاکساید وابسته میشود [17] که این به دلیل افزایش کلسیم سیتوزولی و سنتز نیتریکاکساید اندوتلیالی است [18]. رگهای خونی پیر، سنتز نیتریکاکساید آندوتلیالی کمتری نشان میدهند [19] که باعث تولید نیتریکاکساید کمتری میشود [20]، کاهش تولید نیتریکاکساید میتواند با افزایش فعالیت پلاکتهای خونی و ترومبوس شریانی [21]، همچنین با افزایش آرتروژنز همراه باشد [22]. از طرفی میان کاهش فعالیت زیستی نیتریکاکساید و شیوع بیماریهای قلبیعروقی در زنان یائسه ارتباطی قوی گزارش شده است [24 ،23]. برخی مطالعات، اثر اجرای تمرینات ورزشی منظم را در بهبود اندوتلیال عروق زنان یائسه نشان دادهاند. ورزش با افزایش جریان خون، موجب تحریک مکانیکی در عروق میشود و در صورت سالم بودن اندوتلیال به افزایش تولید و رهایش نیتریکاکساید منجر میشود [25].
هاروی و همکاران در تحقیق خود به نقش درمانی تمرینات ورزشی به عنوان مداخله جایگزین هورموندرمانی برای بهبود عملکرد اندوتلیال زنان یائسه اشاره کردند [26]. همچنین نتایج تحقیق زاوروس و همکاران در سال 2009 نشان داد فشار خون سیستول و دیاستول پس از 6 ماه تمرین ورزشی به طور معنیداری کاهش یافت که البته این کاهش همراه با افزایش سطح متابولیتهای نیتریکاکساید بود [27]. بنابراین با توجه به اینکه زنان یائسه بخش بزرگی از جامعه هستند و یائسگی رویدادی فیزیولوژیک است که در زندگی تمام زنان پدیدار میشود و به تغییرات نامطلوب در عملکرد اندوتلیوم عروقی منجر میشود و همچنین با توجه به تحقیقات محدود درباره تأثیر فعالیت بدنی در این دوره زمانی، این مطالعه با هدف بررسی تأثیر یک دوره تمرین مقاومتی بر غلظت نیتریکاکساید زنان سالمند انجام شد.
روش مطالعه
این تحقیق از نوع نیمهتجربی است و در قالب طرح تحقیق دوگروهی به صورت پیشآزمون و پسآزمون اجرا شد. 24 زن سالمند (با میانگین سن 37/02±67/6 سال، قد 8/12±153/02سانتیمتر، وزن 1278/30±65کیلوگرم، شاخص توده بدن Kg/m2 16/4±26/87، و نسبت کمر به باسن 0/4±0/92) به طور داوطلبانه در تحقیق شرکت کردند.
افراد انتخابشده سابقه شرکت در هیچ تمرین مقاومتی را نداشتند و به بیماریهای قلبی یا بیماریهای خاص مبتلا نبودند. افراد آزمایششده پس از پرکردن فرم رضایتنامه شرکت در این پژوهش به صورت تصادفی به دو گروه تمرین مقاومتی (12 نفر) و گروه کنترل (12 نفر) تقسیم شدند. ابتدا پرسشنامه سلامت عمومی، سطح فعالیت بدنی و پیشینه پزشکی برای ارزیابی وضعیت اولیه توسط آزمودنیها تکمیل شد. سپس قد و وزن بر مبنای فرمولی که در ادامه آمده است و متوسط روزانه فشار خون سیستولیک و دیاستولیک اندازهگیری شد و پزشک ضربان قلب استراحت همگی را در ساعت 8 تا 9 صبح، با دستگاه بیورر ساخت آلمان با دقت 1/0 میلیمتر جیوه در محل برگزاری تمرینات اندازهگیری کرد.
اندازهگیری نیتریکاکساید
48 ساعت قبل و بعد از هشت هفته تمرین مقاومتی، از هر داوطلب 5 سیسی خون از ورید قدامی بازویی گرفته شد. خونگیری رأس ساعت 8 صبح و پس از 12 ساعت، در حالی که آزمودنیها ناشتا بودند، در اتاق پزشک سرای سالمندان انجام شد. نمونهخونهایی که قبل از شروع برنامه تمرین مقاومتی، گرفته شده بودند، بلافاصله به آزمایشگاه فرستاده شدند و مطابق دستورالعمل کیت تخصصی استفادهشده، پلاسمای آنها با سانتریفیوژ جداسازی و در دمای منهای 70 درجه سانتیگراد فریز شد. پس از گرفتن نمونه خونها در 8 هفته تمرین مقاومتی، و جداسازی پلاسمای آن، نمونهها برای تجزیهوتحلیل، به صورت یکجا به آزمایشگاه تشخیص طبی ارسال شد تا غلظت نیتریکاکساید را با استفاده از کیت الایزا (ساخت شرکت گلوریِ آمریکا) با دقت یکدهم میکرومول بر لیتر (µmol/L) اندازهگیری شود.
برنامه تمرین مقاومتی
پس از ارزیابی سطح آمادگی بدنی آزمودنیها، گروه تجربی 8 هفته، هر هفته سه جلسه و در هر جلسه حدود 60 دقیقه در تمرینهای مقاومتی شرکت کردند. برنامۀ تمرین شامل 10 دقیقه گرمکردن با انواع حرکات کششی و نرمشی و سپس انجام 10 حرکت ایستگاهی به صورت دایرهای در 30 تا 40 دقیقه بود. در انتها نیز 10 دقیقه سردکردن در نظر گرفته شد. ایستگاهها شامل 10 نوع تمرین مقاومتی (پرس پا، پرس سینه، پرس شانه، جلوبازو، پشتبازو، لتپول، اکستنشن زانو (چهارسر ران)، خمکردن زانو (سرینی و همسترینگ)، بلندشدن روی پاشنه (تقویت عضله دوقلو)، و درازنشست بود. برنامۀ تمرین در هر جلسه شامل3 دور با 12 تکرار و با شدت 40 تا 65 درصد یک تکرار بیشینه بود. زمان استراحت بین ایستگاهها، 45 تا 60 ثانیه و زمان استراحت بین هر دور 90 ثانیه در نظر گرفته شد. اصل اضافهبار به گونهای طراحی شد که بعد از هر شش جلسه تمرین، یک آزمون یک تکرار بیشینه برای هر فرد در هر ایستگاه انجام شد و 5 درصد وزنه به آن اضافه شد [29 ،28]. برای تعیین یک تکرار بیشینه از فرمول زیر استفاده شد [29]:
گفتنی است برنامه تمرینی این تحقیق با توجه به برنامه کادوره و همکاران [30] که در افراد سالمند به کار گرفته شده بود، طراحی شد. همچنین در این پژوهش به توصیههای ویژه کالج آمریکایی طب ورزش [29 ،28] برای افراد سالمند توجه شد [30] و کمیته مستقل اخلاق گروه تربیت بدنی دانشگاه شهرکرد در جلسه خود این تحقیق را تأیید کردند. در طول تمرین، تمام مراحل تمرین با نظارت مستقیم مربی ویژه آمادگی جسمانی و بدنسازی خانم اجرا شد.
محدودیتهای این تحقیق شامل دو دسته بود: محدودیتهای قابلکنترل و محدودیتهای کنترلنشدنی. محدودیتهای کنترلشده شامل جنسیت، سن و سلامت عمومی بود. همه آزمودنیها زنان سالمند، در گروه سنی 60 تا 75 سال و فاقد سابقه بیماری حاد بودند و سلامت نسبی داشتند. محدودیتهای کنترلنشدنی نیز شامل کنترلنکردن کامل رژیم غذایی آزمودنیها، کنترلنکردن هیجان و اضطراب آزمودنیها، تفاوتهای فردی از نظر خصوصیات ژنتیکی و ویژگیهای وراثتی آنها در اندازهگیری برخی شاخصها، تفاوت فردی آزمودنیها از نظر وضعیت روحی و روانی در جلسات تمرین و عدم امکان کنترل کامل احتمال ابتلا به بیماری یا آسیب هنگام اجرای تحقیق بود.
یافتهها
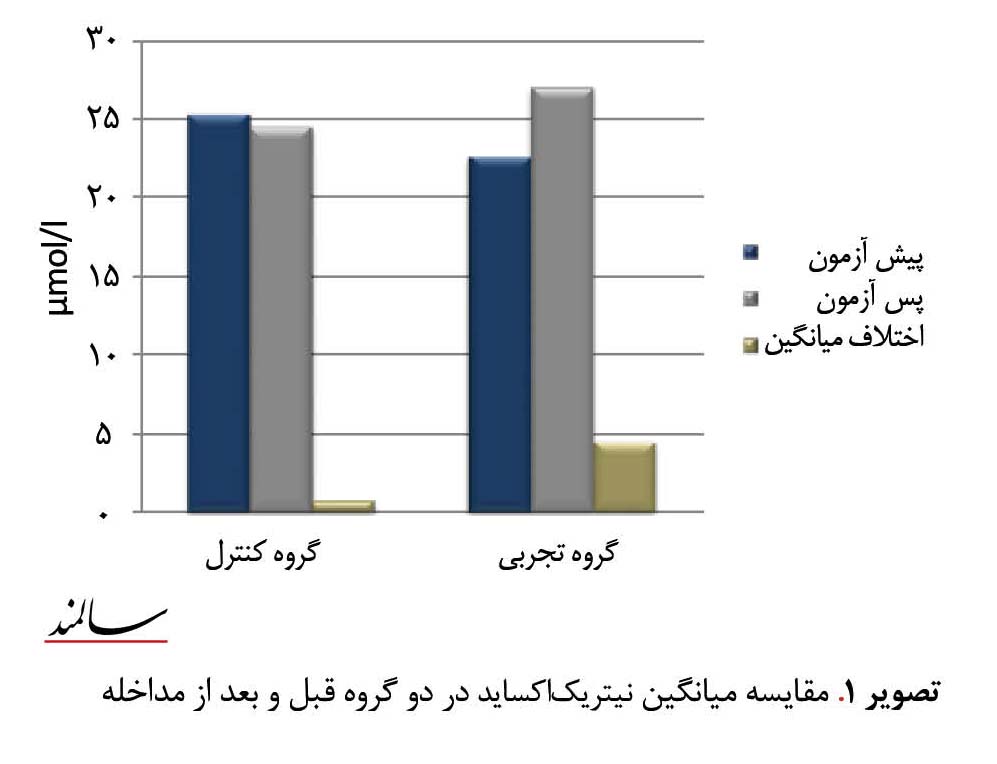
مشخصات عمومی آزمودنیها قبل و بعد از هشت هفته تمرین مقاومتی اندازهگیری شد که به طور مختصر در جدول شماره 1 گزارش شده است. بر اساس یافتههای جدول شماره 1 مقدار P در گروه تجربی برای نیتریکاکساید 0/008 و برای فشار خون سیستولیک و دیاستولیک به ترتیب 0/006 و 0/002 است. همانطور که در جدول شماره 1 مشاهده میشود، با توجه به اینکه مقدار P کمتر از 0/05 است، اختلاف میانگین نیتریکاکساید در پیشآزمون و پسآزمون گروه تجربی معنیدار بوده است؛ در حالی که در گروه کنترل برای نیتریکاکساید 0/745=P و برای فشار خون سیستولیک و دیاستولیک به ترتیب 0/495 و 0/318است که بیشتر از سطح معنیداری [0/05=α] است و این یعنی اختلاف معنیداری در پیشآزمون و پسآزمون نیست. مقایسه میانگین نیتریکاکساید در دو گروه قبل و بعد از مداخله در تصویر شماره 1 آمده است.
محدودیتهای این تحقیق شامل دو دسته بود: محدودیتهای قابلکنترل و محدودیتهای کنترلنشدنی. محدودیتهای کنترلشده شامل جنسیت، سن و سلامت عمومی بود. همه آزمودنیها زنان سالمند، در گروه سنی 60 تا 75 سال و فاقد سابقه بیماری حاد بودند و سلامت نسبی داشتند. محدودیتهای کنترلنشدنی نیز شامل کنترلنکردن کامل رژیم غذایی آزمودنیها، کنترلنکردن هیجان و اضطراب آزمودنیها، تفاوتهای فردی از نظر خصوصیات ژنتیکی و ویژگیهای وراثتی آنها در اندازهگیری برخی شاخصها، تفاوت فردی آزمودنیها از نظر وضعیت روحی و روانی در جلسات تمرین و عدم امکان کنترل کامل احتمال ابتلا به بیماری یا آسیب هنگام اجرای تحقیق بود.
یافتهها
مشخصات عمومی آزمودنیها قبل و بعد از هشت هفته تمرین مقاومتی اندازهگیری شد که به طور مختصر در جدول شماره 1 گزارش شده است. بر اساس یافتههای جدول شماره 1 مقدار P در گروه تجربی برای نیتریکاکساید 0/008 و برای فشار خون سیستولیک و دیاستولیک به ترتیب 0/006 و 0/002 است. همانطور که در جدول شماره 1 مشاهده میشود، با توجه به اینکه مقدار P کمتر از 0/05 است، اختلاف میانگین نیتریکاکساید در پیشآزمون و پسآزمون گروه تجربی معنیدار بوده است؛ در حالی که در گروه کنترل برای نیتریکاکساید 0/745=P و برای فشار خون سیستولیک و دیاستولیک به ترتیب 0/495 و 0/318است که بیشتر از سطح معنیداری [0/05=α] است و این یعنی اختلاف معنیداری در پیشآزمون و پسآزمون نیست. مقایسه میانگین نیتریکاکساید در دو گروه قبل و بعد از مداخله در تصویر شماره 1 آمده است.
نتایج آزمون t مستقل، برای مقایسه اختلاف پسآزمون نیتریکاکساید بین گروه تجربی و کنترل در جدول شماره 2 آمده است. با توجه به اینکه مقدار P بهدستآمده در جدول شماره 2، 0/01 و کمتر از [0/05=α] است، تفاوت معنیداری بین میانگینها و بین اختلاف غلظتها وجود دارد. به عبارت دیگر دخالت متغیر مستقل [تمرین مقاومتی] در افزایش نیتریکاکساید گروه تجربی تأثیر معنیداری داشته است؛ بنابراین هشت هفته تمرین مقاومتی تأثیر معنیداری بر افزایش نیتریکاکساید زنان سالمند دارد.
در بررسی رابطه بین متغیرها در جدول شماره 3، بین غلظت نیتریکاکساید و فشار خون سیستولیک ضریب همبستگیِ 0/582 به دست آمد که نشاندهنده همبستگی معنیدار (در جدول با * مشخص است) و ارتباط مستقیم بین افزایش غلظت نیتریکاکساید پلاسما و کاهش فشار خون سیستولیک است. با این حال، بین غلظت نیتریکاکساید و فشار خون دیاستولیک ضریب همبستگیِ 0/257 به دست آمد که نشاندهنده همبستگی پایین و غیرمعنیدار بین افزایش غلظت نیتریکاکساید پلاسما و کاهش فشار خون دیاستولیک است.
بحث
همانطور که نتایج این تحقیق نشان داد، 8 هفته تمرین مقاومتی تأثیر معنیداری بر افزایش غلظت نیتریکاکساید پلاسمای زنان سالمند داشت. برخی بررسیها نشان میدهند فعالیت ورزشی باعث افزایش نیتریکاکساید میشود، در حالی که برخی دیگر نشان دادهاند فعالیت بدنی باعث کاهش نیتریکاکساید میشود. گوزل و همکاران تأثیر یک جلسه تمرین مقاومتی با شدت زیاد و کم را بر 20 مرد تمریننکرده بررسی کردند. نتایج تحقیق آنان نشان داد تمرین مقاومتی شدید، سطح نیتریکاکساید را افزایش میدهد. همچنین تمرین مقاومتی با شدت زیاد در مقایسه با تمرین مقاومتی با شدت کم، موجب افزایش بیشتری در تولید رادیکالهای آزاد میشود [31].
همچنین زاورس و همکاران تأثیر شش ماه تمرین ورزشی را بر سطح متابولیتهای نیتریکاکساید زنان پرفشار خون بررسی کردند. در این تحقیق 11 زن مبتلا به پُرفشاری خون سه روز در هفته، هر جلسه 60 دقیقه با 50 درصد ضربان قلب ذخیرهای فعالیت کردند. نتایج نشان داد ورزش باعث افزایش متابولیتهای نیتریکاکساید و درنتیجه کاهش فشارخون سیستول و دیاستول میشود [27]. در حالی که هریس و همکاران تأثیر 10 هفته برنامه شدید ورزشی، شامل دویدن روی تردمیل با سرعت 30 متر بر دقیقه و شیب 5 درصد به مدت یک ساعت در هر جلسه را بر 20 سر موش بررسی و مشاهده کردند این تمرینات تأثیری بر نیتریکاکساید عضله سولئوس ندارد [32]. همچنین سونگ و همکاران تأثیر 12 هفته تمرین ورزشی روی تردمیل را بررسی کردند و گیلن و همکاران تأثیر شش ماه فعالیت هوازی را بر مردانی که بیماری قلبی داشتند بررسی کردند. در هر دو تحقیق مذکور تمرین ورزشی باعث کاهش معنیدار نیتریکاکساید شد [34 ،33]. به نظر میرسد علت اختلاف در نتایج را میتوان با شدت، مدت و نوع برنامه تمرینات بدنی، تغذیه بیماران، میزان آمادگی اولیه افراد، تفاوتهای فردی و سن آزمودنیها مرتبط دانست.
تجربیات و تحقیقات در 10 سال گذشته نشان میدهد نیتریکاکساید ماده واسطهای مهمی در انواع اعمال فیزیولوژیک مانند تنظیم فشار خون و گشادشدن عروق و انتقال جریانات عصبی است [33 ،32]. بعد از اینکه فورگات و زاوادزکی کشف ماده اندوتلیوم را کشف کردند، فعالیتهای پژوهشی گستردهای روی گشادکنندههای عروقی انجام شده است. در این پژوهشها اشاره شده است این گشادکنندهها در اثر پرخونی موضعی به وجود میآیند [30].
در سال 1986 میلادی فورگات و همکاران اعلام کردند عامل شلکننده مشتق از اندوتلیوم از نظر ساختار شیمیایی همان نیتریکاکساید است [30]. در تمامی طبقهبندیهای موجود از این محرکهای عمومی، به افزایش سطح کلسیم یونیزه داخل سلولی در سلولهای اندوتلیوم اشاره شده است. این کاتیون با دو بارِ مثبت برای عمل آنزیم نیتریکاکساید و سنتز اصلی در تبدیل اسید آمینه الآرژینین به سیترونین و نیتریکاکساید یک کوفاکتور لازم و ضروری است. نیتریکاکسایدی که از این واکنش تشکیل میشود در داخل سلولهای عضلات صاف عروق منتشر و در این سلولها به فعالشدن آنزیم گوانیلات سیکلاز منجر میشود. با فعالشدن این آنزیم، ترکیب گوانوزین مونوفسفات حلقوی ازگوانوزین تریفسفات تشکیل میشود. همچنین آنزیم گوانیلات سیکلاز به وسیله مواد آلی گشادکننده عروق همچون داروی نیتروگلیسیرین و ترکیبات غیرآلی مانند سدیم نیتروپروساید میتواند به طور مستقیم فعال شود. با افزایش سطح گوانوزین مونوفسفات حلقوی داخل سلولهای عضلات صاف جدار عروق، برداشت کلسیم یونیزه توسط شبکه سارکوپلاسمیک افزایش مییابد. این موضوع حساسیت زنجیره کوتاه میوزین به کلسیم یونیزه را کاهش میدهد؛ درنتیجه موجب افزایش شلشدن عضلات صاف جدار رگها و کاهش فشار درونرگی و متعاقب آن اتساع سیستم شریانی میشود [35 ،30].
همچنین مطالعات دیگر نشان دادند نیتریکاکساید در هنگام ورزش عامل بسیار مهمی است و حین ورزش این عامل میتواند بسیاری از محدودیتهایی را که ممکن است از نظر وریدی وجود داشته باشد، بهبود بخشد و همچنین بر عوامل متابولیک نیز مؤثر باشد [36]. دلف و همکاران و گرین و همکاران در پژوهششان با استفاده از رژیم غذایی و انجام فعالیت تمرینی هوازی دویدن با شدتهای گوناگون دریافتند سطح نیتریت و نیترات پلاسما در هر دو گروه ورزشکار و غیرورزشکار در مقایسه با میزان سطح اولیه افزایش یافته بود [38 ،37]. این نتیجه با یافتههای جانگرستن و همکاران که معتقدند نیترین و نیترات و درنتیجه نیتریکاکساید با افزایش مدت و شدت تمرینات جسمانی به طور معنیداری افزایش مییابد، همخوانی دارد. نتایج این پژوهش، نشان داد نیترات پلاسمای ساکن (ایستا) در افراد ورزشکار بیشتر از افراد غیرورزشکار گروه کنترل بود [39]. در ضمن افزایش تولید نیتریکاکسایدِ پایه در افرادی که فعالیتهای بدنی و تمرینات ورزشی دارند موجب کاهش پاسخهای مقاومت محیطی عروقی میشود [40]. اکثر موارد مذکور بر تمرینات هوازی تکیه داشتند و کمتر دیده شده تأثیرات تمرین مقاومتی سنجیده شود.
نتیجه دیگر پژوهش پیش رو نشان داد انجام هشت هفته تمرین مقاومتی موجب کاهش معنیداری در فشار خون سیستولیک و دیاستولیک زنان سالمند میشود. نتایج این پژوهش با مطالعه کریستن و جوهانسن [41] که در تحقیق خود کاهش و کنترل فشار خون را بعد از یک ورزش هوازی در بیماران کلیوی گزارش دادهاند، با نتیجه گزارش اسملتزر و همکاران [42] که بیانگر کاهش فشار خون سیستولیک در بیماران مبتلا به فشار خون با فعالیت فیزیکی بود و با نتایج یانگ و همکاران [43] و اینس و همکاران [44] همراستا، ولی با نتایج مایلر و همکاران [45] که مشاهده کردند پس از شش ماه فعالیت بدنی، هیچ تغییر معنیداری در میزان فشارخون وجود نداشت و همچنین با نتایج هوردون و همکاران [46] همراستا نبود. تفاوت بین آن پژوهشها و پژوهش پیشِ رو را میتوان به تفاوت بین شدت و مدت برنامههای تمرینی، سن، جنسیت، سطح آمادگی و وضعیت سلامت آزمودنیها نسبت داد.
کاهش فشار خون میتواند به دلیل کاهش کاتکولامینهای تولیدشده بر اثر تمرین باشد. این واکنش در کاهش مقاومت محیطی در برابر جریان خون و متعاقب آن کمشدن فشار خون سهیم است. همچنین فعالیتهای ورزشی میتواند دفع سدیم از کلیهها را تسهیل کند و درنتیجه سبب کاهش حجم مایع و فشارخون شود [47]. به نظر میرسد فعالیتهای ورزشی میتوانند با افزایش تعداد مویرگها در عضلات اسکلتی فعال، افزایش برونده، کاهش مقاومت عروق به علت اتساعپذیری، کاهش مقاومت در برابر جریان خون، بهبود تنظیم عصبی عروق خونی، کاهش مقاومت محیطی وکاهش ضربان قلب در زمان استراحت و فعالیت، باعث کاهش فشارخون شود [48]. این سازگاریها، سطح عرضی حفره را افزایش میدهد و موجب بهبود اتساع عروق میشود، بهطوریکه با افزایش جریان خون هنگام ورزشکردن میتوان فرایند حذف مواد زائد را ایجاد کرد که این در بهبود و کنترل فشارخون مؤثر است [49].
نتیجهگیری نهایی
به طور کلی نتایج این تحقیق نشان داد تمرینهای مقاومتی با 40 تا 65 درصد یک تکرار بیشینه کاهش معنیداری در فشار خون سیستولیک و دیاستولیک دارند و نیز باعث افزایشی معنیدار در مقادیر نیتریکاکساید به عنوان شاخص مهم برای جلوگیری از بیماریهای قلبیعروقی بهخصوص آترواسکلروز و پرفشاری خون میشوند. از طرف دیگر، تمرینهای منظم مقاومتی ضمن کاهش فشار خون دیاستولیک، با افزایش نیتریکاکساید میتوانند باعث کاهش سطح فشار خون سیستولیک و پیشگیری یا کمک به درمان آترواسکلروز شوند. بنابراین این نوع ورزش مقاومتی به افراد مسن و افرادی که از مشکلاتی مانند پرفشاری خون رنج میبرند توصیه میشود.
تشکر و قدردانی
این مقاله حامی مالی ندارد.
همانطور که نتایج این تحقیق نشان داد، 8 هفته تمرین مقاومتی تأثیر معنیداری بر افزایش غلظت نیتریکاکساید پلاسمای زنان سالمند داشت. برخی بررسیها نشان میدهند فعالیت ورزشی باعث افزایش نیتریکاکساید میشود، در حالی که برخی دیگر نشان دادهاند فعالیت بدنی باعث کاهش نیتریکاکساید میشود. گوزل و همکاران تأثیر یک جلسه تمرین مقاومتی با شدت زیاد و کم را بر 20 مرد تمریننکرده بررسی کردند. نتایج تحقیق آنان نشان داد تمرین مقاومتی شدید، سطح نیتریکاکساید را افزایش میدهد. همچنین تمرین مقاومتی با شدت زیاد در مقایسه با تمرین مقاومتی با شدت کم، موجب افزایش بیشتری در تولید رادیکالهای آزاد میشود [31].
همچنین زاورس و همکاران تأثیر شش ماه تمرین ورزشی را بر سطح متابولیتهای نیتریکاکساید زنان پرفشار خون بررسی کردند. در این تحقیق 11 زن مبتلا به پُرفشاری خون سه روز در هفته، هر جلسه 60 دقیقه با 50 درصد ضربان قلب ذخیرهای فعالیت کردند. نتایج نشان داد ورزش باعث افزایش متابولیتهای نیتریکاکساید و درنتیجه کاهش فشارخون سیستول و دیاستول میشود [27]. در حالی که هریس و همکاران تأثیر 10 هفته برنامه شدید ورزشی، شامل دویدن روی تردمیل با سرعت 30 متر بر دقیقه و شیب 5 درصد به مدت یک ساعت در هر جلسه را بر 20 سر موش بررسی و مشاهده کردند این تمرینات تأثیری بر نیتریکاکساید عضله سولئوس ندارد [32]. همچنین سونگ و همکاران تأثیر 12 هفته تمرین ورزشی روی تردمیل را بررسی کردند و گیلن و همکاران تأثیر شش ماه فعالیت هوازی را بر مردانی که بیماری قلبی داشتند بررسی کردند. در هر دو تحقیق مذکور تمرین ورزشی باعث کاهش معنیدار نیتریکاکساید شد [34 ،33]. به نظر میرسد علت اختلاف در نتایج را میتوان با شدت، مدت و نوع برنامه تمرینات بدنی، تغذیه بیماران، میزان آمادگی اولیه افراد، تفاوتهای فردی و سن آزمودنیها مرتبط دانست.
تجربیات و تحقیقات در 10 سال گذشته نشان میدهد نیتریکاکساید ماده واسطهای مهمی در انواع اعمال فیزیولوژیک مانند تنظیم فشار خون و گشادشدن عروق و انتقال جریانات عصبی است [33 ،32]. بعد از اینکه فورگات و زاوادزکی کشف ماده اندوتلیوم را کشف کردند، فعالیتهای پژوهشی گستردهای روی گشادکنندههای عروقی انجام شده است. در این پژوهشها اشاره شده است این گشادکنندهها در اثر پرخونی موضعی به وجود میآیند [30].
در سال 1986 میلادی فورگات و همکاران اعلام کردند عامل شلکننده مشتق از اندوتلیوم از نظر ساختار شیمیایی همان نیتریکاکساید است [30]. در تمامی طبقهبندیهای موجود از این محرکهای عمومی، به افزایش سطح کلسیم یونیزه داخل سلولی در سلولهای اندوتلیوم اشاره شده است. این کاتیون با دو بارِ مثبت برای عمل آنزیم نیتریکاکساید و سنتز اصلی در تبدیل اسید آمینه الآرژینین به سیترونین و نیتریکاکساید یک کوفاکتور لازم و ضروری است. نیتریکاکسایدی که از این واکنش تشکیل میشود در داخل سلولهای عضلات صاف عروق منتشر و در این سلولها به فعالشدن آنزیم گوانیلات سیکلاز منجر میشود. با فعالشدن این آنزیم، ترکیب گوانوزین مونوفسفات حلقوی ازگوانوزین تریفسفات تشکیل میشود. همچنین آنزیم گوانیلات سیکلاز به وسیله مواد آلی گشادکننده عروق همچون داروی نیتروگلیسیرین و ترکیبات غیرآلی مانند سدیم نیتروپروساید میتواند به طور مستقیم فعال شود. با افزایش سطح گوانوزین مونوفسفات حلقوی داخل سلولهای عضلات صاف جدار عروق، برداشت کلسیم یونیزه توسط شبکه سارکوپلاسمیک افزایش مییابد. این موضوع حساسیت زنجیره کوتاه میوزین به کلسیم یونیزه را کاهش میدهد؛ درنتیجه موجب افزایش شلشدن عضلات صاف جدار رگها و کاهش فشار درونرگی و متعاقب آن اتساع سیستم شریانی میشود [35 ،30].
همچنین مطالعات دیگر نشان دادند نیتریکاکساید در هنگام ورزش عامل بسیار مهمی است و حین ورزش این عامل میتواند بسیاری از محدودیتهایی را که ممکن است از نظر وریدی وجود داشته باشد، بهبود بخشد و همچنین بر عوامل متابولیک نیز مؤثر باشد [36]. دلف و همکاران و گرین و همکاران در پژوهششان با استفاده از رژیم غذایی و انجام فعالیت تمرینی هوازی دویدن با شدتهای گوناگون دریافتند سطح نیتریت و نیترات پلاسما در هر دو گروه ورزشکار و غیرورزشکار در مقایسه با میزان سطح اولیه افزایش یافته بود [38 ،37]. این نتیجه با یافتههای جانگرستن و همکاران که معتقدند نیترین و نیترات و درنتیجه نیتریکاکساید با افزایش مدت و شدت تمرینات جسمانی به طور معنیداری افزایش مییابد، همخوانی دارد. نتایج این پژوهش، نشان داد نیترات پلاسمای ساکن (ایستا) در افراد ورزشکار بیشتر از افراد غیرورزشکار گروه کنترل بود [39]. در ضمن افزایش تولید نیتریکاکسایدِ پایه در افرادی که فعالیتهای بدنی و تمرینات ورزشی دارند موجب کاهش پاسخهای مقاومت محیطی عروقی میشود [40]. اکثر موارد مذکور بر تمرینات هوازی تکیه داشتند و کمتر دیده شده تأثیرات تمرین مقاومتی سنجیده شود.
نتیجه دیگر پژوهش پیش رو نشان داد انجام هشت هفته تمرین مقاومتی موجب کاهش معنیداری در فشار خون سیستولیک و دیاستولیک زنان سالمند میشود. نتایج این پژوهش با مطالعه کریستن و جوهانسن [41] که در تحقیق خود کاهش و کنترل فشار خون را بعد از یک ورزش هوازی در بیماران کلیوی گزارش دادهاند، با نتیجه گزارش اسملتزر و همکاران [42] که بیانگر کاهش فشار خون سیستولیک در بیماران مبتلا به فشار خون با فعالیت فیزیکی بود و با نتایج یانگ و همکاران [43] و اینس و همکاران [44] همراستا، ولی با نتایج مایلر و همکاران [45] که مشاهده کردند پس از شش ماه فعالیت بدنی، هیچ تغییر معنیداری در میزان فشارخون وجود نداشت و همچنین با نتایج هوردون و همکاران [46] همراستا نبود. تفاوت بین آن پژوهشها و پژوهش پیشِ رو را میتوان به تفاوت بین شدت و مدت برنامههای تمرینی، سن، جنسیت، سطح آمادگی و وضعیت سلامت آزمودنیها نسبت داد.
کاهش فشار خون میتواند به دلیل کاهش کاتکولامینهای تولیدشده بر اثر تمرین باشد. این واکنش در کاهش مقاومت محیطی در برابر جریان خون و متعاقب آن کمشدن فشار خون سهیم است. همچنین فعالیتهای ورزشی میتواند دفع سدیم از کلیهها را تسهیل کند و درنتیجه سبب کاهش حجم مایع و فشارخون شود [47]. به نظر میرسد فعالیتهای ورزشی میتوانند با افزایش تعداد مویرگها در عضلات اسکلتی فعال، افزایش برونده، کاهش مقاومت عروق به علت اتساعپذیری، کاهش مقاومت در برابر جریان خون، بهبود تنظیم عصبی عروق خونی، کاهش مقاومت محیطی وکاهش ضربان قلب در زمان استراحت و فعالیت، باعث کاهش فشارخون شود [48]. این سازگاریها، سطح عرضی حفره را افزایش میدهد و موجب بهبود اتساع عروق میشود، بهطوریکه با افزایش جریان خون هنگام ورزشکردن میتوان فرایند حذف مواد زائد را ایجاد کرد که این در بهبود و کنترل فشارخون مؤثر است [49].
نتیجهگیری نهایی
به طور کلی نتایج این تحقیق نشان داد تمرینهای مقاومتی با 40 تا 65 درصد یک تکرار بیشینه کاهش معنیداری در فشار خون سیستولیک و دیاستولیک دارند و نیز باعث افزایشی معنیدار در مقادیر نیتریکاکساید به عنوان شاخص مهم برای جلوگیری از بیماریهای قلبیعروقی بهخصوص آترواسکلروز و پرفشاری خون میشوند. از طرف دیگر، تمرینهای منظم مقاومتی ضمن کاهش فشار خون دیاستولیک، با افزایش نیتریکاکساید میتوانند باعث کاهش سطح فشار خون سیستولیک و پیشگیری یا کمک به درمان آترواسکلروز شوند. بنابراین این نوع ورزش مقاومتی به افراد مسن و افرادی که از مشکلاتی مانند پرفشاری خون رنج میبرند توصیه میشود.
تشکر و قدردانی
این مقاله حامی مالی ندارد.
References
- Turk JR, Laughlin MH. Physical activity and atherosclerosis: which animal model? Canadian Journal of Applied Physiology. 2004; 29(5):657–83. doi: 10.1139/h04-042
- Lakatta EG, Levy D. Arterial and cardiac aging: Major shareholders in cardiovascular disease enterprises: Part I: Aging arteries: A “set up” for vascular disease. Circulation. 2003; 107(1):139–46. doi: 10.1161/01.cir.0000048892.83521.58
- Hagobian TA, Jacobs KA, Subudhi AW, Fattor JA, Rock PB, Muza SR, et al. Cytokine responses at high altitude: Effects of exercise and antioxidants at 4300 m. Medicine & Science in Sports & Exercise. 38(2):276-85. doi: 10.1249/01.mss.0000188577.63910.51
- Kanaley JA, Sames C, Swisher L, Swick AG, Ploutz-Snyder LL, Steppan CM, et al. Abdominal fat distribution in pre- and postmenopausal women: The impact of physical activity, age, and menopausal status. Metabolism. 2001; 50(8):976–82. doi: 10.1053/meta.2001.24931
- Marques E, Carvalho J, Soares JMC, Marques F, Mota J. Effects of resistance and multicomponent exercise on lipid profiles of older women. Maturitas. 2009; 63(1):84–8. doi: 10.1016/j.maturitas.2009.03.003
- Sharman MJ, Volek JS. Weight loss leads to reductions in inflammatory biomarkers after a very-low-carbohydrate diet and a low-fat diet in overweight men. Clinical Science. 2004; 107(4):365–9. doi: 10.1042/cs20040111
- Moncada S, Palmer RM, Higgs EA. Nitric oxide: Physiology, pathophysiology, and pharmacology. Pharmacological Reviews, 1991; 43(2):109-42. PMID: 1852778
- Wang JS. Effects of exercise training and detraining on cutaneous microvascular function in man: The regulatory role of endothelium-dependent dilation in skin vasculature. European Journal of Applied Physiology. 2004; 93(4):429–34. doi: 10.1007/s00421-004-1176-4
- Fuchsjager-Mayrl G, Pleiner J, Wiesinger GF, Sieder AE, Quittan M, Nuhr MJ, et al. Exercise training improves vascular endothelial function in patients with type 1 diabetes. Diabetes Care. 2002; 25(10):1795–801. doi: 10.2337/diacare.25.10.1795
- Davis PG, Bartoli WP, Durstine JL. Effects of acute exercise intensity on plasma lipids and apolipoproteins in trained runners. Journal of Applied Physiology. 1992; 72(3):914–9. doi: 10.1152/jappl.1992.72.3.914
- Koivisto VA, Eriksson J, Taimela S. Exercise and the metabolic syndrome. Diabetologia. 1997; 40(2):125–35. doi: 10.1007/s001250050653
- Poehlman ET, Dvorak RV, DeNino WF, Brochu M, Ades PA. Effects of resistance training and endurance training on insulin sensitivity in nonobese, young women: A controlled randomized trial. Journal of Clinical Endocrinology & Metabolism. 2000; 85(7):2463–8. doi: 10.1210/jcem.85.7.6692
- Miyauchi T, Masaki T. Pathophysiology of endothelin in the cardiovascular system. Annual Review of Physiology. 1999; 61(1):391–415. doi: 10.1146/annurev.physiol.61.1.391
- Donato A, Lesniewski L, Delp M. The effects of aging and exercise training on endothelin-1 vasoconstrictor responses in rat skeletal muscle arterioles. Cardiovascular Research. 2005; 66(2):393–401. doi: 10.1016/j.cardiores.2004.10.023
- Wennmalm A, Benthin G, Edlund A, Kieler-Jenson N, Lundin S, Petersson AS, et al. Nitric Oxide Synthesis and Metabolism in Man. Annals of the New York Academy of Sciences. 1994; 714(1):158–64. doi: 10.1111/j.1749-6632.1994.tb12040.x
- Rubanyi GM, Vanhoutte PM. Oxygen-derived free radicals, endothelium, and responsiveness of vascular smooth muscle. American Journal of Physiology-Heart and Circulatory Physiology. 1986; 250(5):H815–H821. doi: 10.1152/ajpheart.1986.250.5.h815
- Ku DD, Zaleski JK, Liu S, Brock TA. Vascular endothelial growth factor induces EDRF-dependent relaxation in coronary arteries. American Journal of Physiology-Heart and Circulatory Physiology. 1993; 265(2):H586–H592. doi: 10.1152/ajpheart.1993.265.2.h58
- Horowitz JR, Rivard A, van der Zee R, Hariawala M, Sheriff DD, Esakof DD, et al. Vascular endothelial growth factor vascular permeability factor produces nitric oxide-dependent hypotension-evidence for a maintenance role in quiescent adult endothelium. Arteriosclerosis, Thrombosis, and Vascular Biology. 1997; 17(11):2793–800. doi: 10.1161/01.atv.17.11.2793
- Chou TC, Yen MH, Li CY, Ding YA. Alterations of nitric oxide synthase expression with aging and hypertension in rats. Hypertension. 1998; 31(2):643–8. doi: 10.1161/01.hyp.31.2.643
- Taddei S, Virdis A, Ghiadoni L, Salvetti G, Bernini G, Magagna A, et al. Age-related reduction of NO availability and oxidative stress in humans. Hypertension. 2001; 38(2):274–9. doi: 10.1161/01.hyp.38.2.274
- Loscalzo J. Nitric oxide insufficiency, platelet activation, and arterial thrombosis. Circulation Research. 2001; 88(8):756–62. doi: 10.1161/hh0801.089861
- Garg UC, Hassid A. Nitric oxide-generating vasodilators and 8-bromo-cyclic guanosine monophosphate inhibit mitogenesis and proliferation of cultured rat vascular smooth muscle cells. Journal of Clinical Investigation. 1989; 83(5):1774–7. doi: 10.1172/jci114081
- Danilov AI, Andersson M, Bavand N, Wiklund NP, Olsson T, Brundin L. Nitric oxide metabolite determinations reveal continuous inflammation in multiple sclerosis. Journal of Neuroimmunology. 2003; 136(1-2):112–8. doi: 10.1016/s0165-5728(02)00464-2
- Kahl KG, Zielasek J, Uttenthal LO, Rodrigo J, Toyka KV, Schmidt HHHW. Protective role of the cytokine-inducible isoform of nitric oxide synthase induction and nitrosative stress in experimental autoimmune encephalomyelitis of the DA rat. Journal of Neuroscience Research. 2003; 73(2):198–205. doi: 10.1002/jnr.10649
- Yang AL, Tsai SJ, Jiang MJ, Jen CJ, Chen H. Chronic exercise increases both inducible and endothelial nitric oxide synthase gene expression in endothelial cells of rat aorta. Journal of Biomedical Science. 2002; 9(2):149–55. doi: 10.1007/bf02256026
- Kingwell BA. Nitric oxide-mediated metabolic regulation during exercise: effects of training in health and cardiovascular disease. The FASEB Journal. 2000; 14(12):1685–96. doi: 10.1096/fj.99-0896rev
- Zaros PR, Pires CER, Bacci M, Moraes C, Zanesco A. Effect of 6-months of physical exercise on the nitrate/nitrite levels in hypertensive postmenopausal women. BMC Women’s Health. 2009; 9(1). doi: 10.1186/1472-6874-9-17
- Engelke KA, Halliwill JR, Proctor DN, Dietz NM, Joyner MJ. Contribution of nitric oxide and prostaglandins to reactive hyperemia in the human forearm. Journal of Applied Physiology. 1996; 81(4):1807–14. doi: 10.1152/jappl.1996.81.4.1807
- Joyner MJ, Dietz NM. Nitric oxide and vasodilation in human limbs. Journal of Applied Physiology. 1997; 83(6):1785–96. doi: 10.1152/jappl.1997.83.6.1785
- Jungersten L, Ambring A, Wall B, Wennmalm Å. Both physical fitness and acute exercise regulate nitric oxide formation in healthy humans. Journal of Applied Physiology. 1997; 82(3):760–4. doi: 10.1152/jappl.1997.82.3.760
- Guzel NA, Hazar S, Erbas D. Effects of different resistance exercise protocols on nitric oxide, lipid peroxidation and creatine kinase activity in sedentary males. Journal of Sports Science & Medicine. 2007; 6(4):417-22. PMCID: PMC3794479
- Harris MB, Mitchell BM, Sood SG, Webb RC, Venema RC. Increased nitric oxide synthase activity and Hsp90 association in skeletal muscle following chronic exercise. European Journal of Applied Physiology. 2008; 104(5):795–802. doi: 10.1007/s00421-008-0833-4
- Song W, Kwak HB, Kim JH, Lawler JM. Exercise training modulates the nitric oxide synthase profile in skeletal muscle from old rats. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2009; 64(5):540-49. doi: 10.1093/gerona/glp021
- Gielen S, Adams V, Mobius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-inflammatory effects of exercise training in the skeletal muscle of patients with chronic heart failure. Journal of the American College of Cardiology. 2003; 42(5):861-68. doi: 10.1016/s0735-1097(03)00848-9
- Mcallister RM, Hirai T, Musch TI. ontribution of Endothelium-Derived Nitric Oxide (EDNO) to the skeletal muscle blood flow response to exercise. Medicine & Science in Sports & Exercise. 1995; 27(8):1145-51. doi: 10.1249/00005768-199508000-00007
- Arsenault BJ, Côté M, Cartier A, Lemieux I, Després JP, Ross R, et al. Effect of exercise training on cardiometabolic risk markers among sedentary, but metabolically healthy overweight or obese post-menopausal women with elevated blood pressure. Atherosclerosis. 2009; 207(2):530–3. doi: 10.1016/j.atherosclerosis.2009.05.009
- Delp MD, McAllister RM, Laughlin MH. Exercise training alters endothelium-dependent vasoreactivity of rat abdominal aorta. Journal of Applied Physiology. 1993; 75(3):1354–63. doi: 10.1152/jappl.1993.75.3.1354
- Green DJ, Cable NT, Fox C, Rankin JM, Taylor RR. Modification of forearm resistance vessels by exercise training in young men. Journal of Applied Physiology. 1994; 77(4):1829–33. doi: 10.1152/jappl.1994.77.4.1829
- Jungersten L, Ambring A, Wall B, Wennmalm Å. Both physical fitness and acute exercise regulate nitric oxide formation in healthy humans. Journal of Applied Physiology. 1997; 82(3):760–4. doi: 10.1152/jappl.1997.82.3.760
- Duncker D. Nitric oxide contributes to the regulation of vasomotor tone but does not modulate O2-consumption in exercising swine. Cardiovascular Research. 2000; 47(4):738–48. doi: 10.1016/s0008-6363(00)00143-7
- Johansen KL. Exercise and chronic kidney disease: current recommendations. Sports Medicine. 2005; 35(6):485–99. doi: 10.2165/00007256-200535060-00003
- Hinkle JL, Cheever KH. Brunner and Suddarth’s textbook of medical-surgical nursing [P. Sami, Persian Trans]. Tehran: Boshra; 2000.
- Yang K, Bernardo LM, Sereika SM, Conroy MB, Balk J, Burke LE. Utilization of 3-month Yoga program for Adults at High Risk for Type 2 Diabetes. Evidence-Based Complementary and Alternative Medicine. 2011; 2011:1–6. doi: 10.1093/ecam/nep117
- Innes KE, Vincent HK. The influence if yoga-based programs on risk profiles in adults with type 2 diabetes mellitus: A systsmatic review. Evidence-Based Complementary and Alternative Medicine. 2007; 4(4):469–86. doi: 10.1093/ecam/nel103
- Miller BW, Cress CL, Johnson ME, Nichols DH, Schnitzler MA. Exercise during hemodialysis decreases the use of antihypertensive medications. American Journal of Kidney Diseases. 2002; 39(4):828–33. doi: 10.1053/ajkd.2002.32004
- Hordern MD, Cooney LM, Beller EM, Prins JB, Marwick TH, Coombes JS. Determinants of changes in blood glucose response to short-term exercise training in patients with Type 2 diabetes. Clinical Science. 2008; 115(9):273–81. doi: 10.1042/cs20070422
- Chen HH. Effects of one-year swimming training on blood pressure and insulin sensitivity in mild hypertensive young patients. The Chinese Journal of Physiology. 2010; 53(4):185-9. doi: 10.4077/cjp.2010.amk042
- Andreazzi AE, Scomparin DX, Mesquita FP, Balbo SL, Gravena C, De Oliveira JC, et al. Swimming exercise at weaning improves glycemic control and inhibits the onset of monosodium L-glutamate-obesity in mice. Journal of Endocrinology. 2009; 201(3):351–9. doi: 10.1677/joe-08-0312
- Johansen KL. Exercise and chronic kidney disease: Current recommendations. Sports Medicine. 2005; 35(6):485–99. doi: 10.2165/00007256-200535060-00003
فهرست منابع
1. Turk JR, Laughlin MH. Physical activity and atherosclerosis: which animal model? Canadian Journal of Applied Physiology. 2004; 29(5):657–83. doi: 10.1139/h04-042 [DOI:10.1139/h04-042]
2. Lakatta EG, Levy D. Arterial and cardiac aging: Major shareholders in cardiovascular disease enterprises: Part I: Aging arteries: A "set up" for vascular disease. Circulation. 2003; 107(1):139–46. doi: 10.1161/01.cir.0000048892.83521.58 [DOI:10.1161/01.CIR.0000048892.83521.58]
3. Hagobian TA, Jacobs KA, Subudhi AW, Fattor JA, Rock PB, Muza SR, et al. Cytokine responses at high altitude: Effects of exercise and antioxidants at 4300 m. Medicine & Science in Sports & Exercise. 38(2):276-85. doi: 10.1249/01.mss.0000188577.63910.51 [DOI:10.1249/01.mss.0000188577.63910.51]
4. Kanaley JA, Sames C, Swisher L, Swick AG, Ploutz-Snyder LL, Steppan CM, et al. Abdominal fat distribution in pre- and postmenopausal women: The impact of physical activity, age, and menopausal status. Metabolism. 2001; 50(8):976–82. doi: 10.1053/meta.2001.24931 [DOI:10.1053/meta.2001.24931]
5. Marques E, Carvalho J, Soares JMC, Marques F, Mota J. Effects of resistance and multicomponent exercise on lipid profiles of older women. Maturitas. 2009; 63(1):84–8. doi: 10.1016/j.maturitas.2009.03.003 [DOI:10.1016/j.maturitas.2009.03.003]
6. Sharman MJ, Volek JS. Weight loss leads to reductions in inflammatory biomarkers after a very-low-carbohydrate diet and a low-fat diet in overweight men. Clinical Science. 2004; 107(4):365–9. doi: 10.1042/cs20040111 [DOI:10.1042/CS20040111]
7. Moncada S, Palmer RM, Higgs EA. Nitric oxide: Physiology, pathophysiology, and pharmacology. Pharmacological Reviews, 1991; 43(2):109-42. PMID: 1852778 [PMID]
8. Wang JS. Effects of exercise training and detraining on cutaneous microvascular function in man: The regulatory role of endothelium-dependent dilation in skin vasculature. European Journal of Applied Physiology. 2004; 93(4):429–34. doi: 10.1007/s00421-004-1176-4 [DOI:10.1007/s00421-004-1176-4]
9. Fuchsjager-Mayrl G, Pleiner J, Wiesinger GF, Sieder AE, Quittan M, Nuhr MJ, et al. Exercise training improves vascular endothelial function in patients with type 1 diabetes. Diabetes Care. 2002; 25(10):1795–801. doi: 10.2337/diacare.25.10.1795 [DOI:10.2337/diacare.25.10.1795]
10. Davis PG, Bartoli WP, Durstine JL. Effects of acute exercise intensity on plasma lipids and apolipoproteins in trained runners. Journal of Applied Physi-ology. 1992; 72(3):914–9. doi: 10.1152/jappl.1992.72.3.914 [DOI:10.1152/jappl.1992.72.3.914]
11. Koivisto VA, Eriksson J, Taimela S. Exercise and the metabolic syndrome. Diabetologia. 1997; 40(2):125–35. doi: 10.1007/s001250050653 [DOI:10.1007/s001250050653]
12. Poehlman ET, Dvorak RV, DeNino WF, Brochu M, Ades PA. Effects of resistance training and endurance training on insulin sensitivity in nonobese, young women: A controlled randomized trial. Journal of Clinical Endocrinology & Metabolism. 2000; 85(7):2463–8. doi: 10.1210/jcem.85.7.6692 [DOI:10.1210/jcem.85.7.6692]
13. Miyauchi T, Masaki T. Pathophysiology of endothelin in the cardiovascular system. Annual Review of Physiology. 1999; 61(1):391–415. doi: 10.1146/annurev.physiol.61.1.391 [DOI:10.1146/annurev.physiol.61.1.391]
14. Donato A, Lesniewski L, Delp M. The effects of aging and exercise training on endothelin-1 vasoconstrictor responses in rat skeletal muscle arterioles. Car-diovascular Research. 2005; 66(2):393–401. doi: 10.1016/j.cardiores.2004.10.023 [DOI:10.1016/j.cardiores.2004.10.023]
15. Wennmalm A, Benthin G, Edlund A, Kieler-Jenson N, Lundin S, Petersson AS, et al. Nitric Oxide Synthesis and Metabolism in Man. Annals of the New York Academy of Sciences. 1994; 714(1):158–64. doi: 10.1111/j.1749-6632.1994.tb12040.x [DOI:10.1111/j.1749-6632.1994.tb12040.x]
16. Rubanyi GM, Vanhoutte PM. Oxygen-derived free radicals, endothelium, and responsiveness of vascular smooth muscle. American Journal of Physiology-Heart and Circulatory Physiology. 1986; 250(5):H815–H821. doi: 10.1152/ajpheart.1986.250.5.h815 [DOI:10.1152/ajpheart.1986.250.5.H815]
17. Ku DD, Zaleski JK, Liu S, Brock TA. Vascular endothelial growth factor induces EDRF-dependent relaxation in coronary arteries. American Journal of Physiology-Heart and Circulatory Physiology. 1993; 265(2):H586–H592. doi: 10.1152/ajpheart.1993.265.2.h58
18. Horowitz JR, Rivard A, van der Zee R, Hariawala M, Sheriff DD, Esakof DD, et al. Vascular endothelial growth factor vascular permeability factor pro-duces nitric oxide-dependent hypotension-evidence for a maintenance role in quiescent adult endothelium. Arteriosclerosis, Thrombosis, and Vascular Biol-ogy. 1997; 17(11):2793–800. doi: 10.1161/01.atv.17.11.2793 [DOI:10.1161/01.ATV.17.11.2793]
19. Chou TC, Yen MH, Li CY, Ding YA. Alterations of nitric oxide synthase expression with aging and hypertension in rats. Hypertension. 1998; 31(2):643–8. doi: 10.1161/01.hyp.31.2.643 [DOI:10.1161/01.HYP.31.2.643]
20. Taddei S, Virdis A, Ghiadoni L, Salvetti G, Bernini G, Magagna A, et al. Age-related reduction of NO availability and oxidative stress in humans. Hy-pertension. 2001; 38(2):274–9. doi: 10.1161/01.hyp.38.2.274 [DOI:10.1161/01.HYP.38.2.274]
21. Loscalzo J. Nitric oxide insufficiency, platelet activation, and arterial thrombosis. Circulation Research. 2001; 88(8):756–62. doi: 10.1161/hh0801.089861 [DOI:10.1161/hh0801.089861]
22. Garg UC, Hassid A. Nitric oxide-generating vasodilators and 8-bromo-cyclic guanosine monophosphate inhibit mitogenesis and proliferation of cultured rat vascular smooth muscle cells. Journal of Clinical Investigation. 1989; 83(5):1774–7. doi: 10.1172/jci114081 [DOI:10.1172/JCI114081]
23. Danilov AI, Andersson M, Bavand N, Wiklund NP, Olsson T, Brundin L. Nitric oxide metabolite determinations reveal continuous inflammation in mul-tiple sclerosis. Journal of Neuroimmunology. 2003; 136(1-2):112–8. doi: 10.1016/s0165-5728(02)00464-2 [DOI:10.1016/S0165-5728(02)00464-2]
24. Kahl KG, Zielasek J, Uttenthal LO, Rodrigo J, Toyka KV, Schmidt HHHW. Protective role of the cytokine-inducible isoform of nitric oxide synthase induc-tion and nitrosative stress in experimental autoimmune encephalomyelitis of the DA rat. Journal of Neuroscience Research. 2003; 73(2):198–205. doi: 10.1002/jnr.10649 [DOI:10.1002/jnr.10649]
25. Yang AL, Tsai SJ, Jiang MJ, Jen CJ, Chen H. Chronic exercise increases both inducible and endothelial nitric oxide synthase gene expression in endothelial cells of rat aorta. Journal of Biomedical Science. 2002; 9(2):149–55. doi: 10.1007/bf02256026 [DOI:10.1007/BF02256026]
26. Kingwell BA. Nitric oxide-mediated metabolic regulation during exercise: effects of training in health and cardiovascular disease. The FASEB Journal. 2000; 14(12):1685–96. doi: 10.1096/fj.99-0896rev [DOI:10.1096/fj.99-0896rev]
27. Zaros PR, Pires CER, Bacci M, Moraes C, Zanesco A. Effect of 6-months of physical exercise on the nitrate/nitrite levels in hypertensive postmenopausal women. BMC Women's Health. 2009; 9(1). doi: 10.1186/1472-6874-9-17 [DOI:10.1186/1472-6874-9-17]
28. Engelke KA, Halliwill JR, Proctor DN, Dietz NM, Joyner MJ. Contribution of nitric oxide and prostaglandins to reactive hyperemia in the human forearm. Journal of Applied Physiology. 1996; 81(4):1807–14. doi: 10.1152/jappl.1996.81.4.1807 [DOI:10.1152/jappl.1996.81.4.1807]
29. Joyner MJ, Dietz NM. Nitric oxide and vasodilation in human limbs. Journal of Applied Physiology. 1997; 83(6):1785–96. doi: 10.1152/jappl.1997.83.6.1785 [DOI:10.1152/jappl.1997.83.6.1785]
30. Jungersten L, Ambring A, Wall B, Wennmalm Å. Both physical fitness and acute exercise regulate nitric oxide formation in healthy humans. Journal of Applied Physiology. 1997; 82(3):760–4. doi: 10.1152/jappl.1997.82.3.760 [DOI:10.1152/jappl.1997.82.3.760]
31. Guzel NA, Hazar S, Erbas D. Effects of different resistance exercise protocols on nitric oxide, lipid peroxidation and creatine kinase activity in sedentary males. Journal of Sports Science & Medicine. 2007; 6(4):417-22. PMCID: PMC3794479 [PMID] [PMCID]
32. Harris MB, Mitchell BM, Sood SG, Webb RC, Venema RC. Increased nitric oxide synthase activity and Hsp90 association in skeletal muscle following chronic exercise. European Journal of Applied Physiology. 2008; 104(5):795–802. doi: 10.1007/s00421-008-0833-4 [DOI:10.1007/s00421-008-0833-4]
33. Song W, Kwak HB, Kim JH, Lawler JM. Exercise training modulates the nitric oxide synthase profile in skeletal muscle from old rats. The Journals of Ger-ontology Series A: Biological Sciences and Medical Sciences. 2009; 64(5):540-49. doi: 10.1093/gerona/glp021 [DOI:10.1093/gerona/glp021]
34. Gielen S, Adams V, Mobius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-inflammatory effects of exercise training in the skeletal muscle of patients with chronic heart failure. Journal of the American College of Cardiology. 2003; 42(5):861-68. doi: 10.1016/s0735-1097(03)00848-9 [DOI:10.1016/S0735-1097(03)00848-9]
35. Mcallister RM, Hirai T, Musch TI. ontribution of Endothelium-Derived Nitric Oxide (EDNO) to the skeletal muscle blood flow response to exercise. Medi-cine & Science in Sports & Exercise. 1995; 27(8):1145-51. doi: 10.1249/00005768-199508000-00007 [DOI:10.1249/00005768-199508000-00007]
36. Arsenault BJ, Côté M, Cartier A, Lemieux I, Després JP, Ross R, et al. Effect of exercise training on cardiometabolic risk markers among sedentary, but metabolically healthy overweight or obese post-menopausal women with elevated blood pressure. Atherosclerosis. 2009; 207(2):530–3. doi: 10.1016/j.atherosclerosis.2009.05.009 [DOI:10.1016/j.atherosclerosis.2009.05.009]
37. Delp MD, McAllister RM, Laughlin MH. Exercise training alters endothelium-dependent vasoreactivity of rat abdominal aorta. Journal of Applied Physi-ology. 1993; 75(3):1354–63. doi: 10.1152/jappl.1993.75.3.1354 [DOI:10.1152/jappl.1993.75.3.1354]
38. Green DJ, Cable NT, Fox C, Rankin JM, Taylor RR. Modification of forearm resistance vessels by exercise training in young men. Journal of Applied Physi-ology. 1994; 77(4):1829–33. doi: 10.1152/jappl.1994.77.4.1829 [DOI:10.1152/jappl.1994.77.4.1829]
39. Jungersten L, Ambring A, Wall B, Wennmalm Å. Both physical fitness and acute exercise regulate nitric oxide formation in healthy humans. Journal of Applied Physiology. 1997; 82(3):760–4. doi: 10.1152/jappl.1997.82.3.760 [DOI:10.1152/jappl.1997.82.3.760]
40. Duncker D. Nitric oxide contributes to the regulation of vasomotor tone but does not modulate O2-consumption in exercising swine. Cardiovascular Re-search. 2000; 47(4):738–48. doi: 10.1016/s0008-6363(00)00143-7 [DOI:10.1016/S0008-6363(00)00143-7]
41. Johansen KL. Exercise and chronic kidney disease: current recommendations. Sports Medicine. 2005; 35(6):485–99. doi: 10.2165/00007256-200535060-00003 [DOI:10.2165/00007256-200535060-00003]
42. Hinkle JL, Cheever KH. Brunner and Suddarth's textbook of medical-surgical nursing [P. Sami, Persian Trans]. Tehran: Boshra; 2000.
43. Yang K, Bernardo LM, Sereika SM, Conroy MB, Balk J, Burke LE. Utilization of 3-month Yoga program for Adults at High Risk for Type 2 Diabetes. Evi-dence-Based Complementary and Alternative Medicine. 2011; 2011:1–6. doi: 10.1093/ecam/nep117 [DOI:10.1093/ecam/nep117]
44. Innes KE, Vincent HK. The influence if yoga-based programs on risk profiles in adults with type 2 diabetes mellitus: A systsmatic review. Evidence-Based Complementary and Alternative Medicine. 2007; 4(4):469–86. doi: 10.1093/ecam/nel103 [DOI:10.1093/ecam/nel103]
45. Miller BW, Cress CL, Johnson ME, Nichols DH, Schnitzler MA. Exercise during hemodialysis decreases the use of antihypertensive medications. American Journal of Kidney Diseases. 2002; 39(4):828–33. doi: 10.1053/ajkd.2002.32004 [DOI:10.1053/ajkd.2002.32004]
46. Hordern MD, Cooney LM, Beller EM, Prins JB, Marwick TH, Coombes JS. Determinants of changes in blood glucose response to short-term exercise training in patients with Type 2 diabetes. Clinical Science. 2008; 115(9):273–81. doi: 10.1042/cs20070422 [DOI:10.1042/CS20070422]
47. Chen HH. Effects of one-year swimming training on blood pressure and insulin sensitivity in mild hypertensive young patients. The Chinese Journal of Physiology. 2010; 53(4):185-9. doi: 10.4077/cjp.2010.amk042 [DOI:10.4077/CJP.2010.AMK042]
48. Andreazzi AE, Scomparin DX, Mesquita FP, Balbo SL, Gravena C, De Oliveira JC, et al. Swimming exercise at weaning improves glycemic control and inhibits the onset of monosodium L-glutamate-obesity in mice. Journal of Endocrinology. 2009; 201(3):351–9. doi: 10.1677/joe-08-0312 [DOI:10.1677/JOE-08-0312]
49. Johansen KL. Exercise and chronic kidney disease: Current recommendations. Sports Medicine. 2005; 35(6):485–99. doi: 10.2165/00007256-200535060-00003 [DOI:10.2165/00007256-200535060-00003]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |