دوره 13، شماره 4 - ( زمستان 1397 )
جلد 13 شماره 4 صفحات 505-494 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ahmadi S M, Fathi M, RashidLamir A, Aminian F. Effects of 8 Weeks Aerobic Training on Plasma Ghrelin Level and Ghrelin Lymphocyte Gene Expression in Elderly Men. Salmand: Iranian Journal of Ageing 2019; 13 (4) :494-505
URL: http://salmandj.uswr.ac.ir/article-1-1336-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-1336-fa.html
احمدی سیدمهدی، فتحی مهرداد، رشیدلمیر امیر، امینیان فرناز. تأثیر هشت هفته تمرین هوازی بر سطح گرلین پلاسما و بیان ژن گرلین لنفوسیت مردان سالمند. سالمند: مجله سالمندی ایران. 1397; 13 (4) :494-505
سیدمهدی احمدی1 
 ، مهرداد فتحی*2
، مهرداد فتحی*2 
 ، امیر رشیدلمیر1
، امیر رشیدلمیر1 

 ، فرناز امینیان3
، فرناز امینیان3 


 ، مهرداد فتحی*2
، مهرداد فتحی*2 
 ، امیر رشیدلمیر1
، امیر رشیدلمیر1 

 ، فرناز امینیان3
، فرناز امینیان3 

1- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی مشهد، مشهد، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی مشهد، مشهد، ایران. ،mfathei@um.ac.ir
3- گروه فیزیولوژی ورزشی، دانشکده علوم انسانی، واحد بجنورد، دانشگاه آزاد اسلامی، بجنورد، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی مشهد، مشهد، ایران. ،
3- گروه فیزیولوژی ورزشی، دانشکده علوم انسانی، واحد بجنورد، دانشگاه آزاد اسلامی، بجنورد، ایران.
متن کامل [PDF 2462 kb]
(3523 دریافت)
| چکیده (HTML) (7752 مشاهده)
فتحی و همکاران (2009) با بررسی تأثیر 12 هفته تمرین استقامتی شدید با شدت 34 متر در دقیقه (معادل 85 درصد حداکثر اکسیژن مصرفی)، به شکل هر جلسه 60 دقیقه و 5 روز در هفته، بر بیان ژن گرلین (آسیلدار) عضله و تغییر سطح سرمی آن در موشهای صحرایی نر به این نتیجه رسیدند که تمرین طولانیمدت با شدت بالا موجب افزایش بیان ژن گرلین در عضله دوقلو و افزایش سطح سرمی گرلین شد که این افزایش نسبت به گروه شاهد معنیدار بود [16].
نوری و همکاران (2016) با بررسی اثر 8 هفته تمرین هوازی، به شکل سه جلسه در هر هفته به مدت 45 دقیقه و در هر جلسه با شدتی معادل 50 تا 60 درصد حداکثر اکسیژن مصرفی در 30 مرد به این نتیجه رسیدند که درصد چربی بدن کاهش و میزان حداکثر اکسیژن مصرفی افزایش یافت. غلظت گرلین به طور معنیداری افزایش یافت در صورتی که تغییر معنیداری در سطح لپتین و شاخص مقاومت به انسولین دیده نشد [17].
کیخسروی و همکاران (2011) با بررسی اثر 8 هفته تمرین هوازی با شدت متوسط به مدت 50 دقیقه با سرعتی معادل 18 الی 20 متر بر دقیقه که روی 24 سر موش انجام دادند به این نتیجه رسیدند که مقدار آبستاتین در پایان دوره کاهش معنیدار یافت، اما تغییر معنیداری در سطح گرلین دیده نشد [19]. قاسمیان و همکاران (2016) با بررسی تأثیر 12 هفته تمرین هوازی همراه با مصرف مکمل اسید فولیک بر سطح هورمون گرلین، میزان غذای مصرفی و تغییرات وزن موشهای صحرایی ماده ویستار به این نتیجه رسیدند که 12 هفته تمرین هوازی همراه با مصرف اسید فولیک، تأثیری بر میزان گرلین اسیلدار بافت معده نداشت [18].
گزارشهای تحقیقی مرتبط با بیان ژن گرلین حاکی از آن است که این پپتید در گونههای مختلف جانوران در بافتهایی مانند آدرنال، کبد، بیضه و عضله بیان میشود [20]. در کل درباره اثر تمرین بر تظاهر ژن گرلین میتوان گفت شاید پس از فعالیت بدنی، گرلین شروع به افزایش میکند تا با سرکوب هزینههای انرژی آن، روند کاتابولیسم متعاقب تمرین را متوقف کند و شرایط را برای آنابولیسم فراهم کند. با این کار ذخایر انرژی ازدسترفته در فعالیت دوباره کسب میشوند و به بازسازی ذخایر کربوهیدرات کمک خواهد شد.
افزایش بیان ژن گرلین را میتوان با تعادل انرژی منفی ایجادشده مرتبط دانست، زیرا کاهش درصد چربی بدن افراد در گروه آزمایش معنیدار بوده است و این حاکی از تعادل انرژی منفی تحمیلشده بر اثر ورزش است، چرا که در گروه شاهد چنین تغییری مشاهده نشده است؛ بنابراین، این مطالعه برای اولینبار نشان داد تمرین هوازی سبب افزایش تظاهر ژن گرلین لنفوسیت مردان میانسال میشود. یکی از سازوکارهایی که درباره گرلین میتوان به آن اشاره کرد، بحث درباره تنظیم متابولیسم انرژی است. بر اساس مطالعات صورتگرفته شرکت در فعالیت بدنی طولانیمدت منجر به کاهش مقادیر آدنوزین تری فسفات و گلیکوژن عضله و کبد میشود؛ بنابراین، تمرین و فعالیت بدنی، هموستاز انرژی را در داخل سلول عضلانی بر هم میزند و تقاضای انرژی سلول را افزایش میدهد [21].
بروز حالت تعادل منفی انرژی میتواند ناشی از کاهش مقادیر آدنوزین تری فسفات عضلانی به علت ازدستدادن مداوم پورینها از عضلات آنها باشد که این کاهش احتمالی منابع انرژی سلولی همراه با ناشتایی میتواند عاملی مهم برای افزایش گرلین پلاسما در آزمودنیها باشد [22]. گرلین بیرونی روی وزن بدن و جذب غذا بیشتر از 100 برابر کنترل مرکزی، علاوه بر حالت درون وریدی یا صفاقی تأثیرگذار است. به همین علت، نشان داده شده است که گرلین از طریق تلفیق مکانیسمهای مرکزی به طور قابلتوجهی روی هوموستاز انرژی تأثیر میگذارد [23].
در هیپوتالاموس، گرلین، تأثیراتش را به صورت مستقل با انتشار هورمون رشد، روی جذب غذا اعمال میکند و عصبهای معرف GHS-R موجود در هسته کمانی هیپوتالاموس را فعال میکند که پپتید عصبی ارکسیژنیک (Y (NPY و پروتئین AgRP را همزمان ترشح میکند [24]. در حالت خاص، تأثیر کاهشدهنده اشباع در رابطه با بازدارندگی لپتین روی تولید NPY هیپوتالامیکی در موشهای صحرایی دیده شده است [25]. با درنظرگرفتن اینکه گرلین در مجرای معدیرودهای ترشح میشود و به تغییرات موجود در وضعیت متابولیک واکنش نشان میدهد، ممکن است چنین تصور شود که گرلین پیرامونی از طریق تأثیرات روی مجرای معدهایرودهای در CNS عمل میکند و این فیبرهای واگ آوران درنهایت فعالیت گردشهای NPY/AgRP هیپوتالامیکی را از طریق رله مغز پسین تغییر میدهند.
نقش مهم عصب واگ آوران به عنوان محرک رفتار تغذیه سازگار با یافتههای اشباع زودرس، کمبود گرسنگی و کاهش وزن ثابت در بیماران چاق است که به دنبال جراحی عصب واگ تنهای ایجاد میشود [27 ،26]. این مطالعه با محدودیتهایی همچون رژیم غذایی متنوع، پاسخهای سازگاری گوناگون به فعالیت بدنی، تعداد کم آزمودنیها به دلیل انصراف بعضی از آنها از شرکت در این تحقیق و تفاوتهای فردی روبهرو بود، درنتیجه باید جانب احتیاط را بیشتر رعایت کرد.
با توجه به اینکه اغلب پژوهشهای صورتپذیرفته در ارتباط با تغییرات گرلین و بروز آن در افراد چاق یا لاغر بوده و کمتر در دوره سالمندی به بررسی آن پرداخته شده است، محقق به منظور تعیین تأثیر گرلین بر هموستاز انرژی، بر آن شد تا به بررسی تأثیر تمرین هوازی بر بیان ژن گرلین بپردازد و نتیجه اینکه انجام فعالیتهای ورزشی هوازی به سبب تغییرات فیزیولوژیکی میتواند از عوامل مؤثر بر تغییرات هورمونهای اشتها باشد و نظر به اینکه تغییر اینگونه متغیرها به شدت، مدت تمرین و وضعیت آمادگی جسمانی افراد بستگی دارد، به مربیان و پزشکان ورزشی پیشنهاد میشود به هنگام طراحی تمرینات ورزشی تدابیر لازم را بیندیشند.
نتیجهگیری نهایی
به طور کلی 8 هفته برنامه تمرین هوازی منجر به کاهش معنیدار درصد چربی بدن و نمایه توده بدن گروه آزمایش شد؛ درصورتی که بیان ژن گرلین لنفوسیت افزایش معنیدار یافت، اما تغییر معنیداری در سطح گرلین پلاسما دیده نشد؛ بنابراین، فعالیت بدنی هوازی منظم میتواند به عنوان یک درمان غیردارویی در تنظیم تعادل هورمونهای پپتیدی مؤثر در شیوع چاقی، استفاده شود. با این یافتهها و نتایج مطالعات پیشین، شناخت مکانیسمهای اصلی عهدهدار ارتباط متقابل گرلین و چاقی و نقش فعالیت بدنی بر آنها به انجام مطالعات بیشتری در این زمینه نیازمند است؛ از این رو، به سالمندان پیشنهاد میشود از تمرینهای هوازی به عنوان یک روش پیشگیرانه برای کاهش چاقی و بروز بیماریهای مرتبط با آن استفاده کنند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
همه اصول اخلاقی در این مقاله رعایت شده است. شرکت کنندگان اجازه داشتند هر زمان که مایل بودند از پژوهش خارج شوند. همچنین همه شرکت کنندگان در جریان روند پژوهش بودند. اطلاعات آن ها محرمانه نگه داشته شد.
حامی مالی
این مقاله از پایاننامه مقطع کارشناسی ارشد سیدمهدی احمدی در گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی دانشگاه فردوسی مشهد با کد 18731 گرفته شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بنا بر اظهارنظر نویسندگان، تعارض منافعی وجود ندارد.
References
متن کامل: (4906 مشاهده)
مقدمه
اشتها از موارد تأثیرگذار بر هومئوستاز انرژی است و تنظیم آن نقش مهمی در کنترل تعادل انرژی ایفا میکند [1]. تعادل انرژی از راه سیستم پیچیدهای تنظیم میشود که شامل عوامل مرکزی و محیطی است [2]. عوامل محیطی درگیر هومئوستاز انرژی و تنظیم اشتها، بیشتر به پیامهای بلندمدت مانند لپتین، انسولین و پیامهای کوتاهمدت معدهایرودهای شامل پپتیدهایی مانند گرلین، کولهسیستوکینین و پپتید YY تقسیم میشوند [3]. گرلین تنها پپتید شناختهشده فعال محیطی اشتهاآور در جریان خون است [3]. گرلین از دو کلمه Gher به معنی رشد و Relin به معنی رهایی تشکیل شده است [4].
پریپروگرلین در انسان از 4 اگزوژن کد میشود که شامل 117 اسیدآمینه است؛ 23 اسیدآمینه از توالی سیگنال، 66 اسیدآمینه در پروپپتید و 28 اسیدآمینه در پپتید نهایی است [6، 5]. براساس مطالعات صورتگرفته، سه نوع جهش در ژن پریپروگرلین وجود دارد که فقط یکی از آنها در محصول نهایی باقی میماند و با چاقی در انسان مرتبط است [7]. با توجه به این امر، اضافهوزن و چاقی و بیماریهای مرتبط با آن به علت هزینههای سرسامآور بهداشتی و پزشکی، به یک معضل بزرگ و جدی اقتصادی در بسیاری از کشورها تبدیل شده است.
از طرفی تعادل منفی انرژی نیز باعث بروز اختلالاتی از جمله ازدستدادن اشتها و کموزنی میشود که این دو از علل عمده مرگومیر در بسیاری از بیماران سرطانی، بیماران مبتلا به ضعف قلبی، بیماران مبتلا به بیماریهای التهابی (از قبیل عفونت)، بیماران دچار سوختگی و بیماران پس از اعمال جراحی ذکر شدهاند [8]؛ بنابراین مشاهده میشود که اندکی بیتعادلی در دریافت یا مصرف انرژی، اثرات زیادی بر وزن بدن دارد؛ بنابراین وزن بدن باید به طریقی مؤثر تنظیم شود [7]. یکی از روشهای اثرگذار بر وزن بدن، انجام فعالیتهای بدنی منظم است.
فعالیت بدنی عاملی اصلاحپذیر در سبک زندگی است که میتواند خطر بروز بیماریهای متابولیکی همچون چاقی را کاهش دهد. برخی از مطالعات میزان کاهش چاقی را با افزایش فعالیت بدنی گزارش کردهاند [9]. درباره نقش محافظتی فعالیتهای ورزشی در برابر بروز چاقی و اضافهوزن، مکانیسمهای مختلفی از جمله تغییر سطوح انرژی بدن و درنتیجه تغییر میزان گرلین وجود دارد. شرکت در فعالیتهای ورزشی منجر به تغییر انرژی دردسترس بدن میشود و گرلین از پپتیدهای مؤثر در تنظیم تعادل انرژی است؛ بنابراین ممکن است در شرایط ورزش دستخوش تغییرات شود [10].
اولکیو و همکاران (2015) با بررسی اثر یک جلسه تمرین هوازی60 دقیقهای با شدتی معادل 50 درصد حداکثر اکسیژن مصرفی، روی 12 زن چاق به این نتیجه رسیدند که سطح لپتین و گرلین پلاسمایی بعد از تمرین بلافاصله کاهشی معنیدار یافت [11]. عزیزی و همکاران (2012) با بررسی اثر 8 هفته تمرین هوازی، 3 جلسه در هر هفته و زمان هر جلسه 60 دقیقه با شدتی معادل 65 تا 80 درصد ضربان قلب بیشینه، روی 24 زن غیرفعال به این نتیجه رسیدند که سطوح گرلین افزایشی معنیدار یافت، اما تغییر معنیداری در سطح لپتین دیده نشد [12].
در نتیجه، با توجه به اینکه فعالیت بدنی متغیرترین بخش از هزینه انرژی در انسانها را شامل میشود، یکی از دلایل مطالعه آثار ورزش بر گرلین ممکن است به دلیل اثر ورزش بر تعادل انرژی باشد که یکی از عملکردهای گرلین است، زیرا میزان اشتها بر اثر گرلین تحت تأثیر ورزش قرار میگیرد و به همان اندازه نیز تعادل انرژی تغییر میکند؛ بنابراین، به منظورکاهش مشکلات چاقی و داشتن جامعهای پویا، داشتن فعالیتهای ورزشی مناسب و تغذیه سالم میتواند از بیماری و ناتوانی در فرد پیشگیری کند و سبب افزایش طول عمر و ارتقای کیفیت زندگی شود؛ بنابراین، در این پژوهش محقق به دنبال مطالعه بررسی تأثیر 8 هفته تمرین هوازی بر سطح گرلین پلاسما و بیان ژن گرلین لنفوسیت مردان سالمند است.
روش مطالعه
آزمودنیها
این تحقیق از نوع نیمهتجربی است که با طرح دو گروه آزمایش و کنترل با پیشآزمون و پسآزمون انجام شد. نمونه آماری این تحقیق را مردان غیرفعال ساکن شهرستان نیشابور با دامنه سنی بین 60 تا 70 سال تشکیل میدادند. از میان افراد واجد معیارهای انتخاب 30 نفر به روش نمونهگیری دردسترس و هدفدار گزینش و به طور تصادفی به دو گروه آزمایش (15 نفر) و کنترل (15 نفر) تقسیم شدند. در روش اتفاقی یا تصادفی که در این پژوهش استفاده شد، انتخاب و گزینش آزمودنیها، کاملاً به صورت تصادفی بود؛ به این نحو که شانس انتخاب برای هر مورد یا آزمودنی مساوی بود.
در این روش از مدل تصادفیسازی ساده مثل قرعهکشی استفاده شد. در این حالت، هر آزمودنی بر اساس نتیجه قرعه در گروه آزمایش و یا کنترل قرار گرفت. برای رعایت ملاحظات اخلاقی ضمن آشنایی آزمودنیها با تمام مراحل اجرای پژوهش، از قبیل برنامههای تمرینی (آسیبدیدگی در طی دوره تمرینی) و ارزیابیهای آزمایشگاهی، قبل از تکمیل فرم رضایتنامه به آنها توضیح داده شد که اطلاعات دریافتی به صورت محرمانه خواهد بود. همچنین آنها میتوانستند در صورت تمایل در هر مرحلهای از مطالعه خارج شوند.
در مرحله نخست افراد با ماهیت و نحوه همکاری برای اجرای پژوهش آشنا شدند. معیارهای ورود به مطالعه عبارت بودند از: مصرفنکردن داروهای اثرگذار بر اشتها، استعمالنکردن دخانیات و نداشتن. معیارهای خروج آزمودنیها از این پژوهش: ابتلا به بیماریهای قلبیعروقی، دیابت، اختلالات نورولوژیک، فشار خون و حضورنیافتن در دو جلسه متوالی یا سه جلسه غیرمتوالی در برنامه تمرینی موردنظر. آزمودنیها بر اساس شرایط تحقیق به صورت داوطلبانه در تحقیق شرکت و فرم رضایتنامه را امضا کردند.
سطح فعالیت جسمانی مردان غیرفعال سالمند در دوره قبل و بعد از 8 هفته تمرین هوازی بررسی شد. در این تحقیق سطح فعالیت جسمانی افراد با استفاده از پرسشنامه ارزیابی فعالیت جسمانی کیزر مشخص شد [13]. این پرسشنامه عادات و الگوهای فعالیت جسمانی را بهویژه در زنان، ارزیابی میکند و شامل چهار بخش است: فعالیتهای مربوط به امور خانه و مراقبت از خانواده، فعالیتهای شغلی، عادات زندگی فعال و مشارکت در ورزش.
استرن فرلد، آینس ورث وکوسنبری در سال (1999) این ابزار اندازهگیری را برای زنان گروه سنی 20 تا 60 سال تأیید کردند و اعتبار درونی آن 83/∙=α کرونباخ بود. بر اساس این پرسشنامه مردانی که در امور عادی و روزمره زندگی خود فعالیت جسمانی کمی داشتند و غیرورزشکار بودند؛ یعنی 3 تا 5 سال سابقه ورزشی منظم نداشتند و در دو ماه اخیر بیش از یک جلسه در هفته به ورزش نپرداخته بودند، شامل این پژوهش میشدند [13].
ترکیب بدنی
برای ارزیابی ترکیب بدنی طول قد آزمودنیها از قدسنج سکا (ساخت کشور آلمان) با حساسیت 5 میلیمتر که قدسنجی مدرج بود، استفاده شد. بدین منظور فرد بدون کفش روی زمین به صورت صاف و کشیده ایستاد؛ به طوری که وزن به طور مساوی روی هر دو پا تقسیم شده، سر و دید چشمها موازی سطح افق باشد. سپس در انتهای بازدم معمولی، خطکش افقی طوری روی سر قرار گرفت که مماس بر کاسه سر بوده و با خطکش عمودی زوایه قائمه بسازد. بدین طریق، قد فرد بر حسب سانتیمتر به دست آمد.
وزن آزمودنیهای واجد شرایط با ترازوی دیجیتالی کمپانی Beurer آلمان (مدل PS06-PS07) اندازهگیری شد. بدین صورت که فرد بدون کفش و با یک دست لباس تمرینی سبک روی ترازو قرار گرفت و وزن او بر حسب کیلوگرم اندازهگیری شد. نمایه توده بدن آزمودنیها، قبل از شروع تمرینات بدنی با استفاده از تقسیم وزن به مجذور قد به متر به دست آمد. در این فرمول، وزن بر حسب کیلوگرم و قد برحسب متر و واحد نمایه توده بدن بر حسب کیلوگرم متر مربع است.
سپس برای اندازهگیری درصد چربی بدن با استفاده از کالیپر نوع لافیت از سه نقطه (تحت کتفی، شکمی و سهسر بازویی) استفاده شد. با قراردادن آن در فرمول لوماناسلاتر میزان درصد چربی بدن به دست آمد (معادله شماره 1). در این معادله Db نماد دانسیته بدن، ∑3SKF معادل مجموع میانگین دادههای سه نقطه اندازهگیریشده و BF% نماد درصد چربی بدن است.
معادله شماره 1:
Db=[1.0973-(0.000815×∑3SKF)]+[0.00000084×(∑3SKF)2]
BF%=(457.0×Db)-414.2
آزمودنیها پس از معاینه قلبیعروقی، اندازهگیری فشارخون و ثبت الکتروکاردیوگرام از سوی پزشک متخصص، مجوز ورود به طرح را کسب کردند. قبل از شروع فعالیت بدنی میزان فشار خون هر آزمودنی با استفاده از دستگاه MaximedExipres TD-3018 اندازهگیری شد و با استفاده از فرمول، فشار خون متوسط شریانی به فشار خون متوسط تبدیل شد (معادله شماره2).
معادله شماره 2:
3/(فشار خون سیتولی+فشار خون دیاستولی×2)=فشار خون متوسط
نمونهگیری خونی
در این تحقیق نمونههای خونی در 48 ساعت پیش از شروع تمرینات و 48 ساعت بعد از جلسه تمرین جمعآوری شد. نمونهگیری در بین ساعات 8 تا 9صبح در آزمایشگاه از سیاهرگ دست چپ هر آزمودنی در وضعیت نشسته و در حالت استراحت انجام شد. همه نمونهها در لولههای حاوی ماده ضدانعقاد اتیلن دی آمین تترا اتیل استات و آنتیپروتئاز پاراهیدروکسی مرکوری بنزوئیک اسید قرار گرفت (یک میلی مولار در حجم نهایی نمونه).
همچنین، سنتریفیوژ با گرانش 3 هزار در دمای 4- درجه سانتیگراد به مدت 15 دقیقه انجام شد و پلاسمای بهدستآمده به لوله دیگری انتقال یافت و بلافاصله پس از آن 100 میکرولیتر اسیدکلریدریک یک مولار به ازای هر میلی لیتر پلاسما به نمونه اضافه شد. برای انجام آزمایش تخلیص mRNA از روش نیمهکمّی RT-PCR با توالی پرایمر فوروارد 5-ATGTGGAACGCGACCCCCAGCGA-3 و پرایمر ریورس 5-ACCCCCAATTGTTTCCAGACCCAT-3 استفاده شد [14]. در انتها پس از بهدستآمدن نتایج با استفاده از دستگاه UVP مدل Gel Doc-It Ts 310 ساخت کشور آمریکا و بهدستآوردن مقدار بتااکتین، عدد بهدستآمده را بر مقدار بتااکتین تقسیم و حاصل را در 100 ضرب شد تا مقدار mRNA گرلین بر اساس درصد به دست آید. ل بتااکتین یک ژن همیشه بیانشونده است و میتواند شاهد خوبی برای بررسی کل فرایند تخلیص mRNA باشد.
نمونههای فریزشده پس از انکوباسیون (2 ساعت در دمای اتاق) و اضافهکردن بافر با نسبت 100 میکرولیتر به ازای 50 میکرولیتر نمونه و 2 بار شستوشو با روش الایزا و با استفاده از کیت Human Ghrelin(GH) ELISA Kit ساخت شرکت EASTBIOPHARM کشور چین و تحت لیسانس آمریکا آزمایش شدند. محدوده سنجش این کیت در حدود 50/0 تا lm/gn 01 است و حساسیت آن lm/gn 0.01 است. در این کیت ضریب تغییرات برونآزمون (برونسنجش) کمتر از 10 درصد )%01<CV) ضریب تغییرات درونآزمون (درونسنجش) کمتر از 12 درصد )%21<CV) است.
برنامه تمرینی
برنامه تمرینی شامل 8 هفته تمرینات هوازی بود که در هر هفته چهار جلسه و هر جلسه به مدت 50 تا 60 دقیقه اجرا شد. برنامه تمرینی شامل گرمکردن عمومی به مدت 10 دقیقه (راهرفتن، دویدن نرم، حرکات کششی و جنبشپذیری)، اجرای تمرینات هوازی شامل دوهای با شدت 60 تا 85 درصد ضربان قلب بیشینه بود که در جلسه اول به مدت 20 دقیقه و بهمرور تا پایان 8 هفته به 60 دقیقه افزایش یافت.
شدت تمرین با ضربانسنج (POLAR / مدل T31، ساخت کشور انگلستان) کنترل شد. در پایان هر جلسه تمرین ورزشی به مدت 10 دقیقه بازگشت بدن به حالت اولیه و سردکردن (دویدن آهسته، راهرفتن و حرکات کششی) انجام میشد [15]. در پایان طرح (پس از 8 هفته) مشابه شرایط پیشآزمون، دوباره تمام اندازهگیریها انجام و دادهها جمعآوری شد. همچنین، گروه شاهد هیچ فعالیتی در طول دوره تحقیق نداشتند و غیرفعال بودند (همچون قبل از این مطالعه، شیوه زندگی غیرفعال داشتند).
روش آماری
در پایان مرحله اجرایی پژوهش، دادههای جمعآوریشده با کمک نسخه 16 نرمافزار SPSS تجزیه و تحلیل شدند. پس از تأیید نرمالبودن توزیع نظری دادهها با استفاده از آزمون آماری شاپیروویلک و همگنی واریانسها با آزمون لون، برای مقایسه میانگینهای درونگروهی و بینگروهی از آمار استنباطی (تحلیل واریانس با اندازههای تکراری) استفاده شد. برای تعیین معنیداری نتایج، سطح 0/05>P به عنوان ضابطه تصمیمگیری در نظر گرفته شد.
یافتهها
مشخصات آزمودنیهای گروه آزمایش و کنترل در جدول شماره 1 نشان داده شدهاند. بر اساس نتایج جدول شماره 1 همانطور که مشاهده میشود، تفاوت معنیداری بین شاخصهای قد، درصد چربی بدن، نمایه توده بدن، گرلین پلاسما و بیان ژن گرلین لنفوسیت در دو گروه آزمایش و کنترل وجود نداشت.
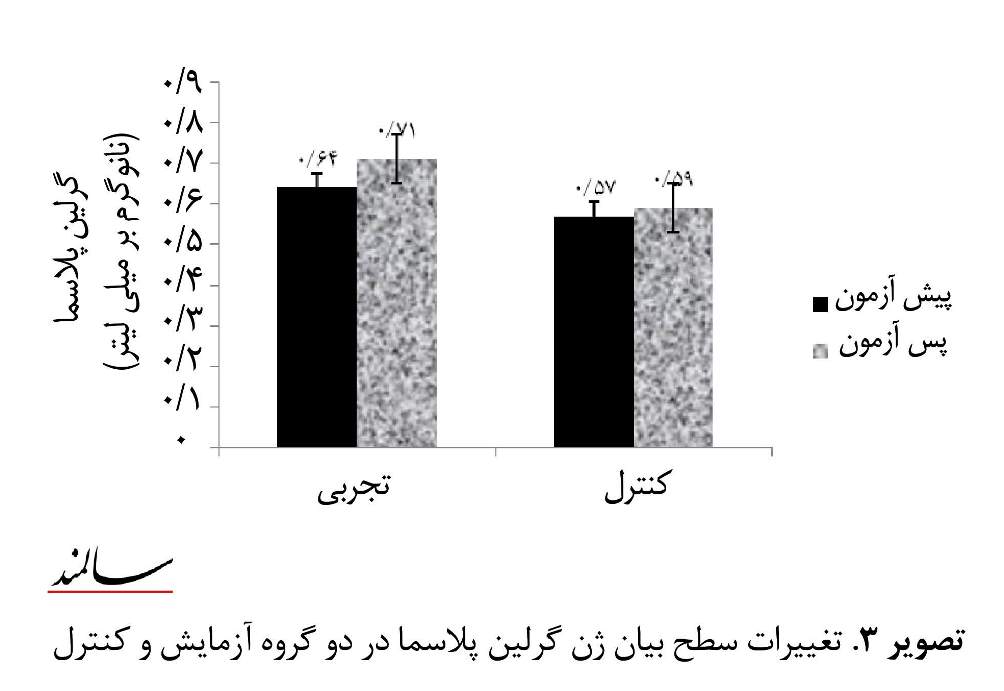
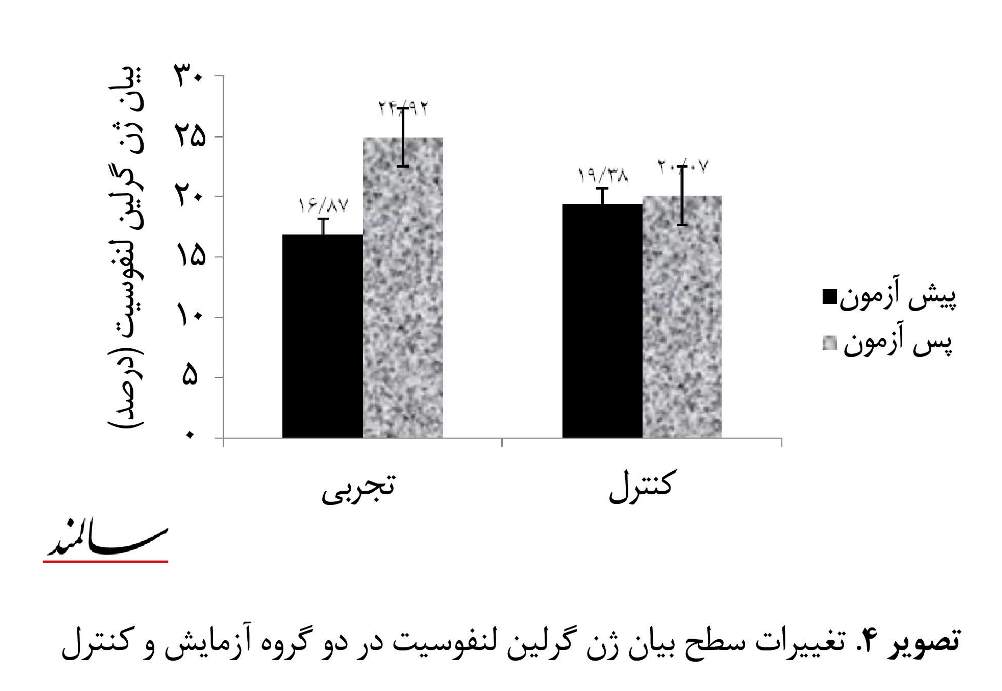
بر اساس جدول شماره 2، نتایج تحلیل واریانس با اندازههای تکراری نشان داد 8 هفته برنامه تمرین هوازی به شکل هر هفته 4 جلسه و هر جلسه به مدت 50 تا 60 دقیقه با شدتی معادل 60 تا 85 درصد ضربان قلب بیشینه منجر به کاهش معنیداری در مقادیر نمایه توده بدن از 27/57 به 26/90 کیلوگرم بر متر مربع (0/001=P)، کاهش درصد چربی بدن از 24/31 به 21/43 درصد (0/001=P) و افزایش معنیدار بیان ژن گرلین لنفوسیت از 16/87 به 24/92 درصد میشود (تصویر شماره 1 و 2). همچنین بر اساس نتایج جدول شماره 2، اگرچه مقادیر گرلین پلاسما از 0/64 به 0/71 نانوگرم بر میلیلیتر افزایش یافت، اما این تغییرات از لحاظ آماری معنیدار نبود.
تغییرات میانگینهای بینگروهی در متغیرهای شاخص توده بدن، درصد چربی بدن و بیان ژن گرلین لنفوسیت در هر دو گروه معنیدار نبود (0/05)
بحث
براساس نتایج بهدستآمده از این تحقیق، 8 هفته برنامه تمرین هوازی منجر به افزایش معنیدار میزان بیان ژن گرلین لنفوسیت در گروه آزمایش در پایان دوره شد. نتایج این پژوهش با یافتههای نوری و همکاران (2016) و فتحی و همکاران (2009) همخوانی دارد [17 ،16]، اما با یافتههای کیخسروی و همکاران (2011) و قاسمیان و همکاران (2016) همخوانی ندارد [19، 18].
اشتها از موارد تأثیرگذار بر هومئوستاز انرژی است و تنظیم آن نقش مهمی در کنترل تعادل انرژی ایفا میکند [1]. تعادل انرژی از راه سیستم پیچیدهای تنظیم میشود که شامل عوامل مرکزی و محیطی است [2]. عوامل محیطی درگیر هومئوستاز انرژی و تنظیم اشتها، بیشتر به پیامهای بلندمدت مانند لپتین، انسولین و پیامهای کوتاهمدت معدهایرودهای شامل پپتیدهایی مانند گرلین، کولهسیستوکینین و پپتید YY تقسیم میشوند [3]. گرلین تنها پپتید شناختهشده فعال محیطی اشتهاآور در جریان خون است [3]. گرلین از دو کلمه Gher به معنی رشد و Relin به معنی رهایی تشکیل شده است [4].
پریپروگرلین در انسان از 4 اگزوژن کد میشود که شامل 117 اسیدآمینه است؛ 23 اسیدآمینه از توالی سیگنال، 66 اسیدآمینه در پروپپتید و 28 اسیدآمینه در پپتید نهایی است [6، 5]. براساس مطالعات صورتگرفته، سه نوع جهش در ژن پریپروگرلین وجود دارد که فقط یکی از آنها در محصول نهایی باقی میماند و با چاقی در انسان مرتبط است [7]. با توجه به این امر، اضافهوزن و چاقی و بیماریهای مرتبط با آن به علت هزینههای سرسامآور بهداشتی و پزشکی، به یک معضل بزرگ و جدی اقتصادی در بسیاری از کشورها تبدیل شده است.
از طرفی تعادل منفی انرژی نیز باعث بروز اختلالاتی از جمله ازدستدادن اشتها و کموزنی میشود که این دو از علل عمده مرگومیر در بسیاری از بیماران سرطانی، بیماران مبتلا به ضعف قلبی، بیماران مبتلا به بیماریهای التهابی (از قبیل عفونت)، بیماران دچار سوختگی و بیماران پس از اعمال جراحی ذکر شدهاند [8]؛ بنابراین مشاهده میشود که اندکی بیتعادلی در دریافت یا مصرف انرژی، اثرات زیادی بر وزن بدن دارد؛ بنابراین وزن بدن باید به طریقی مؤثر تنظیم شود [7]. یکی از روشهای اثرگذار بر وزن بدن، انجام فعالیتهای بدنی منظم است.
فعالیت بدنی عاملی اصلاحپذیر در سبک زندگی است که میتواند خطر بروز بیماریهای متابولیکی همچون چاقی را کاهش دهد. برخی از مطالعات میزان کاهش چاقی را با افزایش فعالیت بدنی گزارش کردهاند [9]. درباره نقش محافظتی فعالیتهای ورزشی در برابر بروز چاقی و اضافهوزن، مکانیسمهای مختلفی از جمله تغییر سطوح انرژی بدن و درنتیجه تغییر میزان گرلین وجود دارد. شرکت در فعالیتهای ورزشی منجر به تغییر انرژی دردسترس بدن میشود و گرلین از پپتیدهای مؤثر در تنظیم تعادل انرژی است؛ بنابراین ممکن است در شرایط ورزش دستخوش تغییرات شود [10].
اولکیو و همکاران (2015) با بررسی اثر یک جلسه تمرین هوازی60 دقیقهای با شدتی معادل 50 درصد حداکثر اکسیژن مصرفی، روی 12 زن چاق به این نتیجه رسیدند که سطح لپتین و گرلین پلاسمایی بعد از تمرین بلافاصله کاهشی معنیدار یافت [11]. عزیزی و همکاران (2012) با بررسی اثر 8 هفته تمرین هوازی، 3 جلسه در هر هفته و زمان هر جلسه 60 دقیقه با شدتی معادل 65 تا 80 درصد ضربان قلب بیشینه، روی 24 زن غیرفعال به این نتیجه رسیدند که سطوح گرلین افزایشی معنیدار یافت، اما تغییر معنیداری در سطح لپتین دیده نشد [12].
در نتیجه، با توجه به اینکه فعالیت بدنی متغیرترین بخش از هزینه انرژی در انسانها را شامل میشود، یکی از دلایل مطالعه آثار ورزش بر گرلین ممکن است به دلیل اثر ورزش بر تعادل انرژی باشد که یکی از عملکردهای گرلین است، زیرا میزان اشتها بر اثر گرلین تحت تأثیر ورزش قرار میگیرد و به همان اندازه نیز تعادل انرژی تغییر میکند؛ بنابراین، به منظورکاهش مشکلات چاقی و داشتن جامعهای پویا، داشتن فعالیتهای ورزشی مناسب و تغذیه سالم میتواند از بیماری و ناتوانی در فرد پیشگیری کند و سبب افزایش طول عمر و ارتقای کیفیت زندگی شود؛ بنابراین، در این پژوهش محقق به دنبال مطالعه بررسی تأثیر 8 هفته تمرین هوازی بر سطح گرلین پلاسما و بیان ژن گرلین لنفوسیت مردان سالمند است.
روش مطالعه
آزمودنیها
این تحقیق از نوع نیمهتجربی است که با طرح دو گروه آزمایش و کنترل با پیشآزمون و پسآزمون انجام شد. نمونه آماری این تحقیق را مردان غیرفعال ساکن شهرستان نیشابور با دامنه سنی بین 60 تا 70 سال تشکیل میدادند. از میان افراد واجد معیارهای انتخاب 30 نفر به روش نمونهگیری دردسترس و هدفدار گزینش و به طور تصادفی به دو گروه آزمایش (15 نفر) و کنترل (15 نفر) تقسیم شدند. در روش اتفاقی یا تصادفی که در این پژوهش استفاده شد، انتخاب و گزینش آزمودنیها، کاملاً به صورت تصادفی بود؛ به این نحو که شانس انتخاب برای هر مورد یا آزمودنی مساوی بود.
در این روش از مدل تصادفیسازی ساده مثل قرعهکشی استفاده شد. در این حالت، هر آزمودنی بر اساس نتیجه قرعه در گروه آزمایش و یا کنترل قرار گرفت. برای رعایت ملاحظات اخلاقی ضمن آشنایی آزمودنیها با تمام مراحل اجرای پژوهش، از قبیل برنامههای تمرینی (آسیبدیدگی در طی دوره تمرینی) و ارزیابیهای آزمایشگاهی، قبل از تکمیل فرم رضایتنامه به آنها توضیح داده شد که اطلاعات دریافتی به صورت محرمانه خواهد بود. همچنین آنها میتوانستند در صورت تمایل در هر مرحلهای از مطالعه خارج شوند.
در مرحله نخست افراد با ماهیت و نحوه همکاری برای اجرای پژوهش آشنا شدند. معیارهای ورود به مطالعه عبارت بودند از: مصرفنکردن داروهای اثرگذار بر اشتها، استعمالنکردن دخانیات و نداشتن. معیارهای خروج آزمودنیها از این پژوهش: ابتلا به بیماریهای قلبیعروقی، دیابت، اختلالات نورولوژیک، فشار خون و حضورنیافتن در دو جلسه متوالی یا سه جلسه غیرمتوالی در برنامه تمرینی موردنظر. آزمودنیها بر اساس شرایط تحقیق به صورت داوطلبانه در تحقیق شرکت و فرم رضایتنامه را امضا کردند.
سطح فعالیت جسمانی مردان غیرفعال سالمند در دوره قبل و بعد از 8 هفته تمرین هوازی بررسی شد. در این تحقیق سطح فعالیت جسمانی افراد با استفاده از پرسشنامه ارزیابی فعالیت جسمانی کیزر مشخص شد [13]. این پرسشنامه عادات و الگوهای فعالیت جسمانی را بهویژه در زنان، ارزیابی میکند و شامل چهار بخش است: فعالیتهای مربوط به امور خانه و مراقبت از خانواده، فعالیتهای شغلی، عادات زندگی فعال و مشارکت در ورزش.
استرن فرلد، آینس ورث وکوسنبری در سال (1999) این ابزار اندازهگیری را برای زنان گروه سنی 20 تا 60 سال تأیید کردند و اعتبار درونی آن 83/∙=α کرونباخ بود. بر اساس این پرسشنامه مردانی که در امور عادی و روزمره زندگی خود فعالیت جسمانی کمی داشتند و غیرورزشکار بودند؛ یعنی 3 تا 5 سال سابقه ورزشی منظم نداشتند و در دو ماه اخیر بیش از یک جلسه در هفته به ورزش نپرداخته بودند، شامل این پژوهش میشدند [13].
ترکیب بدنی
برای ارزیابی ترکیب بدنی طول قد آزمودنیها از قدسنج سکا (ساخت کشور آلمان) با حساسیت 5 میلیمتر که قدسنجی مدرج بود، استفاده شد. بدین منظور فرد بدون کفش روی زمین به صورت صاف و کشیده ایستاد؛ به طوری که وزن به طور مساوی روی هر دو پا تقسیم شده، سر و دید چشمها موازی سطح افق باشد. سپس در انتهای بازدم معمولی، خطکش افقی طوری روی سر قرار گرفت که مماس بر کاسه سر بوده و با خطکش عمودی زوایه قائمه بسازد. بدین طریق، قد فرد بر حسب سانتیمتر به دست آمد.
وزن آزمودنیهای واجد شرایط با ترازوی دیجیتالی کمپانی Beurer آلمان (مدل PS06-PS07) اندازهگیری شد. بدین صورت که فرد بدون کفش و با یک دست لباس تمرینی سبک روی ترازو قرار گرفت و وزن او بر حسب کیلوگرم اندازهگیری شد. نمایه توده بدن آزمودنیها، قبل از شروع تمرینات بدنی با استفاده از تقسیم وزن به مجذور قد به متر به دست آمد. در این فرمول، وزن بر حسب کیلوگرم و قد برحسب متر و واحد نمایه توده بدن بر حسب کیلوگرم متر مربع است.
سپس برای اندازهگیری درصد چربی بدن با استفاده از کالیپر نوع لافیت از سه نقطه (تحت کتفی، شکمی و سهسر بازویی) استفاده شد. با قراردادن آن در فرمول لوماناسلاتر میزان درصد چربی بدن به دست آمد (معادله شماره 1). در این معادله Db نماد دانسیته بدن، ∑3SKF معادل مجموع میانگین دادههای سه نقطه اندازهگیریشده و BF% نماد درصد چربی بدن است.
معادله شماره 1:
Db=[1.0973-(0.000815×∑3SKF)]+[0.00000084×(∑3SKF)2]
BF%=(457.0×Db)-414.2
آزمودنیها پس از معاینه قلبیعروقی، اندازهگیری فشارخون و ثبت الکتروکاردیوگرام از سوی پزشک متخصص، مجوز ورود به طرح را کسب کردند. قبل از شروع فعالیت بدنی میزان فشار خون هر آزمودنی با استفاده از دستگاه MaximedExipres TD-3018 اندازهگیری شد و با استفاده از فرمول، فشار خون متوسط شریانی به فشار خون متوسط تبدیل شد (معادله شماره2).
معادله شماره 2:
3/(فشار خون سیتولی+فشار خون دیاستولی×2)=فشار خون متوسط
نمونهگیری خونی
در این تحقیق نمونههای خونی در 48 ساعت پیش از شروع تمرینات و 48 ساعت بعد از جلسه تمرین جمعآوری شد. نمونهگیری در بین ساعات 8 تا 9صبح در آزمایشگاه از سیاهرگ دست چپ هر آزمودنی در وضعیت نشسته و در حالت استراحت انجام شد. همه نمونهها در لولههای حاوی ماده ضدانعقاد اتیلن دی آمین تترا اتیل استات و آنتیپروتئاز پاراهیدروکسی مرکوری بنزوئیک اسید قرار گرفت (یک میلی مولار در حجم نهایی نمونه).
همچنین، سنتریفیوژ با گرانش 3 هزار در دمای 4- درجه سانتیگراد به مدت 15 دقیقه انجام شد و پلاسمای بهدستآمده به لوله دیگری انتقال یافت و بلافاصله پس از آن 100 میکرولیتر اسیدکلریدریک یک مولار به ازای هر میلی لیتر پلاسما به نمونه اضافه شد. برای انجام آزمایش تخلیص mRNA از روش نیمهکمّی RT-PCR با توالی پرایمر فوروارد 5-ATGTGGAACGCGACCCCCAGCGA-3 و پرایمر ریورس 5-ACCCCCAATTGTTTCCAGACCCAT-3 استفاده شد [14]. در انتها پس از بهدستآمدن نتایج با استفاده از دستگاه UVP مدل Gel Doc-It Ts 310 ساخت کشور آمریکا و بهدستآوردن مقدار بتااکتین، عدد بهدستآمده را بر مقدار بتااکتین تقسیم و حاصل را در 100 ضرب شد تا مقدار mRNA گرلین بر اساس درصد به دست آید. ل بتااکتین یک ژن همیشه بیانشونده است و میتواند شاهد خوبی برای بررسی کل فرایند تخلیص mRNA باشد.
نمونههای فریزشده پس از انکوباسیون (2 ساعت در دمای اتاق) و اضافهکردن بافر با نسبت 100 میکرولیتر به ازای 50 میکرولیتر نمونه و 2 بار شستوشو با روش الایزا و با استفاده از کیت Human Ghrelin(GH) ELISA Kit ساخت شرکت EASTBIOPHARM کشور چین و تحت لیسانس آمریکا آزمایش شدند. محدوده سنجش این کیت در حدود 50/0 تا lm/gn 01 است و حساسیت آن lm/gn 0.01 است. در این کیت ضریب تغییرات برونآزمون (برونسنجش) کمتر از 10 درصد )%01<CV) ضریب تغییرات درونآزمون (درونسنجش) کمتر از 12 درصد )%21<CV) است.
برنامه تمرینی
برنامه تمرینی شامل 8 هفته تمرینات هوازی بود که در هر هفته چهار جلسه و هر جلسه به مدت 50 تا 60 دقیقه اجرا شد. برنامه تمرینی شامل گرمکردن عمومی به مدت 10 دقیقه (راهرفتن، دویدن نرم، حرکات کششی و جنبشپذیری)، اجرای تمرینات هوازی شامل دوهای با شدت 60 تا 85 درصد ضربان قلب بیشینه بود که در جلسه اول به مدت 20 دقیقه و بهمرور تا پایان 8 هفته به 60 دقیقه افزایش یافت.
شدت تمرین با ضربانسنج (POLAR / مدل T31، ساخت کشور انگلستان) کنترل شد. در پایان هر جلسه تمرین ورزشی به مدت 10 دقیقه بازگشت بدن به حالت اولیه و سردکردن (دویدن آهسته، راهرفتن و حرکات کششی) انجام میشد [15]. در پایان طرح (پس از 8 هفته) مشابه شرایط پیشآزمون، دوباره تمام اندازهگیریها انجام و دادهها جمعآوری شد. همچنین، گروه شاهد هیچ فعالیتی در طول دوره تحقیق نداشتند و غیرفعال بودند (همچون قبل از این مطالعه، شیوه زندگی غیرفعال داشتند).
روش آماری
در پایان مرحله اجرایی پژوهش، دادههای جمعآوریشده با کمک نسخه 16 نرمافزار SPSS تجزیه و تحلیل شدند. پس از تأیید نرمالبودن توزیع نظری دادهها با استفاده از آزمون آماری شاپیروویلک و همگنی واریانسها با آزمون لون، برای مقایسه میانگینهای درونگروهی و بینگروهی از آمار استنباطی (تحلیل واریانس با اندازههای تکراری) استفاده شد. برای تعیین معنیداری نتایج، سطح 0/05>P به عنوان ضابطه تصمیمگیری در نظر گرفته شد.
یافتهها
مشخصات آزمودنیهای گروه آزمایش و کنترل در جدول شماره 1 نشان داده شدهاند. بر اساس نتایج جدول شماره 1 همانطور که مشاهده میشود، تفاوت معنیداری بین شاخصهای قد، درصد چربی بدن، نمایه توده بدن، گرلین پلاسما و بیان ژن گرلین لنفوسیت در دو گروه آزمایش و کنترل وجود نداشت.
بر اساس جدول شماره 2، نتایج تحلیل واریانس با اندازههای تکراری نشان داد 8 هفته برنامه تمرین هوازی به شکل هر هفته 4 جلسه و هر جلسه به مدت 50 تا 60 دقیقه با شدتی معادل 60 تا 85 درصد ضربان قلب بیشینه منجر به کاهش معنیداری در مقادیر نمایه توده بدن از 27/57 به 26/90 کیلوگرم بر متر مربع (0/001=P)، کاهش درصد چربی بدن از 24/31 به 21/43 درصد (0/001=P) و افزایش معنیدار بیان ژن گرلین لنفوسیت از 16/87 به 24/92 درصد میشود (تصویر شماره 1 و 2). همچنین بر اساس نتایج جدول شماره 2، اگرچه مقادیر گرلین پلاسما از 0/64 به 0/71 نانوگرم بر میلیلیتر افزایش یافت، اما این تغییرات از لحاظ آماری معنیدار نبود.
تغییرات میانگینهای بینگروهی در متغیرهای شاخص توده بدن، درصد چربی بدن و بیان ژن گرلین لنفوسیت در هر دو گروه معنیدار نبود (0/05)
براساس نتایج بهدستآمده از این تحقیق، 8 هفته برنامه تمرین هوازی منجر به افزایش معنیدار میزان بیان ژن گرلین لنفوسیت در گروه آزمایش در پایان دوره شد. نتایج این پژوهش با یافتههای نوری و همکاران (2016) و فتحی و همکاران (2009) همخوانی دارد [17 ،16]، اما با یافتههای کیخسروی و همکاران (2011) و قاسمیان و همکاران (2016) همخوانی ندارد [19، 18].
نوری و همکاران (2016) با بررسی اثر 8 هفته تمرین هوازی، به شکل سه جلسه در هر هفته به مدت 45 دقیقه و در هر جلسه با شدتی معادل 50 تا 60 درصد حداکثر اکسیژن مصرفی در 30 مرد به این نتیجه رسیدند که درصد چربی بدن کاهش و میزان حداکثر اکسیژن مصرفی افزایش یافت. غلظت گرلین به طور معنیداری افزایش یافت در صورتی که تغییر معنیداری در سطح لپتین و شاخص مقاومت به انسولین دیده نشد [17].
کیخسروی و همکاران (2011) با بررسی اثر 8 هفته تمرین هوازی با شدت متوسط به مدت 50 دقیقه با سرعتی معادل 18 الی 20 متر بر دقیقه که روی 24 سر موش انجام دادند به این نتیجه رسیدند که مقدار آبستاتین در پایان دوره کاهش معنیدار یافت، اما تغییر معنیداری در سطح گرلین دیده نشد [19]. قاسمیان و همکاران (2016) با بررسی تأثیر 12 هفته تمرین هوازی همراه با مصرف مکمل اسید فولیک بر سطح هورمون گرلین، میزان غذای مصرفی و تغییرات وزن موشهای صحرایی ماده ویستار به این نتیجه رسیدند که 12 هفته تمرین هوازی همراه با مصرف اسید فولیک، تأثیری بر میزان گرلین اسیلدار بافت معده نداشت [18].
گزارشهای تحقیقی مرتبط با بیان ژن گرلین حاکی از آن است که این پپتید در گونههای مختلف جانوران در بافتهایی مانند آدرنال، کبد، بیضه و عضله بیان میشود [20]. در کل درباره اثر تمرین بر تظاهر ژن گرلین میتوان گفت شاید پس از فعالیت بدنی، گرلین شروع به افزایش میکند تا با سرکوب هزینههای انرژی آن، روند کاتابولیسم متعاقب تمرین را متوقف کند و شرایط را برای آنابولیسم فراهم کند. با این کار ذخایر انرژی ازدسترفته در فعالیت دوباره کسب میشوند و به بازسازی ذخایر کربوهیدرات کمک خواهد شد.
افزایش بیان ژن گرلین را میتوان با تعادل انرژی منفی ایجادشده مرتبط دانست، زیرا کاهش درصد چربی بدن افراد در گروه آزمایش معنیدار بوده است و این حاکی از تعادل انرژی منفی تحمیلشده بر اثر ورزش است، چرا که در گروه شاهد چنین تغییری مشاهده نشده است؛ بنابراین، این مطالعه برای اولینبار نشان داد تمرین هوازی سبب افزایش تظاهر ژن گرلین لنفوسیت مردان میانسال میشود. یکی از سازوکارهایی که درباره گرلین میتوان به آن اشاره کرد، بحث درباره تنظیم متابولیسم انرژی است. بر اساس مطالعات صورتگرفته شرکت در فعالیت بدنی طولانیمدت منجر به کاهش مقادیر آدنوزین تری فسفات و گلیکوژن عضله و کبد میشود؛ بنابراین، تمرین و فعالیت بدنی، هموستاز انرژی را در داخل سلول عضلانی بر هم میزند و تقاضای انرژی سلول را افزایش میدهد [21].
بروز حالت تعادل منفی انرژی میتواند ناشی از کاهش مقادیر آدنوزین تری فسفات عضلانی به علت ازدستدادن مداوم پورینها از عضلات آنها باشد که این کاهش احتمالی منابع انرژی سلولی همراه با ناشتایی میتواند عاملی مهم برای افزایش گرلین پلاسما در آزمودنیها باشد [22]. گرلین بیرونی روی وزن بدن و جذب غذا بیشتر از 100 برابر کنترل مرکزی، علاوه بر حالت درون وریدی یا صفاقی تأثیرگذار است. به همین علت، نشان داده شده است که گرلین از طریق تلفیق مکانیسمهای مرکزی به طور قابلتوجهی روی هوموستاز انرژی تأثیر میگذارد [23].
در هیپوتالاموس، گرلین، تأثیراتش را به صورت مستقل با انتشار هورمون رشد، روی جذب غذا اعمال میکند و عصبهای معرف GHS-R موجود در هسته کمانی هیپوتالاموس را فعال میکند که پپتید عصبی ارکسیژنیک (Y (NPY و پروتئین AgRP را همزمان ترشح میکند [24]. در حالت خاص، تأثیر کاهشدهنده اشباع در رابطه با بازدارندگی لپتین روی تولید NPY هیپوتالامیکی در موشهای صحرایی دیده شده است [25]. با درنظرگرفتن اینکه گرلین در مجرای معدیرودهای ترشح میشود و به تغییرات موجود در وضعیت متابولیک واکنش نشان میدهد، ممکن است چنین تصور شود که گرلین پیرامونی از طریق تأثیرات روی مجرای معدهایرودهای در CNS عمل میکند و این فیبرهای واگ آوران درنهایت فعالیت گردشهای NPY/AgRP هیپوتالامیکی را از طریق رله مغز پسین تغییر میدهند.
نقش مهم عصب واگ آوران به عنوان محرک رفتار تغذیه سازگار با یافتههای اشباع زودرس، کمبود گرسنگی و کاهش وزن ثابت در بیماران چاق است که به دنبال جراحی عصب واگ تنهای ایجاد میشود [27 ،26]. این مطالعه با محدودیتهایی همچون رژیم غذایی متنوع، پاسخهای سازگاری گوناگون به فعالیت بدنی، تعداد کم آزمودنیها به دلیل انصراف بعضی از آنها از شرکت در این تحقیق و تفاوتهای فردی روبهرو بود، درنتیجه باید جانب احتیاط را بیشتر رعایت کرد.
با توجه به اینکه اغلب پژوهشهای صورتپذیرفته در ارتباط با تغییرات گرلین و بروز آن در افراد چاق یا لاغر بوده و کمتر در دوره سالمندی به بررسی آن پرداخته شده است، محقق به منظور تعیین تأثیر گرلین بر هموستاز انرژی، بر آن شد تا به بررسی تأثیر تمرین هوازی بر بیان ژن گرلین بپردازد و نتیجه اینکه انجام فعالیتهای ورزشی هوازی به سبب تغییرات فیزیولوژیکی میتواند از عوامل مؤثر بر تغییرات هورمونهای اشتها باشد و نظر به اینکه تغییر اینگونه متغیرها به شدت، مدت تمرین و وضعیت آمادگی جسمانی افراد بستگی دارد، به مربیان و پزشکان ورزشی پیشنهاد میشود به هنگام طراحی تمرینات ورزشی تدابیر لازم را بیندیشند.
نتیجهگیری نهایی
به طور کلی 8 هفته برنامه تمرین هوازی منجر به کاهش معنیدار درصد چربی بدن و نمایه توده بدن گروه آزمایش شد؛ درصورتی که بیان ژن گرلین لنفوسیت افزایش معنیدار یافت، اما تغییر معنیداری در سطح گرلین پلاسما دیده نشد؛ بنابراین، فعالیت بدنی هوازی منظم میتواند به عنوان یک درمان غیردارویی در تنظیم تعادل هورمونهای پپتیدی مؤثر در شیوع چاقی، استفاده شود. با این یافتهها و نتایج مطالعات پیشین، شناخت مکانیسمهای اصلی عهدهدار ارتباط متقابل گرلین و چاقی و نقش فعالیت بدنی بر آنها به انجام مطالعات بیشتری در این زمینه نیازمند است؛ از این رو، به سالمندان پیشنهاد میشود از تمرینهای هوازی به عنوان یک روش پیشگیرانه برای کاهش چاقی و بروز بیماریهای مرتبط با آن استفاده کنند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
همه اصول اخلاقی در این مقاله رعایت شده است. شرکت کنندگان اجازه داشتند هر زمان که مایل بودند از پژوهش خارج شوند. همچنین همه شرکت کنندگان در جریان روند پژوهش بودند. اطلاعات آن ها محرمانه نگه داشته شد.
حامی مالی
این مقاله از پایاننامه مقطع کارشناسی ارشد سیدمهدی احمدی در گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی دانشگاه فردوسی مشهد با کد 18731 گرفته شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بنا بر اظهارنظر نویسندگان، تعارض منافعی وجود ندارد.
References
- Cheng MH, Bushnell D, Cannon DT, Kern M. Appetite regulation via exercise prior or subsequent to high-fat meal consumption. Appetite. 2009; 52(1):193-8. [DOI:10.1016/j.appet.2008.09.015]
- Issazadeh R. Effect of twelve weeks combined exercise (aerobicresistance) on plasma levels of ghrelin and obestatin in obese adolescens. Razi Journal of Medical Sciences. 2016; 22(141):91-103.
- Cummings DE. Ghrelin and the short-and long-term regulation of appetite and body weight. Physiology & Behavior. 2006; 89(1):71-84. [DOI:10.1016/j.physbeh.2006.05.022]
- Cummings DE, Shannon MH. Roles for ghrelin in the regulation of appetite and body weight. Archives of Surgery. 2003; 138(4):389-96. [DOI:10.1001/archsurg.138.4.389]
- Ukkola O, Ravussin E, Jacobson P, Snyder EE, Chagnon M, Sjöström L, Bouchard C. Rapid communications: Mutations in the preproghrelin/ghrelin gene associated with obesity in humans. The Journal of Clinical Endocrinology & Metabolism. 2001; 86(8):3996-9. [DOI:10.1210/jcem.86.8.7914] [PMID]
- Date Y, Nakazato M, Hashiguchi S, Dezaki K, Mondal MS, Hosoda H, et al. Ghrelin is present in pancreatic α-cells of humans and rats and stimulates insulin secretion. Diabetes. 2002; 51(1):124-9. [DOI:10.2337/diabetes.51.1.124]
- Korbonits M, Goldstone AP, Gueorguiev M, Grossman AB. Ghrelin—a hormone with multiple functions. Frontiers in neuroendocrinology. 2004; 25(1):27-68.
- Woods SC, Benoit SC, Clegg DJ, Seeley RJ. Regulation of energy homeostasis by peripheral signals. Best Practice & Research Clinical Endocrinology & Metabolism. 2004; 18(4):497-515. [DOI:10.1016/j.beem.2004.08.004]
- Banks E, Lim L, Seubsman SA, Bain C, Sleigh A. Relationship of obesity to physical activity, domestic activities, and sedentary behaviours: cross-sectional findings from a national cohort of over 70,000 Thai adults. BMC Public Health. 2011; 11:762. [DOI:10.1186/1471-2458-11-762]
- Kraemer RR, Castracane VD. Exercise and humoral mediators of peripheral energy balance: Ghrelin and adiponectin. Experimental Biology and Medicine. 2007; (2):184-94.
- Olcucu B, Vatansever S, Koparan S, Mulazimoglu O, Çınar V. Effect of moderate intensity exercise on ghrelin and leptin hormones. Life Sciences. 2015; 5(3):1301-6.
- Azizi M. Serum leptin and ghrelin changes-induced aerobic training in healthy young females. International Journal of Collaborative Research on Internal Medicine & Public Health. 2012; 4(6):1257-64.
- Sternfeld B, Ainsworth BE, Quesenberry JR CP. Physical activity patterns in a diverse population of women. Preventive Medicine. 1999; 28(3):313-23. [DOI:10.1006/pmed.1998.0470]
- Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999; 402(6762):656-60. [DOI:10.1038/45230]
- Aghapour A, Farzanegi P. Effect of six-week aerobic exercise on Chemerin and Resistin concentration in hypertensive postmenopausal women. Electronic Physician. 2013; 5(1):623-30.
- Fathi R, Ghanbari-Niaki A, Rahbarizadeh F, Hedayati MA, Ghahramanloo E, et al. The effect of exercise on plasma acylated ghrelin concentrations and gastrocnemius muscle mRNA expression in male rats. Iranian Journal of Endocrinology and Metabolism. 2009; 10(5):519-26.
- Nuri R, Moghaddasi M, Darvishi H, Izadpanah A. Effect of aerobic exercise on leptin and ghrelin in patients with colorectal cancer. Journal of Cancer Research and Therapeutics. 2016; 12(1):169-74. [DOI:10.4103/0973-1482.155982]
- Parvizi A, Ghasemnian A, Rahmani A. [Effect of 12 weeks aerobic exercise for along with folic acid supplementation on the levels of the ghrelin hormone amount of food intake and weight changes of female Wistar rats (Persian)]. Armaghan-e Danesh. 2016; 21(8):746-56.
- Keikhosravi F, Shah HM, Daryanoush F, Hosseini SA, Noura M, Hasanpour G, et al. The effect of eight weeks moderate Intensity aerobic training on obestatin and ghrelin of obese male rats. Researcher in Sport Science Quarterly. 2011; 2(1):18-25.
- Ghelardoni S, Carnicelli V, Frascarelli S, Ronca-Testoni S, Zucchi R. Ghrelin tissue distribution: comparison between gene and protein expression. Journal of Endocrinological Investigation. 2006; 29(2):115-21. [DOI:10.1007/BF03344083]
- Morpurgo PS, Resnik M, Agosti F, Cappiello V, Sartorio A, Spada A. Ghrelin secretion in severely obese subjects before and after a 3-week integrated body mass reduction program. Journal of Endocrinological Investigation. 2003; 26(8):723-7.
- Chen JX, Zhao X, Yue GX, Wang ZF. Influence of acute and chronic treadmill exercise on rat plasma lactate and brain NPY, LENK, DYN A 1–13. Cellular and Molecular Neurobiology. 2007; 27(1):1-10. [DOI:10.1007/s10571-006-9110-4]
- Hansen TK, Dall R, Hosoda H, Kojima M, Kangawa K, Christiansen JS, et al. Weight loss increases circulating levels of ghrelin in human obesity. Clinical Endocrinology. 2002; 56(2):203-6. [DOI:10.1046/j.0300-0664.2001.01456.x]
- Tschöp M, Weyer C, Tataranni PA, Devanarayan V, Ravussin E, Heiman ML. Circulating ghrelin levels are decreased in human obesity. Diabetes. 2001; 50(4):707-9. [DOI:10.2337/diabetes.50.4.707]
- Tolle V, Kadem M, Bluet-Pajot MT, Frere D, Foulon C, Bossu C, et al. Balance in ghrelin and leptin plasma levels in anorexia nervosa patients and constitutionally thin women. The Journal of Clinical Endocrinology & Metabolism. 2003; 88(1):109-16. [DOI:10.1210/jc.2002-020645]
- Shiiya T, Nakazato M, Mizuta M, Date Y, Mondal MS, Tanaka M, et al. Plasma ghrelin levels in lean and obese humans and the effect of glucose on ghrelin secretion. The Journal of Clinical Endocrinology & Metabolism. 2002; 87(1):240-4. [DOI:10.1210/jcem.87.1.8129]
- Andrews ZB, Liu ZW, Walllingford N, Erion DM, Borok E, Friedman JM, et al. UCP2 mediates ghrelin’s action on NPY/AgRP neurons by lowering free radicals. Nature. 2008; 454(7206):846-51. [DOI:10.1038/nature07181]
فهرست منابع
1. Cheng MH, Bushnell D, Cannon DT, Kern M. Appetite regulation via exercise prior or subsequent to high-fat meal consumption. Appetite. 2009; 52(1):193-8. [DOI:10.1016/j.appet.2008.09.015] [DOI:10.1016/j.appet.2008.09.015]
2. Issazadeh R. Effect of twelve weeks combined exercise (aerobicresistance) on plasma levels of ghrelin and obestatin in obese adolescens. Razi Journal of Medical Sciences. 2016; 22(141):91-103.
3. Cummings DE. Ghrelin and the short-and long-term regulation of appetite and body weight. Physiology & Behavior. 2006; 89(1):71-84. [DOI:10.1016/j.physbeh.2006.05.022] [DOI:10.1016/j.physbeh.2006.05.022]
4. Cummings DE, Shannon MH. Roles for ghrelin in the regulation of appetite and body weight. Archives of Surgery. 2003; 138(4):389-96. [DOI:10.1001/archsurg.138.4.389] [DOI:10.1001/archsurg.138.4.389]
5. Ukkola O, Ravussin E, Jacobson P, Snyder EE, Chagnon M, Sjöström L, Bouchard C. Rapid communications: Mutations in the preproghrelin/ghrelin gene associated with obesity in humans. The Journal of Clinical Endocrinology & Metabolism. 2001; 86(8):3996-9. [DOI:10.1210/jcem.86.8.7914] [PMID] [DOI:10.1210/jcem.86.8.7914]
6. Date Y, Nakazato M, Hashiguchi S, Dezaki K, Mondal MS, Hosoda H, et al. Ghrelin is present in pancreatic α-cells of humans and rats and stimulates insulin secretion. Diabetes. 2002; 51(1):124-9. [DOI:10.2337/diabetes.51.1.124] [DOI:10.2337/diabetes.51.1.124]
7. Korbonits M, Goldstone AP, Gueorguiev M, Grossman AB. Ghrelin—a hormone with multiple functions. Frontiers in neuroendocrinology. 2004; 25(1):27-68. [DOI:10.1016/j.yfrne.2004.03.002] [PMID]
8. Woods SC, Benoit SC, Clegg DJ, Seeley RJ. Regulation of energy homeostasis by peripheral signals. Best Practice & Research Clinical Endocrinology & Metabolism. 2004; 18(4):497-515. [DOI:10.1016/j.beem.2004.08.004] [DOI:10.1016/j.beem.2004.08.004]
9. Banks E, Lim L, Seubsman SA, Bain C, Sleigh A. Relationship of obesity to physical activity, domestic activities, and sedentary behaviours: cross-sectional findings from a national cohort of over 70,000 Thai adults. BMC Public Health. 2011; 11:762. [DOI:10.1186/1471-2458-11-762] [DOI:10.1186/1471-2458-11-762]
10. Kraemer RR, Castracane VD. Exercise and humoral mediators of peripheral energy balance: Ghrelin and adiponectin. Experimental Biology and Medicine. 2007; (2):184-94.
11. Olcucu B, Vatansever S, Koparan S, Mulazimoglu O, Çınar V. Effect of moderate intensity exercise on ghrelin and leptin hormones. Life Sciences. 2015; 5(3):1301-6.
12. Azizi M. Serum leptin and ghrelin changes-induced aerobic training in healthy young females. International Journal of Collaborative Research on Internal Medicine & Public Health. 2012; 4(6):1257-64.
13. Sternfeld B, Ainsworth BE, Quesenberry JR CP. Physical activity patterns in a diverse population of women. Preventive Medicine. 1999; 28(3):313-23. [DOI:10.1006/pmed.1998.0470] [DOI:10.1006/pmed.1998.0470]
14. Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999; 402(6762):656-60. [DOI:10.1038/45230] [DOI:10.1038/45230]
15. Aghapour A, Farzanegi P. Effect of six-week aerobic exercise on Chemerin and Resistin concentration in hypertensive postmenopausal women. Electronic Physician. 2013; 5(1):623-30. [PMID] [PMCID]
16. Fathi R, Ghanbari-Niaki A, Rahbarizadeh F, Hedayati MA, Ghahramanloo E, et al. The effect of exercise on plasma acylated ghrelin concentrations and gastrocnemius muscle mRNA expression in male rats. Iranian Journal of Endocrinology and Metabolism. 2009; 10(5):519-26.
17. Nuri R, Moghaddasi M, Darvishi H, Izadpanah A. Effect of aerobic exercise on leptin and ghrelin in patients with colorectal cancer. Journal of Cancer Research and Therapeutics. 2016; 12(1):169-74. [DOI:10.4103/0973-1482.155982] [DOI:10.4103/0973-1482.155982]
18. Parvizi A, Ghasemnian A, Rahmani A. [Effect of 12 weeks aerobic exercise for along with folic acid supplementation on the levels of the ghrelin hormone amount of food intake and weight changes of female Wistar rats (Persian)]. Armaghan-e Danesh. 2016; 21(8):746-56.
19. Keikhosravi F, Shah HM, Daryanoush F, Hosseini SA, Noura M, Hasanpour G, et al. The effect of eight weeks moderate Intensity aerobic training on obestatin and ghrelin of obese male rats. Researcher in Sport Science Quarterly. 2011; 2(1):18-25.
20. Ghelardoni S, Carnicelli V, Frascarelli S, Ronca-Testoni S, Zucchi R. Ghrelin tissue distribution: comparison between gene and protein expression. Journal of Endocrinological Investigation. 2006; 29(2):115-21. [DOI:10.1007/BF03344083] [DOI:10.1007/BF03344083]
21. Morpurgo PS, Resnik M, Agosti F, Cappiello V, Sartorio A, Spada A. Ghrelin secretion in severely obese subjects before and after a 3-week integrated body mass reduction program. Journal of Endocrinological Investigation. 2003; 26(8):723-7. [DOI:10.1007/BF03347353] [PMID]
22. Chen JX, Zhao X, Yue GX, Wang ZF. Influence of acute and chronic treadmill exercise on rat plasma lactate and brain NPY, LENK, DYN A 1–13. Cellular and Molecular Neurobiology. 2007; 27(1):1-10. [DOI:10.1007/s10571-006-9110-4] [DOI:10.1007/s10571-006-9110-4]
23. Hansen TK, Dall R, Hosoda H, Kojima M, Kangawa K, Christiansen JS, et al. Weight loss increases circulating levels of ghrelin in human obesity. Clinical Endocrinology. 2002; 56(2):203-6. [DOI:10.1046/j.0300-0664.2001.01456.x] [DOI:10.1046/j.0300-0664.2001.01456.x]
24. Tschöp M, Weyer C, Tataranni PA, Devanarayan V, Ravussin E, Heiman ML. Circulating ghrelin levels are decreased in human obesity. Diabetes. 2001; 50(4):707-9. [DOI:10.2337/diabetes.50.4.707] [DOI:10.2337/diabetes.50.4.707]
25. Tolle V, Kadem M, Bluet-Pajot MT, Frere D, Foulon C, Bossu C, et al. Balance in ghrelin and leptin plasma levels in anorexia nervosa patients and constitutionally thin women. The Journal of Clinical Endocrinology & Metabolism. 2003; 88(1):109-16. [DOI:10.1210/jc.2002-020645] [DOI:10.1210/jc.2002-020645]
26. Shiiya T, Nakazato M, Mizuta M, Date Y, Mondal MS, Tanaka M, et al. Plasma ghrelin levels in lean and obese humans and the effect of glucose on ghrelin secretion. The Journal of Clinical Endocrinology & Metabolism. 2002; 87(1):240-4. [DOI:10.1210/jcem.87.1.8129] [DOI:10.1210/jcem.87.1.8129]
27. Andrews ZB, Liu ZW, Walllingford N, Erion DM, Borok E, Friedman JM, et al. UCP2 mediates ghrelin's action on NPY/AgRP neurons by lowering free radicals. Nature. 2008; 454(7206):846-51. [DOI:10.1038/nature07181] [DOI:10.1038/nature07181]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |