دوره 19، شماره 3 - ( پاییز 1403 )
جلد 19 شماره 3 صفحات 469-452 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mojarrad A, Sadri Damirchi E, Sheykholeslami A, Rezaii Sharif A, Abbasi V. Comparing the Effects of Transcranial Direct Current Stimulation and Cognitive Rehabilitation on Language Skills and Attention in Elderly With Mild Alzheimer's Disease. Salmand: Iranian Journal of Ageing 2024; 19 (3) :452-469
URL: http://salmandj.uswr.ac.ir/article-1-2631-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-2631-fa.html
مجرد آرزو، صدری دمیرچی اسماعیل، شیخ الاسلامی علی، رضایی شریف علی، عباسی وحید. مقایسه اثربخشی تحریک الکتریکی مغز با جریان مستقیم و توانبخشی شناختی بر مهارتهای زبانی و توجه در سالمندان مبتلا به آلزایمر خفیف. سالمند: مجله سالمندی ایران. 1403; 19 (3) :452-469
آرزو مجرد1 

 ، اسماعیل صدری دمیرچی*2
، اسماعیل صدری دمیرچی*2 

 ، علی شیخ الاسلامی1
، علی شیخ الاسلامی1 

 ، علی رضایی شریف1
، علی رضایی شریف1 

 ، وحید عباسی3
، وحید عباسی3 




 ، اسماعیل صدری دمیرچی*2
، اسماعیل صدری دمیرچی*2 

 ، علی شیخ الاسلامی1
، علی شیخ الاسلامی1 

 ، علی رضایی شریف1
، علی رضایی شریف1 

 ، وحید عباسی3
، وحید عباسی3 


1- گروه مشاوره، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران.
2- گروه مشاوره، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران. ،e.sadri@uma.ac.ir
3- گروه نورولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل، ایران.
2- گروه مشاوره، دانشکده علوم تربیتی و روانشناسی، دانشگاه محقق اردبیلی، اردبیل، ایران. ،
3- گروه نورولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اردبیل، اردبیل، ایران.
واژههای کلیدی: تحریک الکتریکی مغز با جریان مستقیم، توانبخشی شناختی، مهارتهای زبانی، توجه، آلزایمر خفیف
متن کامل [PDF 7126 kb]
(1544 دریافت)
| چکیده (HTML) (3331 مشاهده)
بحث
پژوهش حاضر با هدف مقایسه اثربخشی روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت بر مهارتهای زبانی و توجه در سالمندان مبتلا به آلزایمر خفیف انجام گرفت. نتیجه اول پژوهش نشان داد درمورد متغیر توجه بهجز مؤلفه توجه و تمرکز تفاوت معنیداری بین 3 زمان موردآزمایش (پیشآزمون پسآزمون و دوره پیگیری) وجود داشت. اگرچه میانگینهای 2 متغیر جهتیابی و بهیادسپاری با زمان تغییر کردهاند، ولی اثر متقابل بین زمان و گروههای آزمایش (کنترل، گروه توانبخشی شناختی کوتاهمدت و گروه تحریک الکتریکی مغز با جریان مستقیم) در هیچکدام از 3 متغیر معنیدار نبود. این بدین معنی است که بین میانگینها هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. به عبارت خیلی سادهتر، هیچیک از روشهای موردمطالعه روی شاخص توجه تأثیر معناداری نداشته و تنها عامل زمان موجب تغییر در شاخص توجه شده است. نتیجه حاضر با نتیجه پژوهش رضاپورجاغرق و همکاران [41] همسو و با نتایج پژوهشهای میرزائی و همکاران [29]، سیهجانی و همکارانم [42]، کورس و همکاران [30] و ایرازوکی و همکاران [31] ناهمسو است. در مطالعه حاضر روشهای مداخله هرچند تأثیر معناداری را نشان نمیدهد، اما انتظار میرود اگر مداخلات طولانیتر میشد، احتمال معنادار شدن تغییر نیز بیشتر میشد. به نظر میرسد علت ناهمسویی نتیجه پژوهش حاضر با نتایج پیشین نیز همین امر باشد، از سوی دیگر پژوهشهای پیشین به بررسی مجموعه گستردهای از عملکردهای شناختی پرداخته و اثربخشی روش درمانی را بر مجموعهای از عملکردهای شناختی گزارش کردهاند. درصورتیکه در پژوهش حاضر تنها به بررسی 2 مؤلفه پرداخته شده و احتمال اینکه بر سایر مؤلفهها تأثیر گذاشته باشد، وجود دارد. باتوجهبه نظریه لوریا [35] مناطق سالم مغز در زمانی که ناحیه مجاور یا مشابه آن در یک نیمکره یا نیمکره دیگر آسیب ببینند، به انجام وظایف نقاط آسیبدیده خواهند پرداخت و شواهد تجربی و مطالعات تصویربرداری مغزی نیز از این نظریه حمایت کردهاند [43]. بنابراین امکان دارد روشهای مداخله موجب بهبود سایر عملکردهای شناختی فرد شود در درازمدت توجه فرد نیز بهبود یابد. همچنین در تبیین عدم اثربخشی درمان تحریک الکتریکی مغز با جریان مستقیم و ناهمسویی نتیجه پژوهش حاضر با برخی پژوهشهای سابق میتوان چنین گفت که تفاوتها ممکن است به دلیل تغییرات پارامترهای خاص مطالعه از جمله این موارد باشد: مدت تحریک، محل قرارگیری الکترود، نوع بیمار و آسیبشناختی، تعداد جلسات، شدت جریان، زمانبندی تحریک و عدم تأیید اثر طولانیمدت [44].
همچنین نتیجه دیگر پژوهش نشان داد بهجز 2 مؤلفه نوشتن و نامگذاری تفاوت معنیداری بین 3 زمان موردآزمایش (پیشآزمون، پسآزمون و دوره پیگیری) وجود نداشت. این بدین معنی است که بین میانگینهای 4 مؤلفه درک مطلب، تکرار، فهم مطلب و خواندن هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. به عبارت خیلی سادهتر، هیچ یک از روشهای موردمطالعه روی 4 مؤلفه درک مطلب، تکرار، فهم مطلب و خواندن تأثیر نداشته است. همچنین هر دو روش توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم تأثیر معنیدار مشابهی بر مقدار نوشتن در زمان پسآزمون دارند. این در حالی است که برعکس روش تحریک الکتریکی مغز با جریان مستقیم که توانسته است در بلندمدت نیز خوب عمل کند، روش توانبخشی شناختی کوتاهمدت در دوره پیگیری عملکرد خوبی نداشته است. درمورد متغیر نامگذاری، تنها روش تحریک الکتریکی مغز با جریان مستقیم در زمان پسآزمون تأثیر معنیداری داشته است. همچنین هر دو روش توانبخشی شناختی کوتاهمدت و تحریک الکتریکی مغز با جریان مستقیم بهطور معنیداری موجب بهبود مؤلفه نوشتن در پسآزمون شدهاند. البته برعکس روش توانبخشی شناختی کوتاهمدت، روش تحریک الکتریکی مغز با جریان مستقیم توانسته است این بهبود را در دوره پیگیری حفظ کند. درمورد متغیر نامگذاری باید گفت روش توانبخشی شناختی کوتاهمدت بهتر عمل کرده و نهتنها در پسآزمون موجب بهبود عملکرد شده، بلکه در دوره پیگیری نیز این معنیداری را حفظ کرده است. این در حالی است که روش تحریک الکتریکی مغز با جریان مستقیم فقط در زمان پسآزمون تأثیر معنیداری داشته است. نتیجه پژوهش حاضر با نتایج فرنگی و همکاران [45] و پانچولی و ویجای [23] همسو است.
در تبیین اثر تحریک الکتریکی فراجمجمهای مغز در ناحیه پیشپیشانی بر عملکرد شناختی باید گفت باتوجهبه اهمیت و نقش ناحیه پیشپیشانی بر اعمال شناختی به نظر میرسد تحریک این منطقه، ظرفیت بسیاری در بالا بردن عملکردهای شناختی داشته باشد؛ یعنی ممکن است تحریک قشر پیشپیشانی باعث افزایش کارکردهای شناختی و تحریکپذیری کورتکسی در شبکههای مربوط به کارکردهای شناختی شود؛ زیرا این ناحیه با کارکردها و واکنشهای شناختی درگیر است که خود موجب بهبود عملکرد شناختی در سالمندان مبتلا به آلزایمر میشود [46]. درعینحال ممکن است شبکههای کورتکسی که در انواع دیگر تکالیف شناختی درگیر هستند نیز به سبب جریان ثابت الکتریکی ناحیه پیشپیشانی و غلظت یونی، موجب تحریک شدن مناطق دیگر شود. از طرفی، مکانیسمهای آنژیوژنیک (تحریک رگزایی در بافتها و اندامهای کمخون مغز) ممکن است زمینهساز پیشرفتهای شناختی ناشی از تحریک فراجمجمهای مغز در سالمندان مبتلا به آلزایمر باشد. مورد دیگر که میتوان به آن اشاره کرد، نقش تحریک الکتریکی در افزایش رهاسازی دوپامین در قشر پیشپیشانی است که در بهبود حافظه مؤثر است و میتواند منجر به پایداری فعالیت نورونی در این ناحیه و فرایندهای حافظه کاری شود [47].
همچنین در تبیین اثربخشی روش توانبخشی شناختی کوتاهمدت میتوان گفت به رغم وجود برخی مفروضات مبنی بر ناتوانی یادگیری جدید بین بیماران مبتلا به آلزایمر، نتایج حاضر نشان میدهد یادگیری در بیماران آلزایمری امکانپذیر است؛ اگرچه میزان یادگیری ممکن است وابسته به نوع و شدت بیماری باشد. بهطور کل نتیجه حاضر نشاندهنده قابلیت یادگیری بیماران آلزایمری نوع خفیف است و از این منطق حمایت میکند که تمرین و تکرار بهصورت منظم یا نامنظم، موجب یادگیری است؛ حتی در کسانی که به نظر فاقد توانایی در یادگیری هستند. براساس یافته موجود، لزوم توانبخشی شناختی بیماران آلزایمری بیشازپیش، برجسته شده و متخصصان را به ضرورت آن رهنمون میشود [48].
نتیجهگیری نهایی
نتایج مطالعه نشان داد هر دو روش موردمطالعه روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت موجب بهبود مؤلفههای نوشتن و نامگذاری متغیرهای مهارتهای زبانی میشوند. از محدودیتهای پژوهش حاضر میتوان به استفاده از روش نمونهگیری در دسترس اشاره کرد، بنابراین پیشنهاد میشود در پژوهشهای آتی بهمنظور افزایش دقت از روشهای نمونهگیری تصادفی استفاده شود. همچنین پیشنهاد میشود اثربخشی روش ترکیبی روش تحریک الکتریکی فراجمجمهای و روش توانبخشی شناختی کوتاهمدت نیز مورد آزمایش قرار گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه برگرفته از رساله دکتری آرزو مجرد با کد اخلاق IR.UMA.REC.1401.008 است. شرکتکنندگان قبل از ورود به مطالعه یک رضایتنامه کتبی آگاهانه را تکمیل کردند. نحوه و هدف از پژوهش برای شرکتکنندگان بهطور کامل توضیح داده شد.
حامی مالی
این مقاله حامی مالی نداشته است.
مشارکت نویسندگان
مفهومسازی: آرزو مجرد، اسماعیل صدری دمیرچی، روششناسی: علی شیخالاسلامی، علی رضایی شریف، آرزو مجرد، اعتبارسنجی: علی رضایی شریف، تحلیل: علی شیخالاسلامی، تحقیق و بررسی: آرزو مجرد، منبع: آرزو مجرد، وحید عباسی، نگارش پیشنویس: آرزو مجرد، ویراستاری و نهاییسازی: اسماعیل صدری دمیرچی، بصریسازی: وحید عباسی، نظارت: اسماعیل صدری دمیرچی، وحید عباسی، مدیریت پروژه: اسماعیل صدری دمیرچی.
تعارض منافع
بنابراظهار نویسندگان این مقاله تعارض منافع ندارد.
متن کامل: (1354 مشاهده)
مقدمه
انجمن جهانی آلزایمر با انتشار گزارش جهانی در سال 2019 اعلام کرده است که هر 3 ثانیه یک نفر در جهان به دمانس مبتلا میشود، ولی بیشتر این افراد تشخیص داده نشده و حمایت نمیشوند. هزینه سالیانه دمانس 1 تریلیون دلار است و پیشبینی میشود این میزان تا سال 2030 2 برابر شود [1]. در سرتاسر دنیا 70 درصد از افرادی که از دمانس رنج میبرند، مبتلا به آلزایمر هستند که شایعترین نوع دمانس است [2].
ایران نیز جزو کشورهایی است که با این مشکل روبهرو است [3]. طبق اطلاعات انجمن آلزایمر ایران آمار دقیقی از تعداد افراد مبتلا به آلزایمر در کشور وجود ندارد، ولی احتمال میرود حدود 300 تا 450 هزار نفر در ایران مبتلا به این بیماری باشند [3] که باتوجهبه آمارها، 115 میلیون نفر نیز در سراسر دنیا تا سال 2050 تحت تأثیر این بیماری قرار خواهند گرفت [3]. افراد مبتلا به آلزایمر پیامدهای مختلفی در اثر این بیماری که با آسیب به مغز همراه است را تجربه میکنند؛ از جمله این پیامدها اختلال در حافظه، تفکر، قضاوت، رفتار، خلقوخو و نیز اختلال در انجام فعالیتهای روزانه فرد مبتلا است [4].
این بیماری با اختلال در حافظه کوتاهمدت شروع و با پیشرفت بیماری، سایر عملکردهای شناختی و عملکردی فرد بیمار را نیز تحت تأثیر قرار میدهد [5]. عملکرد شناختی به ظرفیتهای ذهنی متعددی شامل تفکر، استدلال، یادآوری و یادگیری، حل مسئله، تصمیمگیری و توجه اشاره دارد. رویکرد غالب در سنجش و مفهومسازی عملکرد شناختی، روانسنجی بوده که از تلاشهایی آغاز شده است که سعی در کمی کردن ظرفیتهای شناختی داشتهاند [6]. به بیان دیگر عملکرد شناختی مجموعهای از ظرفیتها را شامل میشود که به فرد، توانایی بازشناسی، پردازش و پاسخ به اطلاعات ورودی را میدهد [7] از اساسیترین مؤلفههای عملکرد شناختی که در افراد مبتلا به آلزایمر دچار اختلال میشود توجه است. توجه یکی از مهمترین عملکردهای اساسی در مغز انسان است که اجزای آن پایه و اساس سایر فرایندهای شناختی است [8]. توجه به یکسری عملیات پیچیده ذهنی اطلاق میشود که شامل تمرکز کردن یا درگیر شدن نسبت به هدف، نگه داشتن یا تحمل کردن و گوشبهزنگ بودن در یک زمان طولانی، رمزگردانی ویژگیهای محرک و تغییر تمرکز از یک هدف به هدف دیگر است [9]. توجه، پایه و اساس تمام کارکردهای شناختی است، زیرا دروازه ورود اطلاعات به مغز است [10]. توجه به توانایی تمرکز روی محرکهای خاص اطلاق میشود که یکی از قابلتوجهترین تأثیرهای سالمندی در تکالیف پیچیده در متغیر توجه دیده میشود [11]. یکی دیگر از مؤلفههای مهم شناختی که تحتتأثیر آلزایمر قرار میگیرد، زبان است. زبان یک مهارت اساسی و پایه است [12] که دارای 2 کارکرد اساسی و حیاتی برای بشر است. نخست اینکه به ما امکان برقراری ارتباط با دیگران را میدهد و دوم، امر تفکر و اندیشیدن را امکانپذیر میکند. مطابق نظر براین، زبان چیزی است که کنشهای شناختی انسان را از حیوانات پستتر متمایز میکند. از دیدگاه او برای فهم انسان لازم است که چگونگی کنشهای زبان او درک شود [13]. زبان یکی از عملکردهای عالی کرتکس مغز است که رشد آن در هر فرد به ساختار عملکردی و کالبدشناختی او ازلحاظ ژنتیکی و تحریکات کلامی ناشی از محیط بستگی دارد. زبان یکی از راههای برقراری ارتباط و یک ابزار اجتماعی جهت تعامل با دیگران است. بنابراین باید زبان را نه یک محصول، بلکه یک فرایند یا عامل مؤثر و پویا دانست. زبان یک نظام متداول از نمادهای قراردادی است که بهمنظور ذخیره کردن و تبادل اطلاعات بهطور قاعدهمند با هم ترکیب میشوند [14].
برای درمان بیماری آلزایمر در سالهای اخیر، تکنیکهای غیرتهاجمی تحریک مغزی مختلفی مورد استفاده قرار گرفته است که میتوانند منجر به تعدیل در تحریکپذیری و فعالیت کورتکسی و در نتیجه، ایجاد تغییرات در کارکردهای شناختی و رفتاری شوند [15, 16]. تحریک الکتریکی مغز با جریان مستقیم ازجمله چنین تکنیکهایی است. از حدود 50 سال پیش نشان داده شده است که بهکارگیری جریانهای مستقیم زیرآستانهای و نسبتاً ضعیف بر روی کورتکس حیوانات میتواند منجر به ایجاد تغییراتی قطبی در فعالیت کورتکسی و همچنین تحریکپذیری آن شود که میتواند چندین ساعت پس از مداخله به طول بینجامد [17]. مطالعات مربوط به نمونههای انسانی نیز نتایج فوق را مورد تأیید قرار داده است [18]. کلید درک چگونگی کارکرد تکنولوژیهای تحریک مغزی، فهم ساختار مدارگونه مغز است که در کارکردهای بهنجار و نابهنجار مغز نقش اساسی ایفا میکند. درنتیجه تحریک عصبی بهوسیله تحریک مغزی، آبشاری از وقایع مولکولی روی میدهد که منجر به تغییرات عصبی درازمدتی بهخصوص در سطح سیناپسی میشود که میتوانند تا چند ساعت، روز و یا مدت طولانیتری نسبت به طول تحریک واردشده، دوام آورند [19]. در این روش اصول کار به این صورت است که 2 الکترود یکی قطب مثبت و دیگری قطب منفی ازطریق یک پد اسفنجی که با محلول رسانا مثل سرم شستوشو مرطوب شده است بر روی سر قرار میگیرند. جریان الکتریکی توسط این الکترودها پس از عبور از نواحی مختلف (پوست سر، جمجمه و غیره) خود را به سطح قشر مغز میرساند. جریانی که به این ناحیه رسیده نورون را دارای بار الکتریکی میکند و پس از ایجاد قطب مثبت و منفی منجر به تغییر فعالیت آن ناحیه میشود [20]. قرار دادن آند بر روی قشر پیشپیشانی پشتی جانبی سمت چپ و کاتد در ناحیه راست این قشر، رایجترین پروتکل تحریک فراجمجمهای مغز برای بهبود حافظه فعال، عملکرد شناختی و وضعیت ذهنی است [21]. نتایج مطالعات نشاندهنده نقش درمانی مثبت و امیدوارکننده استفاده از تحریک غیرتهاجمی مغز در اختلالات عملکرد حافظه و حفظ عملکرد شناختی مربوط به آلزایمر است. وانگ و همکاران [22] در پژوهشی نشان دادند تحریک فراجمجمهای مغز در ناحیه قشر خلفی جانبی پیشپیشانی در سالمندان مبتلا به آلزایمر موجب بهبود علمکرد شناختی در آزمونهای وضعیت شناختی و درجهبندی زوال عقل میشود. همچنین پانچولی و ویجای [23]، ایناگاوا و همکاران [24] کروز گنزالس و همکاران [25] و ددونکر و همکاران [26] نیز بیان کردند تحریک فراجمجمهای منجر به بهبود حوزههای شناختی خاص و کارکردهای اجرایی در بیماران مبتلا به اختلال شناختی خفیف و آلزایمر میشود.
یکی دیگر از انواع مداخلات که امروزه توجه پژوهشگران و درمانگران زیادی را به خود جلب کرده است، مداخلات شناختی مغز است که توانبخشی شناختی نامیده میشود. توانبخشی شناختی اصطلاحی است که برای درمان و بازتوانی اختلالات شناختی استفاده میشود که هدف اصلی آن بهبود نقایص و عملکرد شناختی بیمار از قبیل حافظه، عملکرد اجرایی، درک اجتماعی و توجه و تمرکز است. درمان توانبخشی شناختی بر اصولی از شکلپذیری عصبی مبتنی است که شامل تمرینهای هدفمند برای بهبود حوزههای گوناگون شناخت مانند حافظه، توجه، زبان و کارکردهای اجرایی است [27]. درواقع توانبخشی شناختی، به آموزشهایی اطلاق میشوند که مبتنی بر یافتههای علومشناختی سعی میکنند عملکردهای شناختی (دقت، توجه، ادراک دیداریفضایی، تمییز شنیداری، انواع حافظه مخصوصاً حافظه کاری و سایر کارکردهای اجرایی) را بهبود بخشیده یا ارتقا دهند که همه این مورد بر اصل نوروپلاستیسیتی یا همان انعطافپذیری مغز اشاره دارد و روشی جهت بازگرداندن ظرفیتهای شناختی ازدسترفته است که توسط تمرینات و ارائه محرکهای هدفمند صورت میپذیرد و هدف آن بهبود عملکرد فرد در اجرای فعالیتها ازطریق بهبود ادراک، توجه، حافظه، حل مسئله، هوشیاری و مفهومسازی است [28]. مطالعات نشان داده این برنامهها و آموزش شناختی در کاهش نواقص شناختی و حتی در بهبود عملکردهای شناختی در سالمندان سالم و همچنین در مبتلایان به اختلال شناختی خفیف و زوال عقل مؤثر بوده است [29]. برای مثال کورس و همکاران [30]، ایرازوکی و همکاران [31] و هانتلی و همکاران [32] نشان دادند در بیماری آلزایمر تمرینات شناختی تأثیر قابلملاحظهای در عملکردهای شناختی (حتی عملکردهایی که تمرین دادهنشده) دارد.
مراقبت از بیماران آلزایمر نیازمند صرف وقت و هزینه زیادی است که سبب ایجاد مشکلات عدیده برای بیمار و خانواده وی میشود درحالیکه تشخیص و درمان این بیماری در مراحل اولیه میتواند با کند کردن سرعت پیشرفت بیماری، به تعویق انداختن کاهش اختلال عملکرد فردی و کاهش هزینههای درمان، باعث کاهش فشار و بار بیماری بر روی اطرافیان شود [33]. از سوی دیگر باتوجهبه اینکه درزمینه تحریک فراجمجمهای مغز در ناحیه پیشپیشانی و اثربخشی آن بر روی سالمندان مبتلا به آلزایمر در ایران پژوهشهای اندکی انجام شده است. از طرفی با بررسیهایی که انجام شد ملاحظه شد اکثر پروتکلهای توانبخشی شناختی بسیار طولانیمدتاند و نیاز به جلسات زیادی دارند. ازاینرو پژوهش حاضر به دنبال پاسخگویی به این پرسش است که آیا بین اثربخشی برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم بر مهارتهای زبانی و توجه و جهتیابی در سالمندان مبتلا به آلزایمر خفیف تفاوت معنادار وجود دارد؟
روش مطالعه
روش پژوهش حاضر، یک روش نیمهآزمایشی با 2 گروه آزمایش و یک گروه کنترل است که با استفاده از روش پیشآزمون و پسآزمون انجام شده است. جامعه آماری پژوهش حاضر، کلیه سالمندان بالای 65 سال مبتلا به آلزایمر خفیف بودند که در سال 1401 به مطب پزشک مغز و اعصاب مراجعه کرده بودند. از بین این افراد، 63 نفر بهصورت نمونهگیری دردسترس انتخاب شدند و سپس بهصورت تصادفیسازی (قرعهکشی) در 2 گروه آزمایش و 1 گروه کنترل (هر گروه 21 نفر) گمارده شدند (تصویر شماره 1).
انجمن جهانی آلزایمر با انتشار گزارش جهانی در سال 2019 اعلام کرده است که هر 3 ثانیه یک نفر در جهان به دمانس مبتلا میشود، ولی بیشتر این افراد تشخیص داده نشده و حمایت نمیشوند. هزینه سالیانه دمانس 1 تریلیون دلار است و پیشبینی میشود این میزان تا سال 2030 2 برابر شود [1]. در سرتاسر دنیا 70 درصد از افرادی که از دمانس رنج میبرند، مبتلا به آلزایمر هستند که شایعترین نوع دمانس است [2].
ایران نیز جزو کشورهایی است که با این مشکل روبهرو است [3]. طبق اطلاعات انجمن آلزایمر ایران آمار دقیقی از تعداد افراد مبتلا به آلزایمر در کشور وجود ندارد، ولی احتمال میرود حدود 300 تا 450 هزار نفر در ایران مبتلا به این بیماری باشند [3] که باتوجهبه آمارها، 115 میلیون نفر نیز در سراسر دنیا تا سال 2050 تحت تأثیر این بیماری قرار خواهند گرفت [3]. افراد مبتلا به آلزایمر پیامدهای مختلفی در اثر این بیماری که با آسیب به مغز همراه است را تجربه میکنند؛ از جمله این پیامدها اختلال در حافظه، تفکر، قضاوت، رفتار، خلقوخو و نیز اختلال در انجام فعالیتهای روزانه فرد مبتلا است [4].
این بیماری با اختلال در حافظه کوتاهمدت شروع و با پیشرفت بیماری، سایر عملکردهای شناختی و عملکردی فرد بیمار را نیز تحت تأثیر قرار میدهد [5]. عملکرد شناختی به ظرفیتهای ذهنی متعددی شامل تفکر، استدلال، یادآوری و یادگیری، حل مسئله، تصمیمگیری و توجه اشاره دارد. رویکرد غالب در سنجش و مفهومسازی عملکرد شناختی، روانسنجی بوده که از تلاشهایی آغاز شده است که سعی در کمی کردن ظرفیتهای شناختی داشتهاند [6]. به بیان دیگر عملکرد شناختی مجموعهای از ظرفیتها را شامل میشود که به فرد، توانایی بازشناسی، پردازش و پاسخ به اطلاعات ورودی را میدهد [7] از اساسیترین مؤلفههای عملکرد شناختی که در افراد مبتلا به آلزایمر دچار اختلال میشود توجه است. توجه یکی از مهمترین عملکردهای اساسی در مغز انسان است که اجزای آن پایه و اساس سایر فرایندهای شناختی است [8]. توجه به یکسری عملیات پیچیده ذهنی اطلاق میشود که شامل تمرکز کردن یا درگیر شدن نسبت به هدف، نگه داشتن یا تحمل کردن و گوشبهزنگ بودن در یک زمان طولانی، رمزگردانی ویژگیهای محرک و تغییر تمرکز از یک هدف به هدف دیگر است [9]. توجه، پایه و اساس تمام کارکردهای شناختی است، زیرا دروازه ورود اطلاعات به مغز است [10]. توجه به توانایی تمرکز روی محرکهای خاص اطلاق میشود که یکی از قابلتوجهترین تأثیرهای سالمندی در تکالیف پیچیده در متغیر توجه دیده میشود [11]. یکی دیگر از مؤلفههای مهم شناختی که تحتتأثیر آلزایمر قرار میگیرد، زبان است. زبان یک مهارت اساسی و پایه است [12] که دارای 2 کارکرد اساسی و حیاتی برای بشر است. نخست اینکه به ما امکان برقراری ارتباط با دیگران را میدهد و دوم، امر تفکر و اندیشیدن را امکانپذیر میکند. مطابق نظر براین، زبان چیزی است که کنشهای شناختی انسان را از حیوانات پستتر متمایز میکند. از دیدگاه او برای فهم انسان لازم است که چگونگی کنشهای زبان او درک شود [13]. زبان یکی از عملکردهای عالی کرتکس مغز است که رشد آن در هر فرد به ساختار عملکردی و کالبدشناختی او ازلحاظ ژنتیکی و تحریکات کلامی ناشی از محیط بستگی دارد. زبان یکی از راههای برقراری ارتباط و یک ابزار اجتماعی جهت تعامل با دیگران است. بنابراین باید زبان را نه یک محصول، بلکه یک فرایند یا عامل مؤثر و پویا دانست. زبان یک نظام متداول از نمادهای قراردادی است که بهمنظور ذخیره کردن و تبادل اطلاعات بهطور قاعدهمند با هم ترکیب میشوند [14].
برای درمان بیماری آلزایمر در سالهای اخیر، تکنیکهای غیرتهاجمی تحریک مغزی مختلفی مورد استفاده قرار گرفته است که میتوانند منجر به تعدیل در تحریکپذیری و فعالیت کورتکسی و در نتیجه، ایجاد تغییرات در کارکردهای شناختی و رفتاری شوند [15, 16]. تحریک الکتریکی مغز با جریان مستقیم ازجمله چنین تکنیکهایی است. از حدود 50 سال پیش نشان داده شده است که بهکارگیری جریانهای مستقیم زیرآستانهای و نسبتاً ضعیف بر روی کورتکس حیوانات میتواند منجر به ایجاد تغییراتی قطبی در فعالیت کورتکسی و همچنین تحریکپذیری آن شود که میتواند چندین ساعت پس از مداخله به طول بینجامد [17]. مطالعات مربوط به نمونههای انسانی نیز نتایج فوق را مورد تأیید قرار داده است [18]. کلید درک چگونگی کارکرد تکنولوژیهای تحریک مغزی، فهم ساختار مدارگونه مغز است که در کارکردهای بهنجار و نابهنجار مغز نقش اساسی ایفا میکند. درنتیجه تحریک عصبی بهوسیله تحریک مغزی، آبشاری از وقایع مولکولی روی میدهد که منجر به تغییرات عصبی درازمدتی بهخصوص در سطح سیناپسی میشود که میتوانند تا چند ساعت، روز و یا مدت طولانیتری نسبت به طول تحریک واردشده، دوام آورند [19]. در این روش اصول کار به این صورت است که 2 الکترود یکی قطب مثبت و دیگری قطب منفی ازطریق یک پد اسفنجی که با محلول رسانا مثل سرم شستوشو مرطوب شده است بر روی سر قرار میگیرند. جریان الکتریکی توسط این الکترودها پس از عبور از نواحی مختلف (پوست سر، جمجمه و غیره) خود را به سطح قشر مغز میرساند. جریانی که به این ناحیه رسیده نورون را دارای بار الکتریکی میکند و پس از ایجاد قطب مثبت و منفی منجر به تغییر فعالیت آن ناحیه میشود [20]. قرار دادن آند بر روی قشر پیشپیشانی پشتی جانبی سمت چپ و کاتد در ناحیه راست این قشر، رایجترین پروتکل تحریک فراجمجمهای مغز برای بهبود حافظه فعال، عملکرد شناختی و وضعیت ذهنی است [21]. نتایج مطالعات نشاندهنده نقش درمانی مثبت و امیدوارکننده استفاده از تحریک غیرتهاجمی مغز در اختلالات عملکرد حافظه و حفظ عملکرد شناختی مربوط به آلزایمر است. وانگ و همکاران [22] در پژوهشی نشان دادند تحریک فراجمجمهای مغز در ناحیه قشر خلفی جانبی پیشپیشانی در سالمندان مبتلا به آلزایمر موجب بهبود علمکرد شناختی در آزمونهای وضعیت شناختی و درجهبندی زوال عقل میشود. همچنین پانچولی و ویجای [23]، ایناگاوا و همکاران [24] کروز گنزالس و همکاران [25] و ددونکر و همکاران [26] نیز بیان کردند تحریک فراجمجمهای منجر به بهبود حوزههای شناختی خاص و کارکردهای اجرایی در بیماران مبتلا به اختلال شناختی خفیف و آلزایمر میشود.
یکی دیگر از انواع مداخلات که امروزه توجه پژوهشگران و درمانگران زیادی را به خود جلب کرده است، مداخلات شناختی مغز است که توانبخشی شناختی نامیده میشود. توانبخشی شناختی اصطلاحی است که برای درمان و بازتوانی اختلالات شناختی استفاده میشود که هدف اصلی آن بهبود نقایص و عملکرد شناختی بیمار از قبیل حافظه، عملکرد اجرایی، درک اجتماعی و توجه و تمرکز است. درمان توانبخشی شناختی بر اصولی از شکلپذیری عصبی مبتنی است که شامل تمرینهای هدفمند برای بهبود حوزههای گوناگون شناخت مانند حافظه، توجه، زبان و کارکردهای اجرایی است [27]. درواقع توانبخشی شناختی، به آموزشهایی اطلاق میشوند که مبتنی بر یافتههای علومشناختی سعی میکنند عملکردهای شناختی (دقت، توجه، ادراک دیداریفضایی، تمییز شنیداری، انواع حافظه مخصوصاً حافظه کاری و سایر کارکردهای اجرایی) را بهبود بخشیده یا ارتقا دهند که همه این مورد بر اصل نوروپلاستیسیتی یا همان انعطافپذیری مغز اشاره دارد و روشی جهت بازگرداندن ظرفیتهای شناختی ازدسترفته است که توسط تمرینات و ارائه محرکهای هدفمند صورت میپذیرد و هدف آن بهبود عملکرد فرد در اجرای فعالیتها ازطریق بهبود ادراک، توجه، حافظه، حل مسئله، هوشیاری و مفهومسازی است [28]. مطالعات نشان داده این برنامهها و آموزش شناختی در کاهش نواقص شناختی و حتی در بهبود عملکردهای شناختی در سالمندان سالم و همچنین در مبتلایان به اختلال شناختی خفیف و زوال عقل مؤثر بوده است [29]. برای مثال کورس و همکاران [30]، ایرازوکی و همکاران [31] و هانتلی و همکاران [32] نشان دادند در بیماری آلزایمر تمرینات شناختی تأثیر قابلملاحظهای در عملکردهای شناختی (حتی عملکردهایی که تمرین دادهنشده) دارد.
مراقبت از بیماران آلزایمر نیازمند صرف وقت و هزینه زیادی است که سبب ایجاد مشکلات عدیده برای بیمار و خانواده وی میشود درحالیکه تشخیص و درمان این بیماری در مراحل اولیه میتواند با کند کردن سرعت پیشرفت بیماری، به تعویق انداختن کاهش اختلال عملکرد فردی و کاهش هزینههای درمان، باعث کاهش فشار و بار بیماری بر روی اطرافیان شود [33]. از سوی دیگر باتوجهبه اینکه درزمینه تحریک فراجمجمهای مغز در ناحیه پیشپیشانی و اثربخشی آن بر روی سالمندان مبتلا به آلزایمر در ایران پژوهشهای اندکی انجام شده است. از طرفی با بررسیهایی که انجام شد ملاحظه شد اکثر پروتکلهای توانبخشی شناختی بسیار طولانیمدتاند و نیاز به جلسات زیادی دارند. ازاینرو پژوهش حاضر به دنبال پاسخگویی به این پرسش است که آیا بین اثربخشی برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم بر مهارتهای زبانی و توجه و جهتیابی در سالمندان مبتلا به آلزایمر خفیف تفاوت معنادار وجود دارد؟
روش مطالعه
روش پژوهش حاضر، یک روش نیمهآزمایشی با 2 گروه آزمایش و یک گروه کنترل است که با استفاده از روش پیشآزمون و پسآزمون انجام شده است. جامعه آماری پژوهش حاضر، کلیه سالمندان بالای 65 سال مبتلا به آلزایمر خفیف بودند که در سال 1401 به مطب پزشک مغز و اعصاب مراجعه کرده بودند. از بین این افراد، 63 نفر بهصورت نمونهگیری دردسترس انتخاب شدند و سپس بهصورت تصادفیسازی (قرعهکشی) در 2 گروه آزمایش و 1 گروه کنترل (هر گروه 21 نفر) گمارده شدند (تصویر شماره 1).
نمونهگیری طبق فرمول شماره 1 انجام شد [34].
1. n=2Cx[√ (SD12+SD22)/(M1– M2)]2
n=2x7/9[√(1.352+1.102)/(12.60–11.93)]2=2x7.9 x(2/58/10)=20.39=21
متغیرهای مستقل مداخله تحریک الکتریکی مغز با جریان مستقیم به مدت 10 جلسه 20 دقیقهای بهصورت هفتهای 1 بار روی یک گروه آزمایش اجرا شد. برنامه توانبخشی شناختی کوتاهمدت 9 جلسه (هر جلسه 90 دقیقه) به روش اسنادی و براساس رویکرد جایگزینی کارکرد سالم لوریا [35] مطابق جدول شماره 1 طراحی شد و پس از تأیید روایی محتوا توسط متخصصین، بهصورت هفتهای 1 بار روی گروه آزمایش دوم اعمال شد و بر روی گروه سوم هیچ مداخلهای انجام نشد.

بعد از خاتمه مداخله، پسآزمون با فاصله 1 هفته بر روی گروههای آزمایش و گروه کنترل اجرا شد. بعد از 1 ماه مجدداً گروههای موردمطالعه پیگیری شدند. ملاکهای ورود به پژوهش نداشتن بیماری قلبی، نبود زخم و خراشیدگی در سر، تمایل آگاهانه برای شرکت در پژوهش، نداشتن بیماری مسری، نداشتن بیماری صعبالعلاج مثل سرطان، نداشتن بیماری صرع و ملاکهای خروج شامل وجود اختلال شخصیت، سابقه سوءمصرف یا وابستگی به مواد مخدر یا الکل، دریافت خدمات روانشناسی دیگر در سایر مراکز در حال انجام پژوهش بود. جهت رعایت اخلاق پژوهش در ابتدا هدف پژوهش و اصل محرمانه بودن توضیح داده شد و پس از جلب رضایت آگاهانه، افراد داوطلب وارد پژوهش شدند. همچنین بعد از پایان پژوهش بهمنظور رعایت اصول اخلاقی برای گروه کنترل نیز روشهای درمانی، روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت (باتوجهبه اینکه بین اثربخشی 2 روش تأثیر معناداری نبود، از هر دو روش استفاده شد) اعمال شد. جهت جمعآوری اطلاعات از پرسشنامه زیر استفاده شد:
آزمون شناختی آدن بروک نسخه تجدیدنظرشده: آزمون شناختی آدن بروک برای تشخیص دمانس در مراحل اولیه ابتلا توسط ماتورانات و همکاران (2000) ساخته شده است که قادر به تشخیص افتراقی بین انواع دمانس، مانند بیماری آلزایمر، دمانس پیشانیگیجگاهی، فلج پیشرونده هسته فوقانی و دیگر سندرمهای پارکینسونی است و در تشخیص اختلالات شناختی در بیماران آسیبدیده مغزی کمککننده است [36]. پس از آن فرمهای تجدیدنظرشدهای از این آزمایش برای تشخیصهای بالینی مورد استفاده قرار گرفت [37، 38]. این آزمایش دارای 5 خردهآزمون است که هریک از خردهآزمونها یک عملکرد شناختی را مورد ارزیابی قرار میدهند. حداکثر نمره در این آزمون 100 نمره است که به ترتیب به موارد زیر اختصاص مییابد: توجه / جهتیابی (18 نمره)، حافظه (26 نمره)، روان و سلیس بودن (14 نمره)، زبان (26 نمره) و توانایی دیداری فضایی (16 نمره). نسخه فارسی پرسشنامه آدن بروک در سال 2009 براساس فرهنگ ایرانی هنجاریابی شد. ضریب آلفای کرونباخ کل آزمودنیها 0/84، برای گروه هنجار 0/97، برای گروه اختلال شناختی خفیف 0/88 و برای گروه آلزایمر خفیف برابر 0/93 به دست آمد که نشاندهنده پایایی بالای این آزمون محسوب میشود [39]. پروتکل توانبخشی در جدول شماره 1 ارائه شده است.
تحلیل آماری
در بخش تجزیهوتحلیل توصیفی شاخصهایی نظیر فراوانی، میانگین و انحراف استاندارد نمرات و در بخش استنباطی جهت تحلیل دادهها از آزمون تحلیل واریانس اندازهگیری مکرر در نرمافزار SPSS نسخه 23 استفاده شد. برای همه متغیرها سطح معناداری 0/05 مدنظر بود.
یافتهها
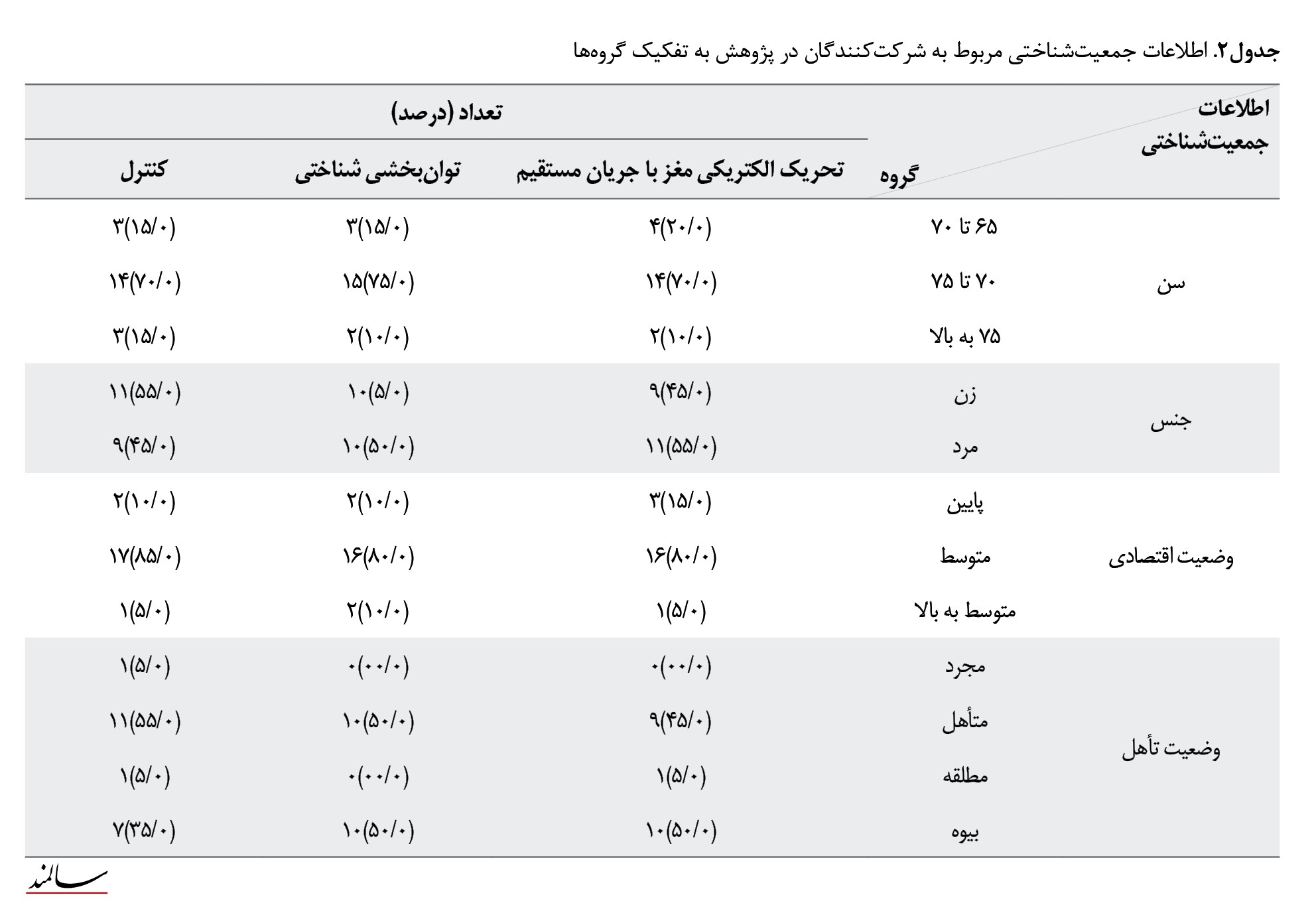
اطلاعات جمعیتشناختی مربوط به شرکتکنندگان در پژوهش از قبیل، سن، جنس، وضعیت اقتصادی و وضعیت تأهل به تفکیک گروهها در جدول شماره 2 گزارش شده است.
همچنین اطلاعات توصیفی (میانگین و انحرافمعیار) مربوط به متغیرهای توجه و جهتیابی و مؤلفههای مربوط به آنها به تفکیک 3 گروه کنترل، برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم در سه زمان مختلف پیشآزمون، پسآزمون و دوره پیگیری در جدول شماره 3 گزارش شده است.

برای بررسی تأثیرگذاری 2 روش موردمطالعه بر بهبود عملکرد شناختی از آزمون تحلیل واریانس اندازههای تکراری با 3 گروه کنترل، برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم و سه زمان مختلف پیشآزمون، پسآزمون و دوره پیگیری استفاده شد. جهت بررسی پیشفرضها از آزمون باکس، ویلکز و جهت بررسی نرمال بودن توزیع ماندهها از آزمون شاپیرو ویلک استفاده شد که در سطح معناداری 0/05 تأیید شد که این امر حاکی از برقراری پیششرط نرمال بودن توزیعها بود. همچنین فرضیه صفر برقراری کرویت براساس آزمون ماچولی بررسی شد، در حالتی که معنیداری این آزمون بزرگتر از 0/05 باشد، فرضیه صفر کرویت برقرار بوده و در نتیجه از آزمون با فرض برقراری کرویت استفاده میشود. در غیر این صورت، اگر کرویت برقرار نبود، برحسب اینکه شاخص اپسیلون بزرگتر از 0/75 باشد یا خیر، به ترتیب از تصحیح هاین فلدت یا تصحیح گرینهاوس جیسر استفاده میشود [40]. نتیجه آزمون ماچولی در جدول شماره 4 گزارش شده است.
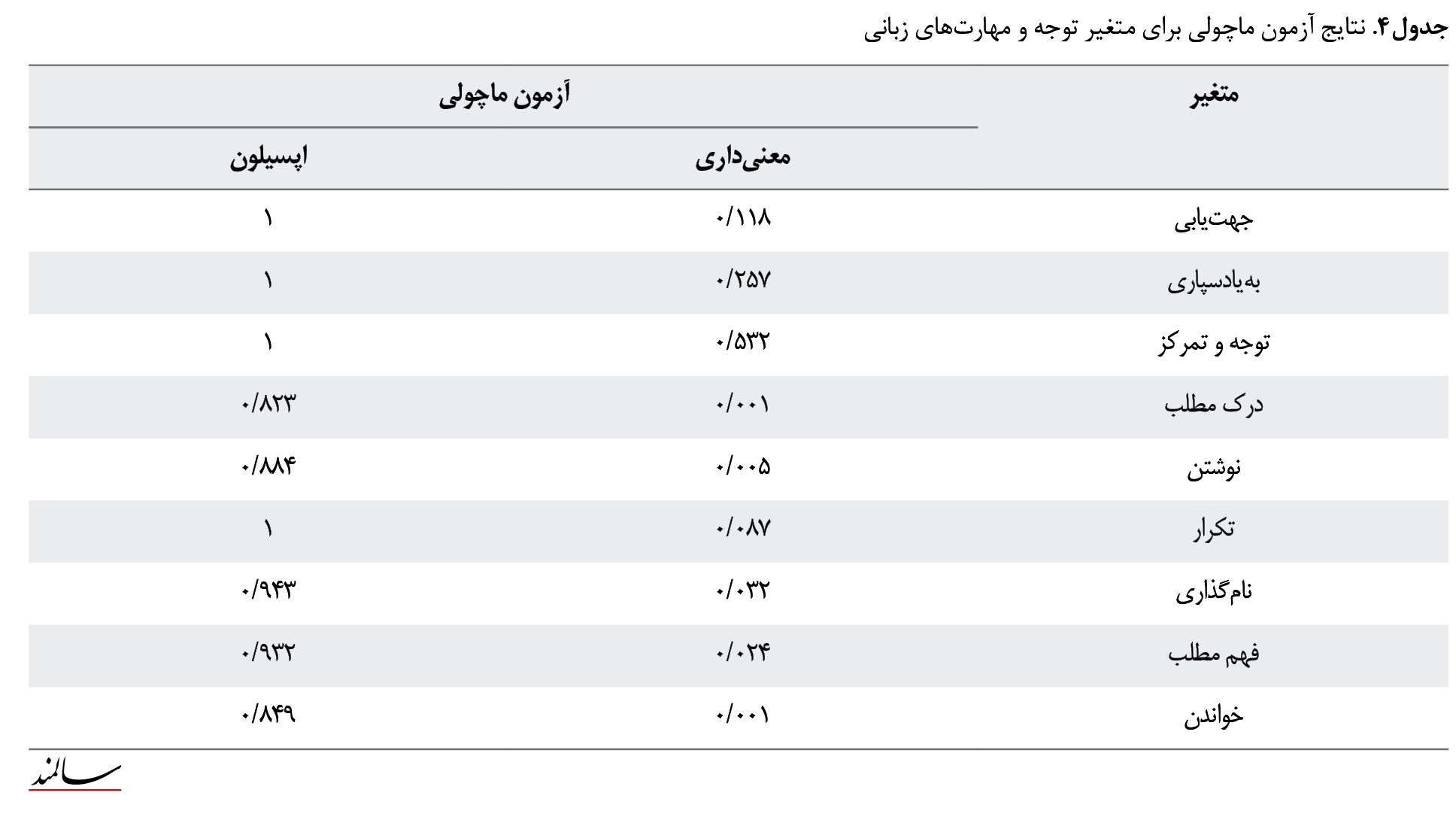
باتوجهبه نتایج آزمون ماچولی فرضیه کرویت برای هر 3 مؤلفه جهتیابی، بهیادسپاری و توجه و تمرکز در سطح اطمینان 0/05 رد نشد و درنتیجه برابری میانگینها با فرض کرویت گزارش شدند. همچنین برای مؤلفههای متغیر، مهارتهای زبان برای همه مؤلفهها بهجز «تکرار» در سطح اطمینان 0/95 رد شد و درنتیجه برابری میانگینها فقط برای این متغیر با فرض کرویت گزارش شد. در 5 مؤلفه دیگر باتوجهبه بزرگ بودن مقدار اپسیلون از آزمون هاین فلدت استفاده شد. همچنین نتیجه آزمون برابری میانگینها برای متغیرهای توجه و مهارتهای زبانی در جدول شماره 5 گزارش شده است.
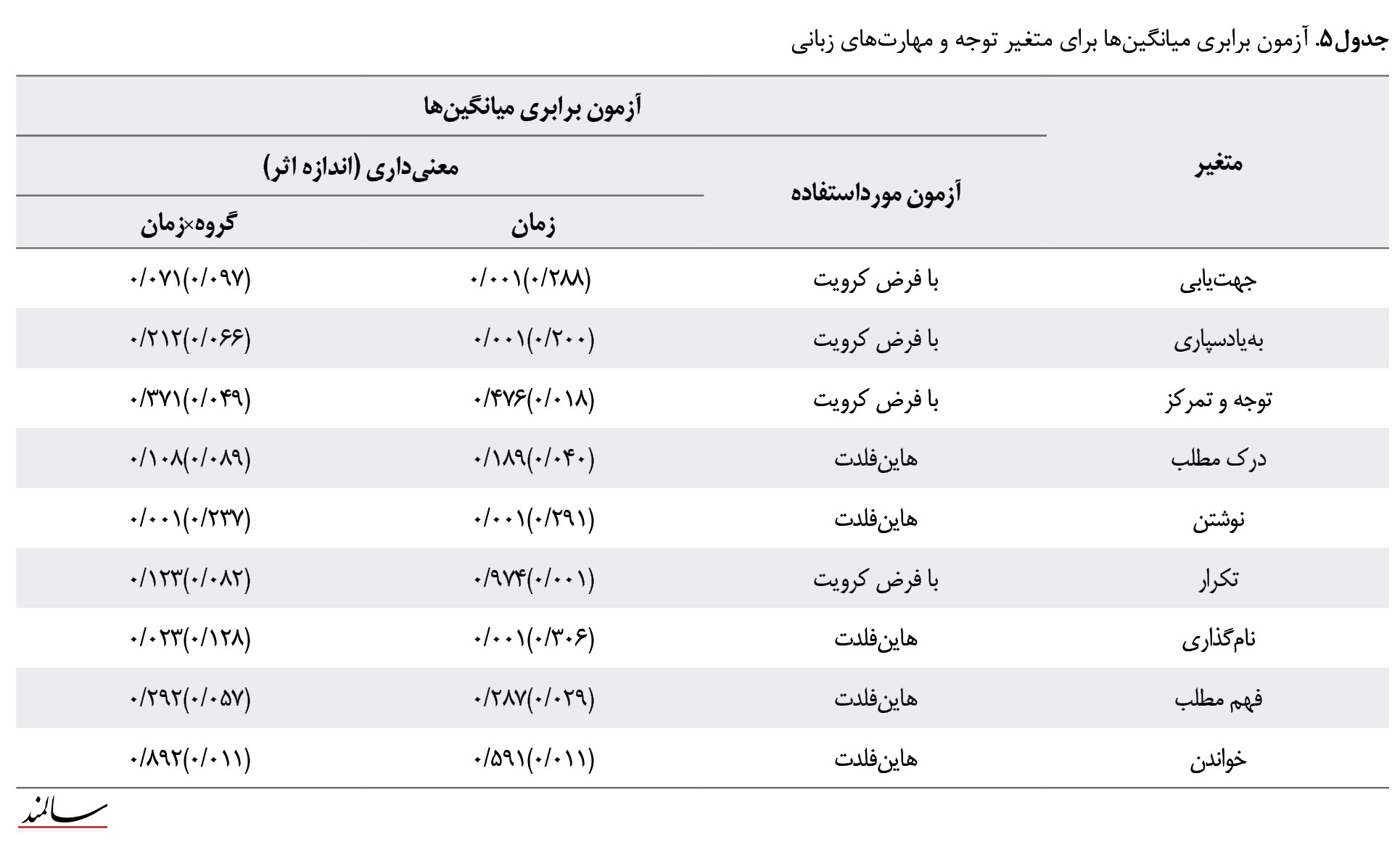
باتوجهبه جدول شماره 5 نتایج آزمون درمورد متغیر توجه نشان داد بهجز مؤلفه توجه و تمرکز تفاوت معنیداری بین 3 زمان موردآزمایش وجود داشت. مقدار اندازه اثر (اتا دو) برای 2 مؤلفه جهتیابی و بهیادسپاری به ترتیب برابر 0/288 و 0/200 به دست آمد. اندازه اثر هرچقدر به 1 نزدیکتر باشد میزان اختلاف بین زمانها بیشتر است. اگرچه میانگینهای 2 متغیر جهتیابی و بهیادسپاری با زمان تغییر کردهاند، ولی اثر متقابل بین زمان و گروههای آزمایش هیچکدام از 3 متغیر معنیدار نبود. این بدین معنی است که بین میانگینها هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. همچنین در خصوص متغیر مهارتهای زبان، نتایج آزمون نشان داد بهجز 2 مؤلفه نوشتن و نامگذاری تفاوت معنیداری بین 3 زمان موردآزمایش وجود نداشت. مقدار اندازه اثر (اتا دو) برای 2 مؤلفه نوشتن و نامگذاری به ترتیب برابر 0/291 و 0/306 به دست آمد. اثر متقابل بین زمان و گروههای آزمایش تنها برای 2 مؤلفه نوشتن و نامگذاری معنیدار بود. این بدین معنی است که بین میانگینهای 4 متغیر درک مطلب، تکرار، فهم مطلب و خواندن هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. برای بررسی اثرات متقابل بین زمان و گروه در 2 متغیر نوشتن و نامگذاری، برحسب همگن بودن یا نبودن واریانسها بین گروهها، به ترتیب از آزمون تعقیبی توکی یا آزمون تعقیبی دانت تی 3 برای مقایسه دوبهدوی میانگینها بین گروههای آزمایش به تفکیک 3 زمان استفاده شد. آزمون تعقیبی بونفرونی نیز برای مقایسه دوبهدوی میانگینها بین 3 زمان به تفکیک 3 گروه به کار رفت. نتایج این آزمونها به ترتیب در جدولهای شماره 6 و 7 گزارش شده است.
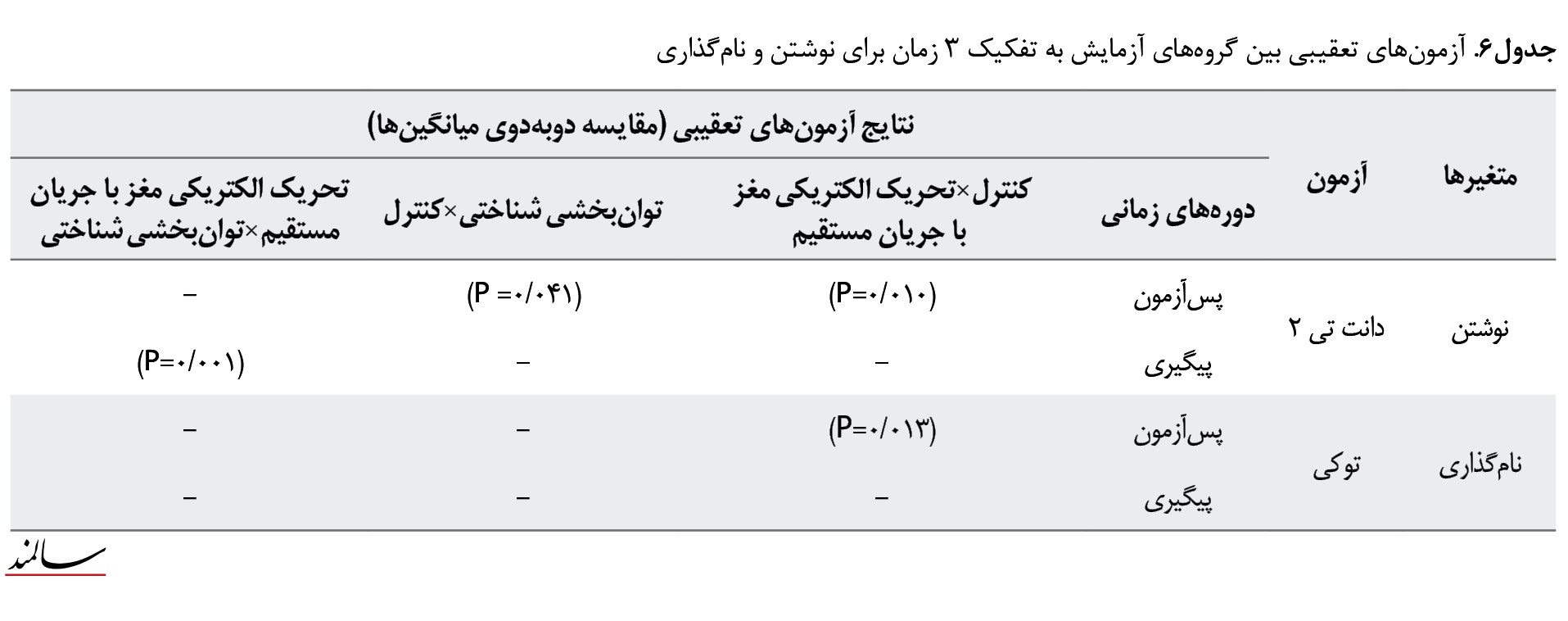
باتوجهبه نتایج گزارششده در جدول شماره 6 هر 2 روش پروتکل شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم تاثیر معنیدار مشابهی بر مقدار مؤلفه نوشتن در زمان پسآزمون دارند. این در حالی است که برعکس روش تحریک الکتریکی مغز با جریان مستقیم که توانسته است در بلندمدت نیز خوب عمل کند، توانبخشی شناختی کوتاهمدت در دوره پیگیری عملکرد خوبی نداشته است. درمورد مؤلفه نامگذاری، تنها روش تحریک الکتریکی مغز با جریان مستقیم در زمان پسآزمون تأثیر معنیداری داشته است.
باتوجهبه نتایج گزارششده در جدول شماره 7، در گروه درمان بین مراحل پیشآزمون با پسآزمون در نمرات نوشتن، تفاوت معناداری وجود دارد (0/01>p)؛ اما بین میانگین نمرات متغیرهای پژوهش، در پسآزمون با پیگیری تفاوتی مشاهده نشده است (0/01<P).

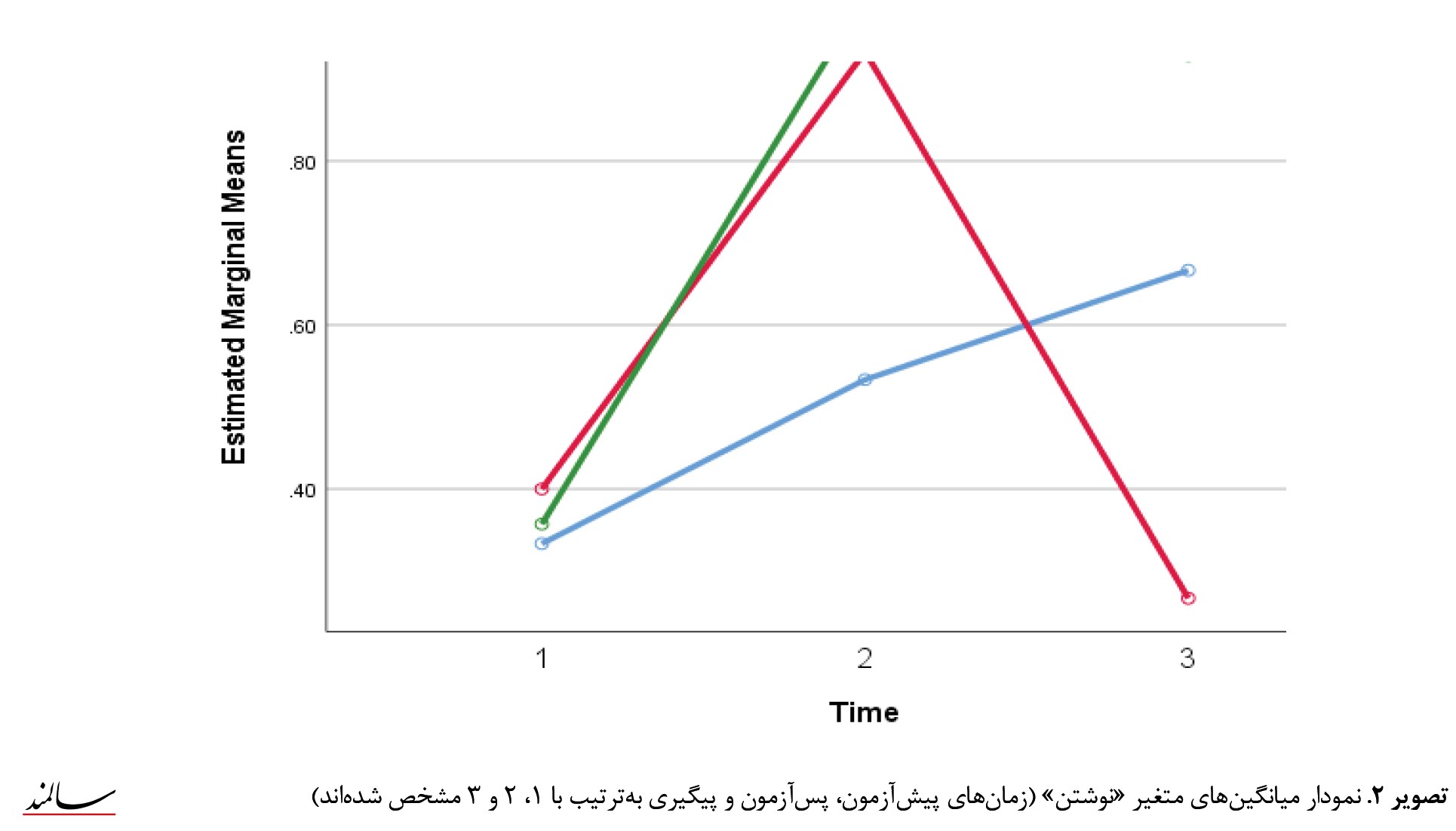
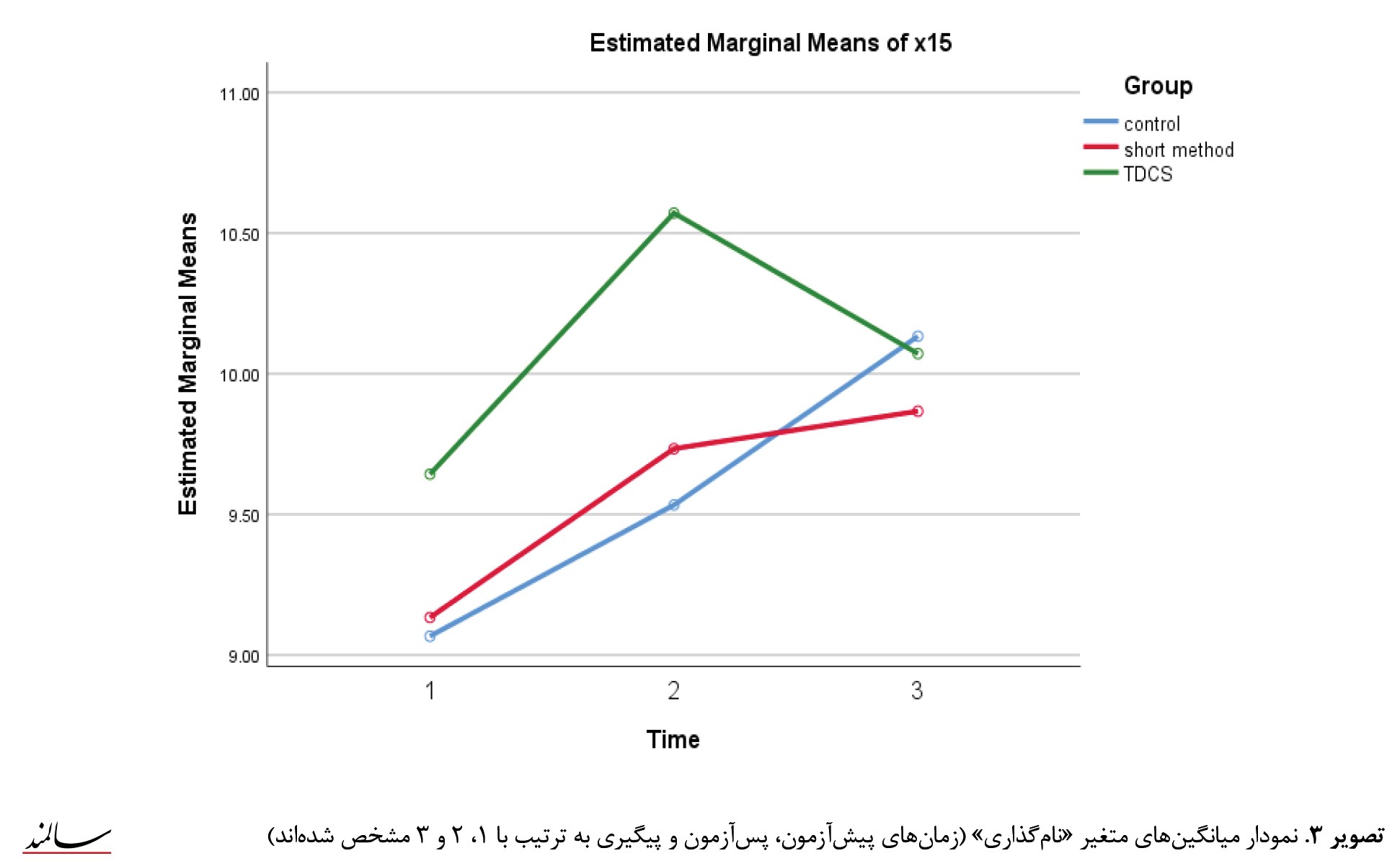
هر دو روش توانبخشی شناختی کوتاهمدت و تحریک الکتریکی مغز با جریان مستقیم بهطور معنیداری موجب بهبود مؤلفه نوشتن در پسآزمون شدهاند. بین مراحل پیشآزمون با پسآزمون در نمرات نوشتن، در هر دو گروه درمان تفاوت معناداری وجود دارد (0/01>p)؛ البته برعکس روش توانبخشی شناختی کوتاهمدت، روش تحریک الکتریکی مغز با جریان مستقیم توانسته است این بهبود را در دوره پیگیری حفظ کند. درمورد مؤلفه نامگذاری در گروه درمان بین مراحل پیشآزمون با پسآزمون در نمرات نام گذاری، تفاوت معناداری وجود دارد (0/01>p)؛ بین مراحل پیشآزمون با پسآزمون در نمرات نام گذاری، در هر دو گروه درمان تفاوت معناداری وجود دارد (0/01>p). همچنین بین مراحل پیشآزمون با پیگیری روش توانبخشی شناختی کوتاهمدت در نمرات نامگذاری، معنیدار بوده، اما بین میانگین نمرات متغیرهای پژوهش، در پسآزمون با پیگیری تفاوتی مشاهده نشده است (0/01<P). بنابراین میتوان گفت روش توانبخشی شناختی کوتاه مدت بهتر عمل کرده و نه تنها در پس آزمون موجب بهتر شدن معنیدار شده، بلکه در دوره پیگیری نیز این معنی داری را حفظ کرده است. این در حالی است که روش تحریک الکتریکی مغز با جریان مستقیم فقط در زمان پسآزمون تأثیر معنیداری داشته است. به منظور وضوح بیشتر نمودار میانگین های متغیر در 3 زمان به ترتیبتصویر شماره 2 و 3 نشان داده شده است.
1. n=2Cx[√ (SD12+SD22)/(M1– M2)]2
n=2x7/9[√(1.352+1.102)/(12.60–11.93)]2=2x7.9 x(2/58/10)=20.39=21
متغیرهای مستقل مداخله تحریک الکتریکی مغز با جریان مستقیم به مدت 10 جلسه 20 دقیقهای بهصورت هفتهای 1 بار روی یک گروه آزمایش اجرا شد. برنامه توانبخشی شناختی کوتاهمدت 9 جلسه (هر جلسه 90 دقیقه) به روش اسنادی و براساس رویکرد جایگزینی کارکرد سالم لوریا [35] مطابق جدول شماره 1 طراحی شد و پس از تأیید روایی محتوا توسط متخصصین، بهصورت هفتهای 1 بار روی گروه آزمایش دوم اعمال شد و بر روی گروه سوم هیچ مداخلهای انجام نشد.

بعد از خاتمه مداخله، پسآزمون با فاصله 1 هفته بر روی گروههای آزمایش و گروه کنترل اجرا شد. بعد از 1 ماه مجدداً گروههای موردمطالعه پیگیری شدند. ملاکهای ورود به پژوهش نداشتن بیماری قلبی، نبود زخم و خراشیدگی در سر، تمایل آگاهانه برای شرکت در پژوهش، نداشتن بیماری مسری، نداشتن بیماری صعبالعلاج مثل سرطان، نداشتن بیماری صرع و ملاکهای خروج شامل وجود اختلال شخصیت، سابقه سوءمصرف یا وابستگی به مواد مخدر یا الکل، دریافت خدمات روانشناسی دیگر در سایر مراکز در حال انجام پژوهش بود. جهت رعایت اخلاق پژوهش در ابتدا هدف پژوهش و اصل محرمانه بودن توضیح داده شد و پس از جلب رضایت آگاهانه، افراد داوطلب وارد پژوهش شدند. همچنین بعد از پایان پژوهش بهمنظور رعایت اصول اخلاقی برای گروه کنترل نیز روشهای درمانی، روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت (باتوجهبه اینکه بین اثربخشی 2 روش تأثیر معناداری نبود، از هر دو روش استفاده شد) اعمال شد. جهت جمعآوری اطلاعات از پرسشنامه زیر استفاده شد:
آزمون شناختی آدن بروک نسخه تجدیدنظرشده: آزمون شناختی آدن بروک برای تشخیص دمانس در مراحل اولیه ابتلا توسط ماتورانات و همکاران (2000) ساخته شده است که قادر به تشخیص افتراقی بین انواع دمانس، مانند بیماری آلزایمر، دمانس پیشانیگیجگاهی، فلج پیشرونده هسته فوقانی و دیگر سندرمهای پارکینسونی است و در تشخیص اختلالات شناختی در بیماران آسیبدیده مغزی کمککننده است [36]. پس از آن فرمهای تجدیدنظرشدهای از این آزمایش برای تشخیصهای بالینی مورد استفاده قرار گرفت [37، 38]. این آزمایش دارای 5 خردهآزمون است که هریک از خردهآزمونها یک عملکرد شناختی را مورد ارزیابی قرار میدهند. حداکثر نمره در این آزمون 100 نمره است که به ترتیب به موارد زیر اختصاص مییابد: توجه / جهتیابی (18 نمره)، حافظه (26 نمره)، روان و سلیس بودن (14 نمره)، زبان (26 نمره) و توانایی دیداری فضایی (16 نمره). نسخه فارسی پرسشنامه آدن بروک در سال 2009 براساس فرهنگ ایرانی هنجاریابی شد. ضریب آلفای کرونباخ کل آزمودنیها 0/84، برای گروه هنجار 0/97، برای گروه اختلال شناختی خفیف 0/88 و برای گروه آلزایمر خفیف برابر 0/93 به دست آمد که نشاندهنده پایایی بالای این آزمون محسوب میشود [39]. پروتکل توانبخشی در جدول شماره 1 ارائه شده است.
تحلیل آماری
در بخش تجزیهوتحلیل توصیفی شاخصهایی نظیر فراوانی، میانگین و انحراف استاندارد نمرات و در بخش استنباطی جهت تحلیل دادهها از آزمون تحلیل واریانس اندازهگیری مکرر در نرمافزار SPSS نسخه 23 استفاده شد. برای همه متغیرها سطح معناداری 0/05 مدنظر بود.
یافتهها
اطلاعات جمعیتشناختی مربوط به شرکتکنندگان در پژوهش از قبیل، سن، جنس، وضعیت اقتصادی و وضعیت تأهل به تفکیک گروهها در جدول شماره 2 گزارش شده است.

همچنین اطلاعات توصیفی (میانگین و انحرافمعیار) مربوط به متغیرهای توجه و جهتیابی و مؤلفههای مربوط به آنها به تفکیک 3 گروه کنترل، برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم در سه زمان مختلف پیشآزمون، پسآزمون و دوره پیگیری در جدول شماره 3 گزارش شده است.

برای بررسی تأثیرگذاری 2 روش موردمطالعه بر بهبود عملکرد شناختی از آزمون تحلیل واریانس اندازههای تکراری با 3 گروه کنترل، برنامه توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم و سه زمان مختلف پیشآزمون، پسآزمون و دوره پیگیری استفاده شد. جهت بررسی پیشفرضها از آزمون باکس، ویلکز و جهت بررسی نرمال بودن توزیع ماندهها از آزمون شاپیرو ویلک استفاده شد که در سطح معناداری 0/05 تأیید شد که این امر حاکی از برقراری پیششرط نرمال بودن توزیعها بود. همچنین فرضیه صفر برقراری کرویت براساس آزمون ماچولی بررسی شد، در حالتی که معنیداری این آزمون بزرگتر از 0/05 باشد، فرضیه صفر کرویت برقرار بوده و در نتیجه از آزمون با فرض برقراری کرویت استفاده میشود. در غیر این صورت، اگر کرویت برقرار نبود، برحسب اینکه شاخص اپسیلون بزرگتر از 0/75 باشد یا خیر، به ترتیب از تصحیح هاین فلدت یا تصحیح گرینهاوس جیسر استفاده میشود [40]. نتیجه آزمون ماچولی در جدول شماره 4 گزارش شده است.

باتوجهبه نتایج آزمون ماچولی فرضیه کرویت برای هر 3 مؤلفه جهتیابی، بهیادسپاری و توجه و تمرکز در سطح اطمینان 0/05 رد نشد و درنتیجه برابری میانگینها با فرض کرویت گزارش شدند. همچنین برای مؤلفههای متغیر، مهارتهای زبان برای همه مؤلفهها بهجز «تکرار» در سطح اطمینان 0/95 رد شد و درنتیجه برابری میانگینها فقط برای این متغیر با فرض کرویت گزارش شد. در 5 مؤلفه دیگر باتوجهبه بزرگ بودن مقدار اپسیلون از آزمون هاین فلدت استفاده شد. همچنین نتیجه آزمون برابری میانگینها برای متغیرهای توجه و مهارتهای زبانی در جدول شماره 5 گزارش شده است.

باتوجهبه جدول شماره 5 نتایج آزمون درمورد متغیر توجه نشان داد بهجز مؤلفه توجه و تمرکز تفاوت معنیداری بین 3 زمان موردآزمایش وجود داشت. مقدار اندازه اثر (اتا دو) برای 2 مؤلفه جهتیابی و بهیادسپاری به ترتیب برابر 0/288 و 0/200 به دست آمد. اندازه اثر هرچقدر به 1 نزدیکتر باشد میزان اختلاف بین زمانها بیشتر است. اگرچه میانگینهای 2 متغیر جهتیابی و بهیادسپاری با زمان تغییر کردهاند، ولی اثر متقابل بین زمان و گروههای آزمایش هیچکدام از 3 متغیر معنیدار نبود. این بدین معنی است که بین میانگینها هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. همچنین در خصوص متغیر مهارتهای زبان، نتایج آزمون نشان داد بهجز 2 مؤلفه نوشتن و نامگذاری تفاوت معنیداری بین 3 زمان موردآزمایش وجود نداشت. مقدار اندازه اثر (اتا دو) برای 2 مؤلفه نوشتن و نامگذاری به ترتیب برابر 0/291 و 0/306 به دست آمد. اثر متقابل بین زمان و گروههای آزمایش تنها برای 2 مؤلفه نوشتن و نامگذاری معنیدار بود. این بدین معنی است که بین میانگینهای 4 متغیر درک مطلب، تکرار، فهم مطلب و خواندن هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. برای بررسی اثرات متقابل بین زمان و گروه در 2 متغیر نوشتن و نامگذاری، برحسب همگن بودن یا نبودن واریانسها بین گروهها، به ترتیب از آزمون تعقیبی توکی یا آزمون تعقیبی دانت تی 3 برای مقایسه دوبهدوی میانگینها بین گروههای آزمایش به تفکیک 3 زمان استفاده شد. آزمون تعقیبی بونفرونی نیز برای مقایسه دوبهدوی میانگینها بین 3 زمان به تفکیک 3 گروه به کار رفت. نتایج این آزمونها به ترتیب در جدولهای شماره 6 و 7 گزارش شده است.

باتوجهبه نتایج گزارششده در جدول شماره 6 هر 2 روش پروتکل شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم تاثیر معنیدار مشابهی بر مقدار مؤلفه نوشتن در زمان پسآزمون دارند. این در حالی است که برعکس روش تحریک الکتریکی مغز با جریان مستقیم که توانسته است در بلندمدت نیز خوب عمل کند، توانبخشی شناختی کوتاهمدت در دوره پیگیری عملکرد خوبی نداشته است. درمورد مؤلفه نامگذاری، تنها روش تحریک الکتریکی مغز با جریان مستقیم در زمان پسآزمون تأثیر معنیداری داشته است.
باتوجهبه نتایج گزارششده در جدول شماره 7، در گروه درمان بین مراحل پیشآزمون با پسآزمون در نمرات نوشتن، تفاوت معناداری وجود دارد (0/01>p)؛ اما بین میانگین نمرات متغیرهای پژوهش، در پسآزمون با پیگیری تفاوتی مشاهده نشده است (0/01<P).

هر دو روش توانبخشی شناختی کوتاهمدت و تحریک الکتریکی مغز با جریان مستقیم بهطور معنیداری موجب بهبود مؤلفه نوشتن در پسآزمون شدهاند. بین مراحل پیشآزمون با پسآزمون در نمرات نوشتن، در هر دو گروه درمان تفاوت معناداری وجود دارد (0/01>p)؛ البته برعکس روش توانبخشی شناختی کوتاهمدت، روش تحریک الکتریکی مغز با جریان مستقیم توانسته است این بهبود را در دوره پیگیری حفظ کند. درمورد مؤلفه نامگذاری در گروه درمان بین مراحل پیشآزمون با پسآزمون در نمرات نام گذاری، تفاوت معناداری وجود دارد (0/01>p)؛ بین مراحل پیشآزمون با پسآزمون در نمرات نام گذاری، در هر دو گروه درمان تفاوت معناداری وجود دارد (0/01>p). همچنین بین مراحل پیشآزمون با پیگیری روش توانبخشی شناختی کوتاهمدت در نمرات نامگذاری، معنیدار بوده، اما بین میانگین نمرات متغیرهای پژوهش، در پسآزمون با پیگیری تفاوتی مشاهده نشده است (0/01<P). بنابراین میتوان گفت روش توانبخشی شناختی کوتاه مدت بهتر عمل کرده و نه تنها در پس آزمون موجب بهتر شدن معنیدار شده، بلکه در دوره پیگیری نیز این معنی داری را حفظ کرده است. این در حالی است که روش تحریک الکتریکی مغز با جریان مستقیم فقط در زمان پسآزمون تأثیر معنیداری داشته است. به منظور وضوح بیشتر نمودار میانگین های متغیر در 3 زمان به ترتیب
بحث
پژوهش حاضر با هدف مقایسه اثربخشی روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت بر مهارتهای زبانی و توجه در سالمندان مبتلا به آلزایمر خفیف انجام گرفت. نتیجه اول پژوهش نشان داد درمورد متغیر توجه بهجز مؤلفه توجه و تمرکز تفاوت معنیداری بین 3 زمان موردآزمایش (پیشآزمون پسآزمون و دوره پیگیری) وجود داشت. اگرچه میانگینهای 2 متغیر جهتیابی و بهیادسپاری با زمان تغییر کردهاند، ولی اثر متقابل بین زمان و گروههای آزمایش (کنترل، گروه توانبخشی شناختی کوتاهمدت و گروه تحریک الکتریکی مغز با جریان مستقیم) در هیچکدام از 3 متغیر معنیدار نبود. این بدین معنی است که بین میانگینها هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. به عبارت خیلی سادهتر، هیچیک از روشهای موردمطالعه روی شاخص توجه تأثیر معناداری نداشته و تنها عامل زمان موجب تغییر در شاخص توجه شده است. نتیجه حاضر با نتیجه پژوهش رضاپورجاغرق و همکاران [41] همسو و با نتایج پژوهشهای میرزائی و همکاران [29]، سیهجانی و همکارانم [42]، کورس و همکاران [30] و ایرازوکی و همکاران [31] ناهمسو است. در مطالعه حاضر روشهای مداخله هرچند تأثیر معناداری را نشان نمیدهد، اما انتظار میرود اگر مداخلات طولانیتر میشد، احتمال معنادار شدن تغییر نیز بیشتر میشد. به نظر میرسد علت ناهمسویی نتیجه پژوهش حاضر با نتایج پیشین نیز همین امر باشد، از سوی دیگر پژوهشهای پیشین به بررسی مجموعه گستردهای از عملکردهای شناختی پرداخته و اثربخشی روش درمانی را بر مجموعهای از عملکردهای شناختی گزارش کردهاند. درصورتیکه در پژوهش حاضر تنها به بررسی 2 مؤلفه پرداخته شده و احتمال اینکه بر سایر مؤلفهها تأثیر گذاشته باشد، وجود دارد. باتوجهبه نظریه لوریا [35] مناطق سالم مغز در زمانی که ناحیه مجاور یا مشابه آن در یک نیمکره یا نیمکره دیگر آسیب ببینند، به انجام وظایف نقاط آسیبدیده خواهند پرداخت و شواهد تجربی و مطالعات تصویربرداری مغزی نیز از این نظریه حمایت کردهاند [43]. بنابراین امکان دارد روشهای مداخله موجب بهبود سایر عملکردهای شناختی فرد شود در درازمدت توجه فرد نیز بهبود یابد. همچنین در تبیین عدم اثربخشی درمان تحریک الکتریکی مغز با جریان مستقیم و ناهمسویی نتیجه پژوهش حاضر با برخی پژوهشهای سابق میتوان چنین گفت که تفاوتها ممکن است به دلیل تغییرات پارامترهای خاص مطالعه از جمله این موارد باشد: مدت تحریک، محل قرارگیری الکترود، نوع بیمار و آسیبشناختی، تعداد جلسات، شدت جریان، زمانبندی تحریک و عدم تأیید اثر طولانیمدت [44].
همچنین نتیجه دیگر پژوهش نشان داد بهجز 2 مؤلفه نوشتن و نامگذاری تفاوت معنیداری بین 3 زمان موردآزمایش (پیشآزمون، پسآزمون و دوره پیگیری) وجود نداشت. این بدین معنی است که بین میانگینهای 4 مؤلفه درک مطلب، تکرار، فهم مطلب و خواندن هم در داخل گروهها در 3 زمان مختلف و هم در هریک از زمانها بین 3 گروه مختلف تفاوت معنیداری وجود ندارد. به عبارت خیلی سادهتر، هیچ یک از روشهای موردمطالعه روی 4 مؤلفه درک مطلب، تکرار، فهم مطلب و خواندن تأثیر نداشته است. همچنین هر دو روش توانبخشی شناختی کوتاهمدت و روش تحریک الکتریکی مغز با جریان مستقیم تأثیر معنیدار مشابهی بر مقدار نوشتن در زمان پسآزمون دارند. این در حالی است که برعکس روش تحریک الکتریکی مغز با جریان مستقیم که توانسته است در بلندمدت نیز خوب عمل کند، روش توانبخشی شناختی کوتاهمدت در دوره پیگیری عملکرد خوبی نداشته است. درمورد متغیر نامگذاری، تنها روش تحریک الکتریکی مغز با جریان مستقیم در زمان پسآزمون تأثیر معنیداری داشته است. همچنین هر دو روش توانبخشی شناختی کوتاهمدت و تحریک الکتریکی مغز با جریان مستقیم بهطور معنیداری موجب بهبود مؤلفه نوشتن در پسآزمون شدهاند. البته برعکس روش توانبخشی شناختی کوتاهمدت، روش تحریک الکتریکی مغز با جریان مستقیم توانسته است این بهبود را در دوره پیگیری حفظ کند. درمورد متغیر نامگذاری باید گفت روش توانبخشی شناختی کوتاهمدت بهتر عمل کرده و نهتنها در پسآزمون موجب بهبود عملکرد شده، بلکه در دوره پیگیری نیز این معنیداری را حفظ کرده است. این در حالی است که روش تحریک الکتریکی مغز با جریان مستقیم فقط در زمان پسآزمون تأثیر معنیداری داشته است. نتیجه پژوهش حاضر با نتایج فرنگی و همکاران [45] و پانچولی و ویجای [23] همسو است.
در تبیین اثر تحریک الکتریکی فراجمجمهای مغز در ناحیه پیشپیشانی بر عملکرد شناختی باید گفت باتوجهبه اهمیت و نقش ناحیه پیشپیشانی بر اعمال شناختی به نظر میرسد تحریک این منطقه، ظرفیت بسیاری در بالا بردن عملکردهای شناختی داشته باشد؛ یعنی ممکن است تحریک قشر پیشپیشانی باعث افزایش کارکردهای شناختی و تحریکپذیری کورتکسی در شبکههای مربوط به کارکردهای شناختی شود؛ زیرا این ناحیه با کارکردها و واکنشهای شناختی درگیر است که خود موجب بهبود عملکرد شناختی در سالمندان مبتلا به آلزایمر میشود [46]. درعینحال ممکن است شبکههای کورتکسی که در انواع دیگر تکالیف شناختی درگیر هستند نیز به سبب جریان ثابت الکتریکی ناحیه پیشپیشانی و غلظت یونی، موجب تحریک شدن مناطق دیگر شود. از طرفی، مکانیسمهای آنژیوژنیک (تحریک رگزایی در بافتها و اندامهای کمخون مغز) ممکن است زمینهساز پیشرفتهای شناختی ناشی از تحریک فراجمجمهای مغز در سالمندان مبتلا به آلزایمر باشد. مورد دیگر که میتوان به آن اشاره کرد، نقش تحریک الکتریکی در افزایش رهاسازی دوپامین در قشر پیشپیشانی است که در بهبود حافظه مؤثر است و میتواند منجر به پایداری فعالیت نورونی در این ناحیه و فرایندهای حافظه کاری شود [47].
همچنین در تبیین اثربخشی روش توانبخشی شناختی کوتاهمدت میتوان گفت به رغم وجود برخی مفروضات مبنی بر ناتوانی یادگیری جدید بین بیماران مبتلا به آلزایمر، نتایج حاضر نشان میدهد یادگیری در بیماران آلزایمری امکانپذیر است؛ اگرچه میزان یادگیری ممکن است وابسته به نوع و شدت بیماری باشد. بهطور کل نتیجه حاضر نشاندهنده قابلیت یادگیری بیماران آلزایمری نوع خفیف است و از این منطق حمایت میکند که تمرین و تکرار بهصورت منظم یا نامنظم، موجب یادگیری است؛ حتی در کسانی که به نظر فاقد توانایی در یادگیری هستند. براساس یافته موجود، لزوم توانبخشی شناختی بیماران آلزایمری بیشازپیش، برجسته شده و متخصصان را به ضرورت آن رهنمون میشود [48].
نتیجهگیری نهایی
نتایج مطالعه نشان داد هر دو روش موردمطالعه روش تحریک الکتریکی مغز با جریان مستقیم و پروتکل توانبخشی شناختی کوتاهمدت موجب بهبود مؤلفههای نوشتن و نامگذاری متغیرهای مهارتهای زبانی میشوند. از محدودیتهای پژوهش حاضر میتوان به استفاده از روش نمونهگیری در دسترس اشاره کرد، بنابراین پیشنهاد میشود در پژوهشهای آتی بهمنظور افزایش دقت از روشهای نمونهگیری تصادفی استفاده شود. همچنین پیشنهاد میشود اثربخشی روش ترکیبی روش تحریک الکتریکی فراجمجمهای و روش توانبخشی شناختی کوتاهمدت نیز مورد آزمایش قرار گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه برگرفته از رساله دکتری آرزو مجرد با کد اخلاق IR.UMA.REC.1401.008 است. شرکتکنندگان قبل از ورود به مطالعه یک رضایتنامه کتبی آگاهانه را تکمیل کردند. نحوه و هدف از پژوهش برای شرکتکنندگان بهطور کامل توضیح داده شد.
حامی مالی
این مقاله حامی مالی نداشته است.
مشارکت نویسندگان
مفهومسازی: آرزو مجرد، اسماعیل صدری دمیرچی، روششناسی: علی شیخالاسلامی، علی رضایی شریف، آرزو مجرد، اعتبارسنجی: علی رضایی شریف، تحلیل: علی شیخالاسلامی، تحقیق و بررسی: آرزو مجرد، منبع: آرزو مجرد، وحید عباسی، نگارش پیشنویس: آرزو مجرد، ویراستاری و نهاییسازی: اسماعیل صدری دمیرچی، بصریسازی: وحید عباسی، نظارت: اسماعیل صدری دمیرچی، وحید عباسی، مدیریت پروژه: اسماعیل صدری دمیرچی.
تعارض منافع
بنابراظهار نویسندگان این مقاله تعارض منافع ندارد.
References
1.Alzheimr’e Disease International. World Alzheimer Report: Attitudes to dementia. London: Alzheimr’e Disease International; 2019. [Link]
2.Sosa-Ortiz AL, Acosta-Castillo I, Prince MJ. Epidemiology of dementias and Alzheimer’s disease. Archives of Medical Research. 2012; 43(8):600-8. [DOI:10.1016/j.arcmed.2012.11.003] [PMID]
3.Jafarjalal E, Haghani H, Carpenter B, Sajady M, Farahaninia M. Knowledge about Alzheimer’s disease among individuals going to neighborhood houses in northern regions of Tehran, Iran. Arvand Journal of Health & Medical Sciences. 2017; 2(2):59-69. [Link]
4.Association AS. Alzheimer’s disease facts and figures. Alzheimer’s & Dementia. 2017; 13(4):325-73. [DOI:10.1016/j.jalz.2017.02.001]
5.Falcão DV, Teodoro ML, Bucher-Maluschke JS. Family cohesion: A study on caregiving daughters of parents with Alzheimer’s disease. Interpersona: An International Journal on Personal Relationships. 2016; 10:61-74. [DOI:10.5964/ijpr.v10isupp1.244]
6.Fisher GG, Chacon M, Chaffee DS. Theories of cognitive aging and work. In: Baltes BB, Rudolph CW, Zacher H, editors. Work across the lifespan. Massachusetts: Academic Press; 2019. [DOI:10.1016/B978-0-12-812756-8.00002-5]
7.Qavamifar A, Hassanpour H. [Identifying functions affecting the cognitive performance of strategic managers (Persian)]. Journal of Human Resource Studies. 2021; 11(2):50-70. [Link]
8.Penner IK, Kappos L. Retraining attention in MS. Journal of The Neurological Sciences. 2006; 245(1-2):147-51. [DOI:10.1016/j.jns.2005.07.015] [PMID]
9.Seidman LJ, Biederman J, Monuteaux MC, Doyle AE, Faraone SV. Learning disabilities and executive dysfunction in boys with attention-deficit/hyperactivity disorder. Neuropsychology. 2001; 15(4):544-56. [DOI:10.1037/0894-4105.15.4.544] [PMID]
10.Nezakat-Alhosseini M. [The effect of mild dehydration on selective and sustained attention (Persian)]. Sport Psychology Studies. 2017; 6(19):1-17. [DOI:10.22089/spsyj.2017.2309.1246]
11.Faizi A. [The effectiveness of the combination of computerized cognitive rehabilitation and motor skill training on working memory, sustained attention and planning ability in the elderly (Persian)][MA thesis). Unpublished. Semnan: Semnan University; 2018.
12.Anushko AE. Multi-domain predictors of trajectories of language development in early childhood [PhD dissertation]. New York: University of Fordham ; 2008. [Link]
13.Steinmetz JN. Cognitional arguments the immateriality of mind[ PhD dissertation]. Washington: Catholic University of America; 2008. [Link]
14.Schirmer CR, Fontoura DR, Nunes ML. Distúrbios da aquisição da linguagem e da aprendizagem. Jornal de Pediatria. 2004; 80:95-103. [DOI:10.1590/S0021-75572004000300012]
15.Flöel A, Suttorp W, Kohl O, Kürten J, Lohmann H, Breitenstein C, et al. Non-invasive brain stimulation improves object-location learning in the elderly. Neurobiology of Aging. 2012; 33(8):1682-9. [DOI:10.1016/j.neurobiolaging.2011.05.007] [PMID]
16.Kuo MF, Paulus W, Nitsche MA. Therapeutic effects of non-invasive brain stimulation with direct currents (tDCS) in neuropsychiatric diseases. Neuroimage. 2014, 85 Pt 3:948-60. [DOI:10.1016/j.neuroimage.2013.05.117] [PMID]
17.Nitsche MA, Liebetanz D, Antal A, Lang N, Tergau F, Paulus W. Modulation of cortical excitability by weak direct current stimulation-technical, safety and functional aspects. Supplements to Clinical Neurophysiology. 2003, 56:255-76. [DOI:10.1016/S1567-424X(09)70230-2] [PMID]
18.Nitsche MA, Paulus W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 2001, 57(10):1899-901. [DOI:10.1212/WNL.57.10.1899] [PMID]
19.Reti IM, Chang AD. Introduction to brain stimulation. In: Reti IM, editor. Brain stimulation: Methodologies and interventions. New Jersey: Wiley-Blackwell; 2015. [DOI:10.1002/9781118568323.ch1]
20.Akbari F. [The effectiveness of transcranial Direct Current Stimulation of the brain (tDCS) on reducing depressive symptoms among people with Depressive Disorder (Persian)]. International Journal of Behavioral Sciences. 2015; 9(1):95-101. [Link]
21.Lai HY. Application of Transcranial Direct Current Stimulation (tDCS) to enhance attention, visuo-motor coordination and executive function in older adults with mild cognitive impairment. Alzheimer's & Dementia. 2020; 16(6):e036427. [DOI:10.1002/alz.036427]
22.Wang CS, Cheng KS, Tang CH, Hou NT, Chien PF, Huang YC. 314-Effects of Transcranial Direct Current Stimulation (tDCS) on cognitive function in Alzheimer’s Dementia. International Psychogeriatrics. 2020; 32(S1):72. [DOI:10.1017/S1041610220002148]
23.Pancholi U, Vijay D. Quantification of electric field strength of tDCS in alzheimer’s and mild cognitive impairment patients. International Journal of Advanced Technology and Engineering Exploration. 2021; 8(82):1168-82. [DOI:10.19101/IJATEE.2021.874444]
24.Inagawa T, Yokoi Y, Yamada Y, Miyagawa N, Otsuka T, Yasuma N, et al. Effects of multisession transcranial direct current stimulation as an augmentation to cognitive tasks in patients with neurocognitive disorders in Japan: A study protocol for a randomised controlled trial. BMJ Open. 2020, 10(12):e037654. [DOI:10.1136/bmjopen-2020-037654] [PMID] [PMCID]
25.Cruz Gonzalez P, Fong KNK, Chung RCK, Ting KH, Law LLF, Brown T. Can transcranial direct-current stimulation alone or combined with cognitive training be used as a clinical intervention to improve cognitive functioning in persons with mild cognitive impairment and dementia? A systematic review and meta-analysis. Frontiers in Human Neuroscience. 2018; 12:416. [DOI:10.3389/fnhum.2018.00416] [PMID] [PMCID]
26.Dedoncker J, Brunoni AR, Baeken C, Vanderhasselt MA. A systematic review and meta-analysis of the effects of transcranial direct current stimulation (tDCS) over the dorsolateral prefrontal cortex in healthy and neuropsychiatric samples: Influence of stimulation parameters. Brain Stimulation. 2016; 9(4):501-17. [DOI:10.1016/j.brs.2016.04.006] [PMID]
27.Bergo E, Lombardi G, Pambuku A, Della Puppa A, Bellu L, D'Avella D, et al. Cognitive rehabilitation in patients with gliomas and other brain tumors: State of the art. BioMed Research International. 2016; 2016:3041824. [DOI:10.1155/2016/3041824] [PMID] [PMCID]
28.Mattioli F, Stampatori C, Scarpazza C, Parrinello G, Capra R. Persistence of the effects of attention and executive functions intensive rehabilitation in relapsing remitting multiple sclerosis. Multiple Sclerosis and Related Disorders. 2012, 1(4):168-73. [DOI:10.1016/j.msard.2012.06.004] [PMID]
29.Mirzaei M, Hasani Abharian P, Meschi F, Sabet M. [Effectiveness of combination therapy of computerized cognitive rehabilitation and transcranial direct current stimulation on the cognitive function in elderlies (Persian)]. EBNESINA. 2020; 22(4):47-59. [DOI:10.22034/22.4.47]
30.Kurth S, Wojtasik V, Lekeu F, Quittre A, Olivier C, Godichard V, et al. Efficacy of cognitive rehabilitation versus usual treatment at home in patients with early stages of alzheimer disease. Journal of Geriatric Psychiatry and Neurology. 2021; 34(3):209-15. [DOI:10.1177/0891988720924721] [PMID]
31.Irazoki E, Contreras-Somoza LM, Toribio-Guzmán JM, Jenaro-Río C, van der Roest H, Franco-Martín MA. Technologies for cognitive training and cognitive rehabilitation for people with mild cognitive impairment and dementia. A systematic review. Frontiers in Psychology. 2020; 11:648. [DOI:10.3389/fpsyg.2020.00648] [PMID] [PMCID]
32.Huntley JD, Hampshire A, Bor D, Owen A, Howard RJ. Adaptive working memory strategy training in early Alzheimer’s disease: Randomised controlled trial. The British Journal of Psychiatry. 2017; 210(1):61-6. [DOI:10.1192/bjp.bp.116.182048] [PMID] [PMCID]
33.Lambert MA, Bickel H, Prince M, Fratiglioni L, Von Strauss E, Frydecka D, et al. Estimating the burden of early onset dementia; systematic review of disease prevalence. European Journal of Neurology. 2014; 21(4):563-9. [DOI:10.1111/ene.12325] [PMID]
34.Abdollahimohammad A, Firouzkouhi M. [Sample size estimation in randomized clinical trials (RCTs) (Persian)]. Journal of Diabetes Nursing. 2019; 7 (1):737-9. [Link]
35.Luria AR. Restoration of function after brain injury. New York: Macmillan; 1963. [Link]
36.Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology. 2000; 55(11):1613-20. [DOI:10.1212/01.wnl.0000434309.85312.19] [PMID]
37.Mioshi E, Dawson K, Mitchell J, Arnold R, Hodges JR. The Addenbrooke’s Cognitive Examination Revised (ACE‐R): A brief cognitive test battery for dementia screening. International Journal of Geriatric Psychiatry. 2006; 21(11):1078-85. [DOI:10.1002/gps.1610] [PMID]
38.Hsieh S, Schubert S, Hoon C, Mioshi E, Hodges JR. Validation of the addenbrooke’s cognitive examination III in frontotemporal dementia and Alzheimer’s disease. Dementia and Geriatric Cognitive Disorders. 2013; 36(3-4):242-50. [DOI:10.1159/000351671] [PMID]
39.Pouretemad HR, Khatibi A, Ganjavi A, Shams J, Zarei M. Validation of Addenbrooke’s cognitive examination (ACE) in a Persian-speaking population. Dementia and Geriatric Cognitive Disorders. 2009; 28(4):343-7. [DOI:10.1159/000252772] [PMID]
40.Abdi H. The greenhouse-geisser correction. Encyclopedia of Research Design. 2010; 1(1):544-8. [Link]
41.Rezapour Jaghargh M, Mandegari Najafabadi M, Kavousipour. S. [The effect of computer games on level of attention in children with attention deficit hyperactivity disorder (Persian)]. Journal of Research in Rehabilitation Sciences. 2014; 10(4):528-38. [Link]
42.Siahjani L, Zare H, Oraki M, Sharifolhoseyni M. [Compiling a cognitive rehabilitation program and its effects on cognitive functions and life satisfaction in the Iranian elderly with mild Alzheimer’s (Persian)]. Neuropsychology. 2021, 6(23):70-98. [DOI:10.30473/clpsy.2020.51920.1524]
43.Sohlberg MM, Mateer CA. Cognitive rehabilitation: An integrative neuropsychological approach. New York: Guilford Press; 2001. [Link]
44.Das N, Spence JS, Aslan S, Vanneste S, Mudar R, Rackley A, et al. Cognitive training and transcranial direct current stimulation in mild cognitive impairment: A randomized pilot trial. Frontiers in Neuroscience. 2019; 13:307. [DOI:10.3389/fnins.2019.00307] [PMID] [PMCID]
45.Fregni F, El-Hagrassy MM, Pacheco-Barrios K, Carvalho S, Leite J, Simis M, et al. Evidence-based guidelines and secondary meta-analysis for the use of transcranial direct current stimulation in neurological and psychiatric disorders. International Journal of Neuropsychopharmacology. 2021; 24(4):256-313. [DOI:10.1093/ijnp/pyaa051] [PMID] [PMCID]
46.Benussi A, Dell'Era V, Cosseddu M, Cantoni V, Cotelli MS, Cotelli M, et al. Transcranial stimulation in frontotemporal dementia: a randomized, double‐blind, sham‐controlled trial. Alzheimer’s & Dementia: Translational Research & Clinical Interventions. 2020; 6(1):e12033. [DOI:10.1002/trc2.12033] [PMID] [PMCID]
47.Pellicciari MC, Miniussi C. Transcranial direct current stimulation in neurodegenerative disorders. The Journal of ECT. 2018; 34(3):193-202. [DOI:10.1097/YCT.0000000000000539] [PMID]
48.Amini M, Dowlatshahi B, Dadkhah A, Lotfi M. [The effect of memory and attention rehabilitation to decrease of memory deficits in older adults with alzheimer disease (Persian)]. Salmand: Iranian Journal of Ageing. 2013; 8(3):53-62. [Link]
1.Alzheimr’e Disease International. World Alzheimer Report: Attitudes to dementia. London: Alzheimr’e Disease International; 2019. [Link]
2.Sosa-Ortiz AL, Acosta-Castillo I, Prince MJ. Epidemiology of dementias and Alzheimer’s disease. Archives of Medical Research. 2012; 43(8):600-8. [DOI:10.1016/j.arcmed.2012.11.003] [PMID]
3.Jafarjalal E, Haghani H, Carpenter B, Sajady M, Farahaninia M. Knowledge about Alzheimer’s disease among individuals going to neighborhood houses in northern regions of Tehran, Iran. Arvand Journal of Health & Medical Sciences. 2017; 2(2):59-69. [Link]
4.Association AS. Alzheimer’s disease facts and figures. Alzheimer’s & Dementia. 2017; 13(4):325-73. [DOI:10.1016/j.jalz.2017.02.001]
5.Falcão DV, Teodoro ML, Bucher-Maluschke JS. Family cohesion: A study on caregiving daughters of parents with Alzheimer’s disease. Interpersona: An International Journal on Personal Relationships. 2016; 10:61-74. [DOI:10.5964/ijpr.v10isupp1.244]
6.Fisher GG, Chacon M, Chaffee DS. Theories of cognitive aging and work. In: Baltes BB, Rudolph CW, Zacher H, editors. Work across the lifespan. Massachusetts: Academic Press; 2019. [DOI:10.1016/B978-0-12-812756-8.00002-5]
7.Qavamifar A, Hassanpour H. [Identifying functions affecting the cognitive performance of strategic managers (Persian)]. Journal of Human Resource Studies. 2021; 11(2):50-70. [Link]
8.Penner IK, Kappos L. Retraining attention in MS. Journal of The Neurological Sciences. 2006; 245(1-2):147-51. [DOI:10.1016/j.jns.2005.07.015] [PMID]
9.Seidman LJ, Biederman J, Monuteaux MC, Doyle AE, Faraone SV. Learning disabilities and executive dysfunction in boys with attention-deficit/hyperactivity disorder. Neuropsychology. 2001; 15(4):544-56. [DOI:10.1037/0894-4105.15.4.544] [PMID]
10.Nezakat-Alhosseini M. [The effect of mild dehydration on selective and sustained attention (Persian)]. Sport Psychology Studies. 2017; 6(19):1-17. [DOI:10.22089/spsyj.2017.2309.1246]
11.Faizi A. [The effectiveness of the combination of computerized cognitive rehabilitation and motor skill training on working memory, sustained attention and planning ability in the elderly (Persian)][MA thesis). Unpublished. Semnan: Semnan University; 2018.
12.Anushko AE. Multi-domain predictors of trajectories of language development in early childhood [PhD dissertation]. New York: University of Fordham ; 2008. [Link]
13.Steinmetz JN. Cognitional arguments the immateriality of mind[ PhD dissertation]. Washington: Catholic University of America; 2008. [Link]
14.Schirmer CR, Fontoura DR, Nunes ML. Distúrbios da aquisição da linguagem e da aprendizagem. Jornal de Pediatria. 2004; 80:95-103. [DOI:10.1590/S0021-75572004000300012]
15.Flöel A, Suttorp W, Kohl O, Kürten J, Lohmann H, Breitenstein C, et al. Non-invasive brain stimulation improves object-location learning in the elderly. Neurobiology of Aging. 2012; 33(8):1682-9. [DOI:10.1016/j.neurobiolaging.2011.05.007] [PMID]
16.Kuo MF, Paulus W, Nitsche MA. Therapeutic effects of non-invasive brain stimulation with direct currents (tDCS) in neuropsychiatric diseases. Neuroimage. 2014, 85 Pt 3:948-60. [DOI:10.1016/j.neuroimage.2013.05.117] [PMID]
17.Nitsche MA, Liebetanz D, Antal A, Lang N, Tergau F, Paulus W. Modulation of cortical excitability by weak direct current stimulation-technical, safety and functional aspects. Supplements to Clinical Neurophysiology. 2003, 56:255-76. [DOI:10.1016/S1567-424X(09)70230-2] [PMID]
18.Nitsche MA, Paulus W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 2001, 57(10):1899-901. [DOI:10.1212/WNL.57.10.1899] [PMID]
19.Reti IM, Chang AD. Introduction to brain stimulation. In: Reti IM, editor. Brain stimulation: Methodologies and interventions. New Jersey: Wiley-Blackwell; 2015. [DOI:10.1002/9781118568323.ch1]
20.Akbari F. [The effectiveness of transcranial Direct Current Stimulation of the brain (tDCS) on reducing depressive symptoms among people with Depressive Disorder (Persian)]. International Journal of Behavioral Sciences. 2015; 9(1):95-101. [Link]
21.Lai HY. Application of Transcranial Direct Current Stimulation (tDCS) to enhance attention, visuo-motor coordination and executive function in older adults with mild cognitive impairment. Alzheimer's & Dementia. 2020; 16(6):e036427. [DOI:10.1002/alz.036427]
22.Wang CS, Cheng KS, Tang CH, Hou NT, Chien PF, Huang YC. 314-Effects of Transcranial Direct Current Stimulation (tDCS) on cognitive function in Alzheimer’s Dementia. International Psychogeriatrics. 2020; 32(S1):72. [DOI:10.1017/S1041610220002148]
23.Pancholi U, Vijay D. Quantification of electric field strength of tDCS in alzheimer’s and mild cognitive impairment patients. International Journal of Advanced Technology and Engineering Exploration. 2021; 8(82):1168-82. [DOI:10.19101/IJATEE.2021.874444]
24.Inagawa T, Yokoi Y, Yamada Y, Miyagawa N, Otsuka T, Yasuma N, et al. Effects of multisession transcranial direct current stimulation as an augmentation to cognitive tasks in patients with neurocognitive disorders in Japan: A study protocol for a randomised controlled trial. BMJ Open. 2020, 10(12):e037654. [DOI:10.1136/bmjopen-2020-037654] [PMID] [PMCID]
25.Cruz Gonzalez P, Fong KNK, Chung RCK, Ting KH, Law LLF, Brown T. Can transcranial direct-current stimulation alone or combined with cognitive training be used as a clinical intervention to improve cognitive functioning in persons with mild cognitive impairment and dementia? A systematic review and meta-analysis. Frontiers in Human Neuroscience. 2018; 12:416. [DOI:10.3389/fnhum.2018.00416] [PMID] [PMCID]
26.Dedoncker J, Brunoni AR, Baeken C, Vanderhasselt MA. A systematic review and meta-analysis of the effects of transcranial direct current stimulation (tDCS) over the dorsolateral prefrontal cortex in healthy and neuropsychiatric samples: Influence of stimulation parameters. Brain Stimulation. 2016; 9(4):501-17. [DOI:10.1016/j.brs.2016.04.006] [PMID]
27.Bergo E, Lombardi G, Pambuku A, Della Puppa A, Bellu L, D'Avella D, et al. Cognitive rehabilitation in patients with gliomas and other brain tumors: State of the art. BioMed Research International. 2016; 2016:3041824. [DOI:10.1155/2016/3041824] [PMID] [PMCID]
28.Mattioli F, Stampatori C, Scarpazza C, Parrinello G, Capra R. Persistence of the effects of attention and executive functions intensive rehabilitation in relapsing remitting multiple sclerosis. Multiple Sclerosis and Related Disorders. 2012, 1(4):168-73. [DOI:10.1016/j.msard.2012.06.004] [PMID]
29.Mirzaei M, Hasani Abharian P, Meschi F, Sabet M. [Effectiveness of combination therapy of computerized cognitive rehabilitation and transcranial direct current stimulation on the cognitive function in elderlies (Persian)]. EBNESINA. 2020; 22(4):47-59. [DOI:10.22034/22.4.47]
30.Kurth S, Wojtasik V, Lekeu F, Quittre A, Olivier C, Godichard V, et al. Efficacy of cognitive rehabilitation versus usual treatment at home in patients with early stages of alzheimer disease. Journal of Geriatric Psychiatry and Neurology. 2021; 34(3):209-15. [DOI:10.1177/0891988720924721] [PMID]
31.Irazoki E, Contreras-Somoza LM, Toribio-Guzmán JM, Jenaro-Río C, van der Roest H, Franco-Martín MA. Technologies for cognitive training and cognitive rehabilitation for people with mild cognitive impairment and dementia. A systematic review. Frontiers in Psychology. 2020; 11:648. [DOI:10.3389/fpsyg.2020.00648] [PMID] [PMCID]
32.Huntley JD, Hampshire A, Bor D, Owen A, Howard RJ. Adaptive working memory strategy training in early Alzheimer’s disease: Randomised controlled trial. The British Journal of Psychiatry. 2017; 210(1):61-6. [DOI:10.1192/bjp.bp.116.182048] [PMID] [PMCID]
33.Lambert MA, Bickel H, Prince M, Fratiglioni L, Von Strauss E, Frydecka D, et al. Estimating the burden of early onset dementia; systematic review of disease prevalence. European Journal of Neurology. 2014; 21(4):563-9. [DOI:10.1111/ene.12325] [PMID]
34.Abdollahimohammad A, Firouzkouhi M. [Sample size estimation in randomized clinical trials (RCTs) (Persian)]. Journal of Diabetes Nursing. 2019; 7 (1):737-9. [Link]
35.Luria AR. Restoration of function after brain injury. New York: Macmillan; 1963. [Link]
36.Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology. 2000; 55(11):1613-20. [DOI:10.1212/01.wnl.0000434309.85312.19] [PMID]
37.Mioshi E, Dawson K, Mitchell J, Arnold R, Hodges JR. The Addenbrooke’s Cognitive Examination Revised (ACE‐R): A brief cognitive test battery for dementia screening. International Journal of Geriatric Psychiatry. 2006; 21(11):1078-85. [DOI:10.1002/gps.1610] [PMID]
38.Hsieh S, Schubert S, Hoon C, Mioshi E, Hodges JR. Validation of the addenbrooke’s cognitive examination III in frontotemporal dementia and Alzheimer’s disease. Dementia and Geriatric Cognitive Disorders. 2013; 36(3-4):242-50. [DOI:10.1159/000351671] [PMID]
39.Pouretemad HR, Khatibi A, Ganjavi A, Shams J, Zarei M. Validation of Addenbrooke’s cognitive examination (ACE) in a Persian-speaking population. Dementia and Geriatric Cognitive Disorders. 2009; 28(4):343-7. [DOI:10.1159/000252772] [PMID]
40.Abdi H. The greenhouse-geisser correction. Encyclopedia of Research Design. 2010; 1(1):544-8. [Link]
41.Rezapour Jaghargh M, Mandegari Najafabadi M, Kavousipour. S. [The effect of computer games on level of attention in children with attention deficit hyperactivity disorder (Persian)]. Journal of Research in Rehabilitation Sciences. 2014; 10(4):528-38. [Link]
42.Siahjani L, Zare H, Oraki M, Sharifolhoseyni M. [Compiling a cognitive rehabilitation program and its effects on cognitive functions and life satisfaction in the Iranian elderly with mild Alzheimer’s (Persian)]. Neuropsychology. 2021, 6(23):70-98. [DOI:10.30473/clpsy.2020.51920.1524]
43.Sohlberg MM, Mateer CA. Cognitive rehabilitation: An integrative neuropsychological approach. New York: Guilford Press; 2001. [Link]
44.Das N, Spence JS, Aslan S, Vanneste S, Mudar R, Rackley A, et al. Cognitive training and transcranial direct current stimulation in mild cognitive impairment: A randomized pilot trial. Frontiers in Neuroscience. 2019; 13:307. [DOI:10.3389/fnins.2019.00307] [PMID] [PMCID]
45.Fregni F, El-Hagrassy MM, Pacheco-Barrios K, Carvalho S, Leite J, Simis M, et al. Evidence-based guidelines and secondary meta-analysis for the use of transcranial direct current stimulation in neurological and psychiatric disorders. International Journal of Neuropsychopharmacology. 2021; 24(4):256-313. [DOI:10.1093/ijnp/pyaa051] [PMID] [PMCID]
46.Benussi A, Dell'Era V, Cosseddu M, Cantoni V, Cotelli MS, Cotelli M, et al. Transcranial stimulation in frontotemporal dementia: a randomized, double‐blind, sham‐controlled trial. Alzheimer’s & Dementia: Translational Research & Clinical Interventions. 2020; 6(1):e12033. [DOI:10.1002/trc2.12033] [PMID] [PMCID]
47.Pellicciari MC, Miniussi C. Transcranial direct current stimulation in neurodegenerative disorders. The Journal of ECT. 2018; 34(3):193-202. [DOI:10.1097/YCT.0000000000000539] [PMID]
48.Amini M, Dowlatshahi B, Dadkhah A, Lotfi M. [The effect of memory and attention rehabilitation to decrease of memory deficits in older adults with alzheimer disease (Persian)]. Salmand: Iranian Journal of Ageing. 2013; 8(3):53-62. [Link]
نوع مطالعه: كاربردي |
موضوع مقاله:
سالمند شناسی
دریافت: 1402/3/3 | پذیرش: 1402/9/27 | انتشار: 1403/7/10
دریافت: 1402/3/3 | پذیرش: 1402/9/27 | انتشار: 1403/7/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |