دوره 19، شماره 2 - ( تابستان 1403 )
جلد 19 شماره 2 صفحات 327-314 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Khademosharie M, Mollanovruzi A, Azarniveh M, Saeidi A. Effect of a Forward and Backward Training Program on Some Inflammatory Factors and Physical Function of Older Women. Salmand: Iranian Journal of Ageing 2024; 19 (2) :314-327
URL: http://salmandj.uswr.ac.ir/article-1-2615-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-2615-fa.html
خادم الشریعه میترا، ملانوروزی اعظم، آذرنیوه مرضیه السادات، سعیدی ایوب. اثر یک دوره تمرین راه رفتن به جلو و عقب بر برخی از عوامل التهابی و آمادگی جسمانی زنان سالمند. سالمند: مجله سالمندی ایران. 1403; 19 (2) :314-327
1- گروه تربیت بدنی و علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه کوثر بجنورد، بجنورد، ایران. ، m.khadem@kub.ac.ir
2- گروه تربیت بدنی و علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه کوثر بجنورد، بجنورد، ایران.
3- گروه تربیت بدنی و علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه زابل، زابل، ایران.
4- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم انسانی و اجتماعی، دانشگاه کردستان، سنندج، ایران.
2- گروه تربیت بدنی و علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه کوثر بجنورد، بجنورد، ایران.
3- گروه تربیت بدنی و علوم ورزشی، دانشکده ادبیات و علوم انسانی، دانشگاه زابل، زابل، ایران.
4- گروه تربیت بدنی و علوم ورزشی، دانشکده علوم انسانی و اجتماعی، دانشگاه کردستان، سنندج، ایران.
متن کامل [PDF 5696 kb]
(1516 دریافت)
| چکیده (HTML) (3280 مشاهده)
متن کامل: (1742 مشاهده)
مقدمه
دوره سالمندی با تغییرات مورفولوژیکی و فیزیولوژیکی شبیه به از دست دادن قدرت عضلانی، انعطافپذیری، تعادل و کاهش دیگر عملکردهای جسمانی بهویژه در زنان و همچنین تغییرات پیکرشناسی و ترکیب بدن مثل کاهش وزن، قد و چگالی مواد معدنی استخوان همراه است که اینها با شیوه زندگی کمتحرک تشدید میشود و باعث تغییر در کیفیت زندگی افراد و افزایش خطر افتادن بهخصوص در زنان خواهد شد [1].
امروزه با افزایش سن، سیستم ایمنی بدن باید برای مدت طولانیتری فعال باشد و این مدتزمان طولانی به آرامی به التهاب مزمن منجر میشود. این پدیده ویژهای است که مرتبط با سن و عامل خطر اصلی برای بیماریهای مزمن مرتبط با سن به شمار میرود، بهطوریکه علت بیماریهای آلزایمر، تصلب شرائین، دیابت و حتی سارکوپنیا و سرطان را بیشتر پدیده التهاب میدانند [2]. در بین مارکرهای متعدد التهاب مزمن، عامل نکروز تومور آلفا (TNF-α) به میزان بیشتری مورد توجه قرار گرفته است [3]. مشخص شده است سطوح بالای این سایتوکینها از عوامل قوی پیشبینی خطر مرگومیر در افراد میانسال و سالمند میباشد [4] و با عوامل خطر سایر بیماریها (دیابت، سرطان و ناتوانی) نیزارتباط دارند [5].
سیستم ایمنی نشانگر خوبی از سرعت رسیدن به سالمندی و سن بیولوژیکی هر فرد و در نتیجه طول عمر اوست. چنانکه ضعف سیستم ایمنی میتواند سرعت رسیدن به سالمندی را افزایش دهد و درنتیجه باعث کاهش طول عمر فرد شود. سلولهای لنفاوی، سلولهای التهابی و سلولهای خونساز در ایجاد یک پاسخ ایمنی موثر نقش دارند. سلولهای ایمنی ذاتی در طی مراحل نخستین و اجرایی پاسخهای ایمنی ذاتی و اکتسابی با دیگر سلولهای ایمنی ذاتی و نیز با سلولهای میزبان وارد تعامل میشوند. بسیاری از برهمکنشها بهواسطه پروتئینهایی ترشحی موسوم به سایتوکاینها صورت میگیرد [6]. ازجمله سایتوکاینهایی که به تغییر در سلولهای ایمنی منجر میشود TGF-β است. TGF-β نقشهای متنوعی در فرآیندهای سلولی دارد که شامل تکثیر، تمایز متابولیسم پروتئین و رشد و بازسازی و تغییر و تحول ماتریکس خارج سلولی میباشد. همچنین نقش مهمی در التهاب و عملکرد سیستم ایمنی دارد و تحت تأثیر سن قرار میگیرد [7].
از طرفی فرایند پیری با کاهش تراکم استخوان، افت ظرفیت کارکردی و افزایش خطر افتادن همراه است. ازآنجاکه زنان نسبت به مردان کمتر به اوج توده عضله و استخوان خود دست مییابند، آنها بیشتر مستعد اختلالات اسکلتی-عضلانی مرتبط با افزایش سن هستند. بنابراین شناخت مداخلاتی که احتمالاً با اختلالات اسکلتی-عضلانی مرتبط با سن مقابله میکند، ضروری به نظر میرسد [8، 9]. ویتامین D به شکل D2 (OH) 1/25یک هورمون استروسیدی است که عمدتاً بهواسطه نقش در هموستازکلسیم و متابولیسم استخوان شناخته میشود. بههرحال، شواهد رو به رشد نشان میدهد ویتامین D نقش مهمی در بسیاری از بافتهای بدن از جمله عضله اسکلتی دارد، بهطوریکه در سطح سلولهای عضله اسکلتی سطوح بالای گیرنده ویتامین D وجود دارد و تعداد این گیرندهها با افزایش سن کاهش مییابد [10]. روتئین متصل به ویتامین D(VDBP)، پروتئین پلاسمایی اصلی حامل ویتامین D و متابولیتهای آن میباشد که مسئول انتقال ویتامین D3 به کبد و 25 هیدروکسی ویتامین D به کلیه و 25 و 1 هیدروکسی ویتامین D به ارگانهای هدف میباشد [11].
فعالیت بدنی بهعنوان یک مداخله غیردارویی کم هزینه، میتواند وسیلهای برای جلوگیری از ضعف و مرگومیر در افراد مسن باشد [12، 13]. برنامههای ورزشی مختلفی برای افزایش آمادگی جسمانی و تعادل برای سالمندان استفاده شده است و بیشترین روشهای تمرینی برنامههای تمرین ترکیبی است که عمدتاً شامل تمرینات قدرت عضلانی، انعطافپذیری و برنامههای تعادلی میباشد و فقدان یک برنامه تمرینی ساده و تأثیرگذار برای افزایش آمادگی جسمانی در سالمندان احساس میشود [14].
تمرینات هوازی شبیه راه رفتن و دویدن در سالمندان، استقامت قلبیعروقی را در آنها بهبود میبخشد، راه رفتن چون نیروی ضربهای کمتری از دویدن ایجاد میکند، درنتیجه باعث فشار کمتر بر استخوان و مفاصل در اندام تحتانی میشود. راه رفتن کم هزینهترین و دردسترسترین نوع فعالیت بدنی است. راه رفتن علاوه بر اینکه برای تمام گروههای سنی مناسب است نیاز به زمان، مکان، هزینه و مهارت خاصی ندارد [15]. راه رفتن به عقب یک حرکت پویای برگرداننده با فواید مستند قلبیعروقی است [16] و باعث کنترل تعادل میشود [17]. درحالحاضر اغلب در برنامههای توانبخشی مختلف، راه رفتن به عقب بهویژه برای اختلالاتی که درآن راه رفتن به جلو باعث تشدید درد زانو میشود گنجانده شده است [18]. براساس گزارشهای پژوهشی، سبک زندگی فعالانه با کاهش سطح سایتوکینهای التهابی و بهبود وضعیت جسمانی و عملکرد سیستم ایمنی در افراد مسن همراه است [19].
مطالعات زیادی بر اثرات ورزش در افراد مسن انجام شده است، اما هنوز هیچ توافقی در نوع برنامه، شدت و مدت آن بهعنوان مؤثرترین روش در بهبود کیفیت زندگی و رفاه آنان و کاهش عوامل التهابی وجود ندارد [20]. به نظر میرسد راه رفتن به عقب برخلاف راه رفتن به جلو موجب درگیری بیشتر سیستم عصبی میشود و مغز را بیشتر درگیر میکند و بر عملکرد شناختی اثر بیشتری دارد. عوامل التهابی از طریق مسیرهای مختلفی میتوانند از سد خـونی-مغـزی عبـور کنند و باعـث کـاهش نـوروژنز و اختلال در حافظه و یادگیری شوند [21، 22]. ازطرفی تحقیقات نشان دادهاند ورزش سبب کاهش ســطوح سایتوکینهای پیشالتهابی [22] و تنظیم عملکرد سیستم ایمنی، به دنبال بیان TGF-β [23] و بهبود سطوح ویتامین D و VDBP [24] میشـود. ازآنجاکه برنامه تمرین راه رفتن به عقب بهعنوان یک روش پیشگیری و درمان عوارض سالمندی کمتر مورد توجه قرار گرفته است، هدف از این تحقیق پاسخ به این سؤال است که آیا بین راه رفتن به جلو و راه رفتن به عقب و آمادگی جسمانی زنان سالمند و فاکتورهای التهابی و ایمنی مرتبط با عملکرد مغز رابطهای وجود دارد؟
روش مطالعه
جامعه و نمونه آماری
تحقیق بهصورت نیمهآزمایشی با طرح پیشآزمون و پسآزمون در دو گروه آزمایش و کنترل انجام شد. تعداد 30 نفر از افرادی انتخاب شدندکه دارای چنین شرایطی بودند: سلامت عمومی و قلبیعروقی، توانایی حضور در جلسات تمرینی، پذیرش انجام تستهای موردنیاز، عدم مصرف دارو و عدم ابتلا به بیماریهای خاص و بیماریهای شدید ارتوپدی. از تمام افراد شرکتکننده در تحقیق، معاینه پزشکی (سلامت عمومی، سلامت قلبیعروقی و فشارخون) گرفته شد. تمام آزمودنیها فرم رضایتنامه کتبی مبنی بر شرکت در پژوهش را تکمیل کردند. جامعه آماری تحقیق حاضر شامل زنان سالمند یائسه بین 60 تا 75 سال بود که بهصورت روزانه فعالیت بدنی داشتند. 30 نفر بهطور تصادفی انتخاب شدند که 6 نفر از آنها از ادامه شرکت در تحقیق انصراف دادند و 24 نفر باقیمانده بهطور تصادفی در یکی از 3 گروه: تمرینات راه رفتن به جلو (8 نفر)، تمرینات راه رفتن به عقب (9 نفر) و کنترل (7 نفر) قرار گرفتند. برنامه تمرینی بهمدت 8 هفته انجام شد. 1 هفته قبل از شروع آزمون، 1 جلسه آشنایی با برنامه تمرینی برای آزمودنیها گذاشته شد.
روش اجرای پژوهش
پیشآزمون
قبل از شروع تمرینات ورزشی از آزمودنیها اندازهگیریهای پیکرسنجی شامل سن، قد، وزن و نمایه توده بدن و همچنین پیشآزمونهای قدرت عضلانی (30 ثانیه نشستن و ایستادن)، استقامت عضلانی (2 دقیقه گام برداشتن) و نمونهگیری خونی (جهت تجزیهوتحلیل بیوشیمایی) به عمل آمد. سپس آزمودنیها بهطور تصادفی در 3 گروه راه رفتن به جلو، راه رفتن به عقب و کنترل قرار گرفتند. در روز خونگیری، آزمودنیها در آزمایشگاه حاضر شدند، از آزمودنیها در حالت ناشتا مقدار 5 سیسی خون از ورید بازویی گرفته شد. 2 سی سی از خون تازه جهت اندازهگیری CBC به آزمایشگاه فرستاده شد. 3 سی سی باقیمانده سانتریفیوژ شد و در 3 الیکوت برای انجام آزمایشات بیوشیمیایی (اندازهگیری TGF-β ،TNF-α و VDBP) در یخچال 80- درجه نگهداری شد.
مقدار TGF-β ،TNF-α و VDBP سرم به روش الایزا و بهترتیب مطابق با دستورالعمل کشور سازنده ( فاکتور رشد تبدیلکننده انسانی بتا (TGF-β1)، کیت الایزا، تورنس، ایالات متحده آمریکا) (فاکتور نکروز تومور α (TNF-α)، کیت الایزا، تورنس، ایالات متحده امریکا) (پروتئین متصل به ویتامین d،VDBP، کیت الایزا، تورنس، ایالات متحده امریکا) با درجه حساسیت (1/52 نانوگرم بر لیتر) TNF-α، TGF-β1 (5/11 نانوگرم بر لیتر) VDBP(5/41 میکروگرم بر میلیلیتر) اندازهگیری شد. پس از این مرحله، آزمودنیهای 2 گروه تمرینات ورزشی بهمدت 8 هفته، تمرینات خود را و گروه کنترل تنها فعالیتهای روزمره و عادی خود را انجام دادند.
پروتکل تمرینی
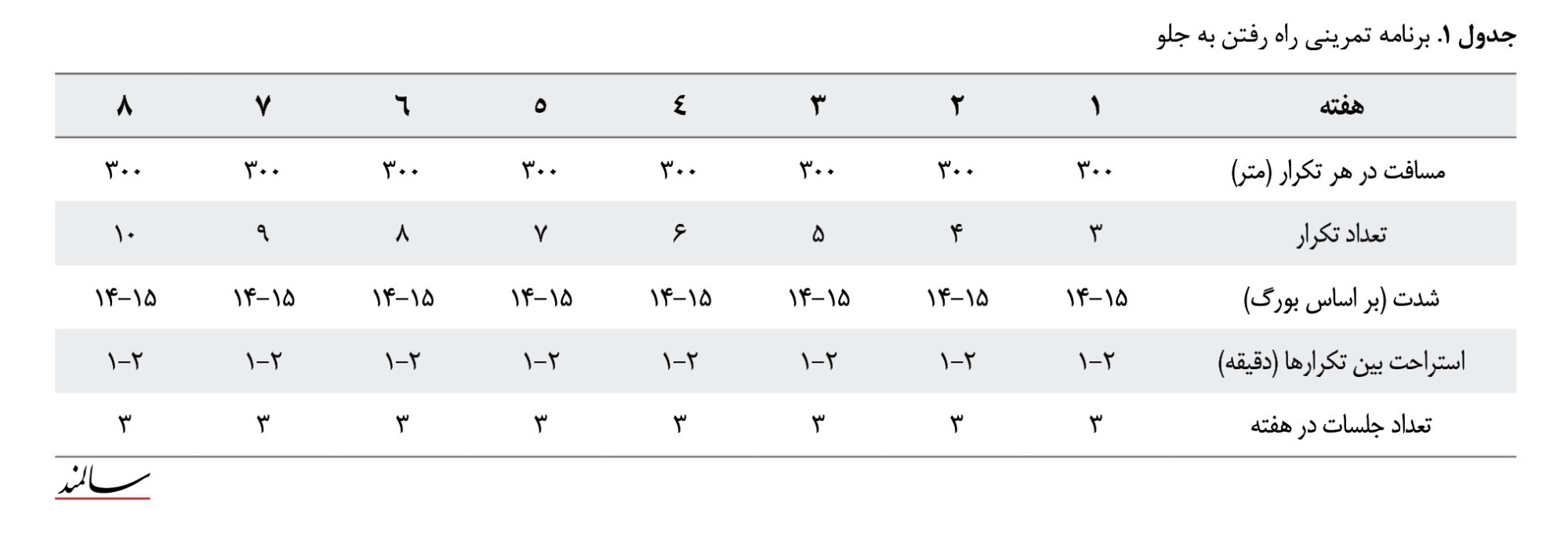
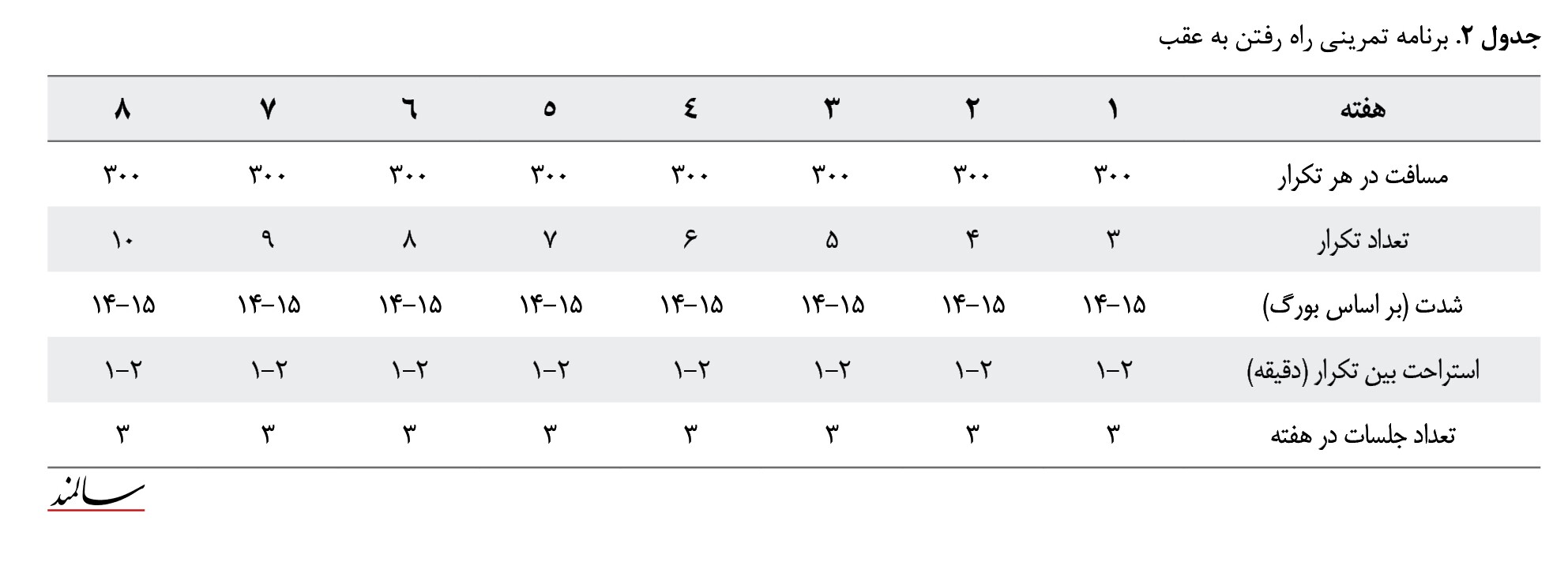
دو گروه راه رفتن به جلو و راه رفتن به عقب 3 جلسه در هفته و بهمدت 8 هفته به تمرین پرداختند. برنامه تمرین در هر جلسه شامل 10 دقیقه گرم کردن عمومی برنامه تمرین اصلی و 10 دقیقه سرد کردن بود. آزمودنیها به 3 گروه کنترل، تمرین راه رفتن به جلو و تمرین راه رفتن به عقب تقسیم شدند. در گروه کنترل افراد غیرفعال بودند، در گروه تمرین راه رفتن به جلو آزمودنیها در 3 تکرار مسافت 300 متر راه رفتن به جلو انجام دادند و در گروه تمرین راه رفتن به عقب نیز آزمودنیها در 3 تکرار مسافت 300 متر راه رفتن به عقب را انجام دادند (جداول شماره 1 و 2). از مقیاس بورگ برای ارزیابی میزان درک فشار و درد، در ابتدا و انتهای هر برنامه تمرینی هنگام اجرای آزمونها استفاده شد.
پسآزمون
پس از 8 هفته، آزمودنیها تحت شرایط قبل از تمرینات ورزشی، یعنی عدم فعالیت بدنی در 48 ساعت قبل از خونگیری در آزمایشگاه حضور پیدا کردند و مانند پیشآزمون، از تمام آزمودنیها نمونه خونی گرفته شد. همچنین از تمام آزمودنیهای 3 گروه اندازهگیری پیکرسنجی و آزمونهای قدرت عضلانی، استقامت عضلانی همانند پیشآزمون گرفته شد.
روش اندازهگیری متغیرها
مقیاس درک فشار بورگ Borg RPE Scale:
این مقیاس در ورزش و مخصوصاً در تستهای بدنی فشار درکشده را اندازه میگیرد. در پزشکی این مقیاس برای ثبت فشار اعمالشده توسط بیمار حین انجام تست به کار میرود و مربیان ورزشی از این مقیاس برای تعیین شدت تمرین و مسابقه استفاده میکنند. مقیاس اصلی گونار بورگ، فشار را روی مقیاسی بین 6-20 نمرهدهی میکند [25، 26]. در این تحقیق، ما شدتی بین 14-15 را در نظر گرفتیم که نسبتاً سنگین محسوب میشد.
اندازهگیری درصد چربی بدن:
اندازهگیری درصد چربی با استفاده از کالیپر انجام شد. با استفاده از انگشت شست و اشاره، چینی از پوست و چربی زیرپوستی را گرفته و برای جدا کردن از بافت عضلانی زیرین بالا کشیده میشد. دهانه کالیپر، فشاری معادل 10/3 گرم بر سانتیمتر در محل تماس با دو لایه پوست و بافت زیرپوستی اعمال میکرد. در این تحقیق 2-4 ثانیه پس از اعمال فشار کامل کالیپر، ضخامت پوستی به میلیمتر اندازهگیری شد. محلهای اندازهگیری شامل 7 ناحیه: عضله سینهای، سهسر بازو، فوق خاصره، شکمی، تحت کتفی، زیربغل و بالای ران بود؛ درحالیکه شخص ایستاده بود، ۲ یا ۳ بار اندازهگیری در هر کدام از نواحی فوق و در سمت راست بدن انجام شد، سپس مقادیر بهدستآمده در فرمول شماره 1 قرار داده شد و درصد چربی بدن هر فرد به دست آمد [27].
1. درصد چربی بدن= (مجموع 4 ناحیه اندازهگیریشده ×0/29288)-(0/0005×مجموع جمع 4 ناحیه)+(سن×0/15845)-5/766377
برآورد قدرت عضلانی پا از طریق آزمون 30 ثانیه نشستن و برخاستن روی صندلی
هدف از این آزمون ارزیابی قدرت پایین تنه است که آزمونی مناسب افراد سالخورده میباشد. آزمون با نشستن روی صندلی و دست روی سینه بهصورت ضربدری، با فرمان حرکت آغاز میشود و زمان نیز بهمدت 30 ثانیه ثبت میشود و تعداد دفعاتی که فرد از روی صندلی بلند میشود و دوباره مینشیند شمرده میشود و با اتمام وقت آزمون به پایان میرسد [28].
برآورد استقامت عضلانی پا از طریق آزمون 2 دقیقه گام برداشتن
هدف از این آزمون ارزیابی استقامت عضلانی پایینتنه میباشد که برای افراد سالخورده مناسب است. در این تمرین باید زانوها تا سطح مشخصشده که نصف فاصله کشکک زانو و تاج خاصره بود بالا بیاید و بهطور متناوب این حرکت بهمدت 2 دقیقه ادامه داشته باشد و تعداد گامها شمرده شود [29].
روشهای آماری
به منظور تجزیهوتحلیل دادهها از آزمون آنووا با اندازهگیریهای مکرر استفاده شد. در صورت معنیدار بودن اثر زمان در گروه و برای مقایسه جفت گروهها آزمون تقیبی بونفرونی مورد استفاده قرار گرفت. سطح معنیداری 05/P≤0 در نظر گرفته شد و دادهها با استفاده از نرمافزار SPSS نسخه 23 تجزیهوتحلیل شدند. پذیرههای زیربنایی مدل شامل آزمونهای توزیع طبیعی با استفاده از آزمونهای کولوموگروف- اسمیرنوف و شاپیرو ویلک و همچنین برابری خطاهای واریانس با آزمون لون مورد ارزیابی و تأیید قرار گرفت.
یافتهها
نتایج آمار توصیفی گروههای تحقیق و درصد تغییرات متغیرها در جدول شماره 3 ارائه شد.
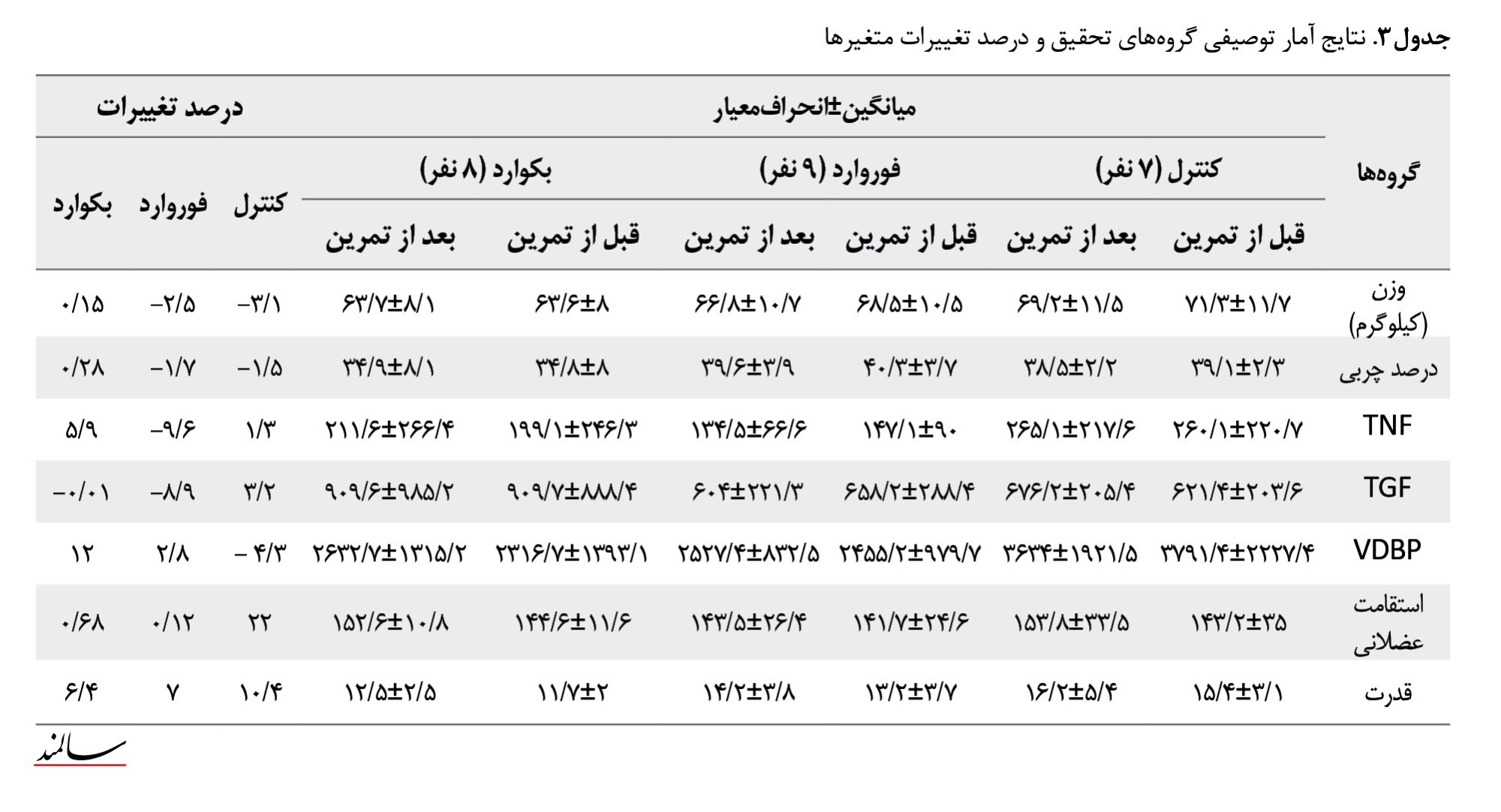
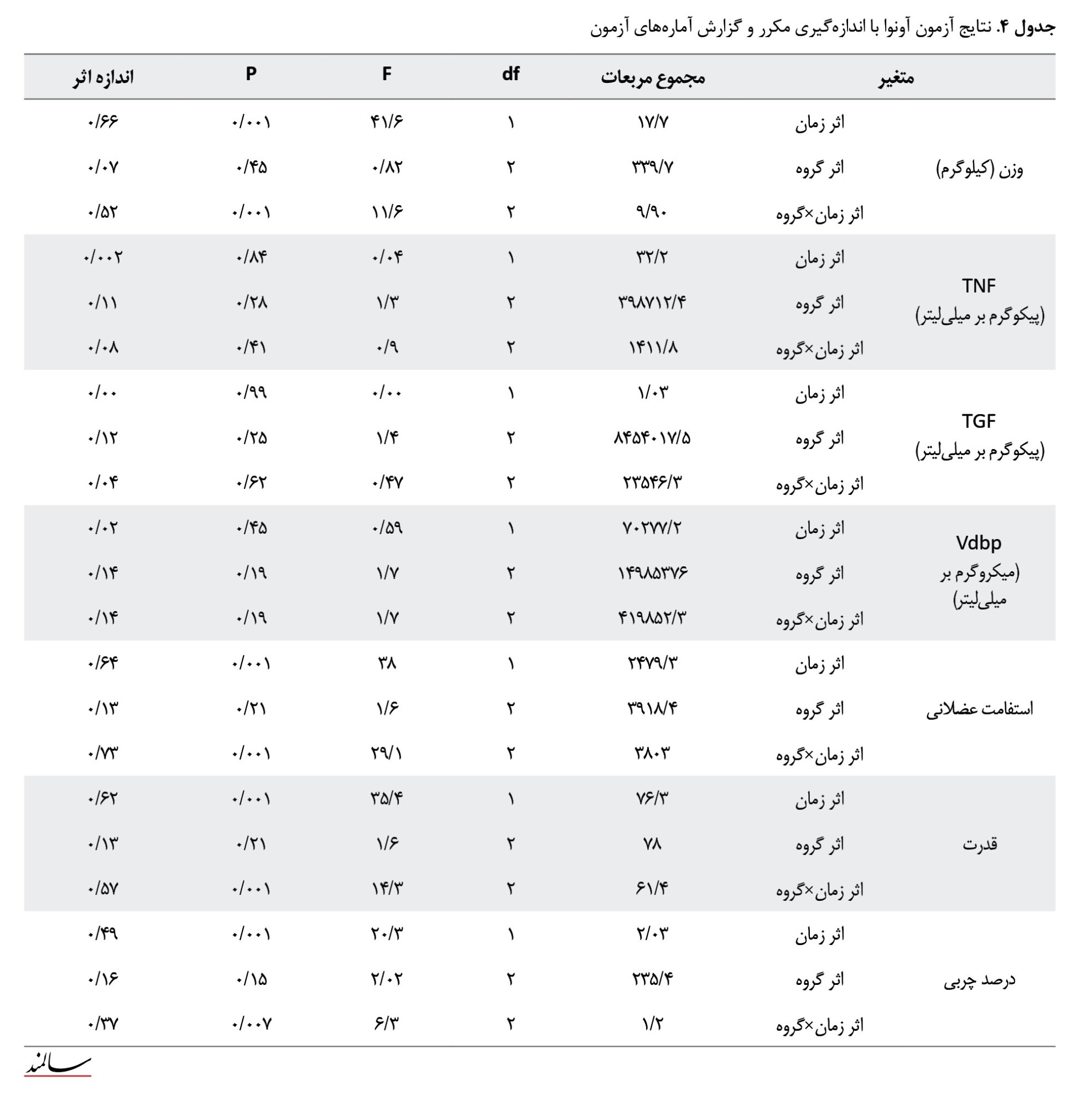
همانطور که در جدول شماره 4 مشخص شده است، برای متغیر وزن بدن، یافتههای آزمون تحلیل واریانس با اندازهگیری تکراری نشان داد که اثر زمان (F=41/62 و P=0/001) و اثر متفابل زمان در گروه (F=11/62 و P=0/0001) معنیدار بود. برای متغیر درصد چربی نیز اثر زمان (F=20/32 و P=0/0001) و اثر متفابل زمان در گروه (F=6/37 و P=0/007) معنیدار بود. باتوجهبه اثر معنیدار زمان در گروه، نتایج آزمون تعقیبی بونفرونی نشان داد افزایش درصد چربی در گروه کنترل معنیدار نبود (F=1/950 و P=0/077)، اما کاهش درصد چربی در گروه تمرین معنیدار بود (F=2/755 و P=0/019). در تجزیهوتحلیل فاکتورهای بیوشیمیایی (TNF-α، TGF-β، VDBP)، با استفاده از تحلیل واریانس با اندازهگیری تکراری، نشان داده شد که هیچیک از اثرات زمان، زمان در گروه و گروه برای این شاخصها معنیدار نبود. دررابطهبا شاخصهای عملکردی نشان داده شد برای متغیر استقامت عضلانی، بین گروه کنترل با هر دو گروه تمرینی، تفاوت معنیداری وجود داشت، همچنین در گروه کنترل قبل از تمرین نسبت به بعد از تمرین تفاوت معنیداری وجود داشت. اثر زمان در گروه برای این متغیر (F=29/15 و P=0/001) معنیدار بود. برای متغیر قدرت عضلانی نیز اثر متفابل زمان در گروه (F=14/3 و P=0/001) معنیدار بود و فقط بین گروه کنترل با BW تفاوت معنیداری مشاهده شد.
بحث
یافتههای پژوهش حاضر نشان داد که 8 هفته تمرین راه رفتن به جلو و عقب سبب بهبود معنیدار قدرت و استقامت عضلانی در گروه راه رفتن به عقب شد، اما تغییر معنیداری در سطوح TNF-α، TGF-β و VDBP در هیچیک از گروهها ایجاد نکرد. در مطالعه حاضر برنامه تمرین راه رفتن به جلو اثر معنیداری بر قدرت عضلانی نداشت و تنها راه رفتن به عقب باعث افزایش معنیدار قدرت عضلانی شد. همراستا با تحقیق حاضر، در مطالعهای که فخاریان و همکاران بر روی 30 دختر 15 تا 16 ساله که در دو گروه راه رفتن و دویدن به جلو و عقب بهمدت 6 هفته، 3 بار در هفته و جلسهای 15 دقیقه با سرعت دلخواه انجام دادند و قدرت را با استفاده از آزمون مدتزمان طیشده بهصورت لیلی در مسافت 6 متری آزمودند، افزایش قدرت تقریباً 10 درصد در گروه فعالیت رو به جلو و 20 درصد در فعالیت رو به عقب بعد از 6 هفته تمرین مشاهده کردند [30]. دلیل درصد تغییرات بیشتر قدرت در مطالعه حاضر نسبت به این مطالعه بهجز تفاوت در گروه های سنی آزمودنیها، میتواند میزان شدت تمرین مورد استفادهشده در مطالعه حاضر در مقایسه با سرعت دلخواه تمرین در مطالعه فخاریان و همکاران [30] باشد.
کاچاناتو و همکاران [31] نیز در تحقیقی که بر روی 30 مرد و 10 زن، 25 ساله انجام دادند، مشاهده کردندکه قدرت عضلات پلانتار فلکسورهای مچ و چهارسر در گروه راه رفتن به عقب در مقایسه با راه رفتن به جلو افزایش معنیداری داشت، اما قدرت عضلات همسترینگ در هر دو گروه تغییر معنیداری نداشت [31]. براساس این مطالعه و تحقیقات ویلنسکی و همکاران [32] یک دلیل افزایش قدرت عضلات با تمرین راه رفتن به عقب این است که عملکرد عضلات حین راه رفتن به جلو و راه رفتن به عقب متفاوت است. راه رفتن به عقب نیاز به فعالیت ایزومتریک و کانسنتریک گروه عضلات چهارسررانی و پلانتار فلکسورهای مچ پا دارد، فعالیت این عضلات درست بهعنوان کاهنده سرعت عمل میکند و بهصورت عمده عمل اکسنتریک دارند اما در راه رفتن به عقب عضلات چهار سر در ابتدا بهصورت ایزومتریک برای تثبیت زانو و بعد بهصورت کانسنتریک عمل میکنند. مطالعات نشان داده است که کار مثبت همراه با انقباضات کانسنتریک همیشه ارزش بیشتری از کار منفی همراه با انقباضات اکسنتریک دارد [31]. بنابراین مقدار افزایش فعالیت عضلانی کانسنتریک همراه با راه رفتن به عقب ممکن است تا حدی افزایش مشاهدهشده در هزینه سوختوساز را توضیح دهد. دلایل متعددی برای بهبود قدرت عضلانی وجود دارد، اسچوان و همکاران [33] نشان دادند یک کار حرکتی نسبتاً جدید بهکارگیری واحدهای حرکتی را افزایش میدهد و بنابراین باعث افزایش هزینه متابولیک فعالیت میشود و میتواند توجیهی برای افزایش قدرت عضلانی در گروه راه رفتن به عقب باشد [33].
در مطالعه حاضر هر دو نوع برنامه تمرین راه رفتن به جلو و راه رفتن به عقب نسبت به گروه کنترل باعث افزایش معنیدار عملکرد استقامتی شد، بهطوریکه عملکرد استقامتی در گروه راه رفتن به عقب نسبت به گروه راه رفتن به جلو افزایش بیشتری داشت. نتایج تحقیقات فلاین و سواتاس لیتل [34]، فخاریان و همکاران [30]، تربلانچ و همکاران [35]، چیلدز و همکاران [36]، وو و همکاران [37] و حسینی و همکاران [38] با نتایج مطالعه حاضر همخوانی داشت.
چیلدز و همکاران [36] بعد از بررسی تمرین راه رفتن به عقب با سرعت 60 درصد حداکثر اکسیژن مصرفی بر روی 7 مرد و زن 23 تا 49 ساله که بهمدت 6 هفته، به این نتیجه رسیدند که راه رفتن به عقب باعث کاهش هزینه متابولیکی و افزایش کارایی در آنها شد و این افزایش را ناشی از افزایش کارایی از واحدهای حرکتی باتوجهبه نوع تمرین دانستند [36]، به نظر میرسد افزایش عملکرد استقامتی مطالعه حاضر نیز ناشی از همین عامل باشد. ازآنجاکه تمرینات راه رفتن به عقب جدیدتر و ناآشناتر از تمرینات راه رفتن رو به جلو محسوب میشود، بنابراین راه رفتن به عقب مستلزم دقت و توجه بیشتری در حرکات است و درنتیجه ممکن است باعث بهبود عملکرد (استقامتی) شود [39].
در مطالعه حاضر هر دو نوع برنامه تمرین راه رفتن به جلو و راه رفتن به عقب نسبت به گروه کنترل تغییر معنیداری در سطوح TNF-α ایجاد نکرد. این یافتهها با یافتههای برخی تحقیقات انجامشده همسو میباشد. وایندسر و همکاران نشان دادند که یک جلسه تمرین دوچرخهسواری تداومی با شدت متوسط و اینتروال با شدت بالا، تغییر معنیداری در پاسخ سایتوکاینها در افراد مسن ایجاد نکرد و این پاسخها درسالمندان با سطوح بالا یا پایین آمادگی قلبی ریوی یکسان بود [40].
تحقیقات بهطورکلی نشان دادهاند فعالیت بدنی سبب کاهش سطح سایتوکینهای پیشالتهابی میشود [41، 42]. ناهمسو با تحقیق حاضر، کراب و همکاران [43] در تحقیق خود نشان دادند، افزایش نیم ساعت فعالیت ورزشی در هفته میتواند سطح TNF-α را در زنان سالمند کاهش دهد[43]. درخصوص مکانیسم عملکرد تمرین در تغییر عوامل التهابی ازجمله TNF-α موارد متعددی بیان شده است. تحقیقات مختلف نشان دادهاند با افزایش سن، بافت چربی شکمی افزایش و بافت عضلانی بدن کاهش مییابد [43]. به نظر میرسد انجام تمرین در سالمندان موجب بهکارگیری بیشتر عضلات برای انجام فعالیت میشود. ازآنجاکه تمرینات مقاومتی و استقامتی باعث افزایش اکسیداسیون چربی میشود، میتواند باعث کاهش سایتوکاینهای پیشالتهابی [44] و افزایش سایتوکینهای ضدالتهابی گردد [45، 46]. مکماهون و همکاران [47] بیان کردند که بعد از 12 هفته تمرین قدرتی در افراد مسن، سطوح پایه گیرنده TNF-α با افزایش قدرت عضله ارتباط معکوس و معنیداری دارد [47].
تحقیقات مختلف نشان دادهاند میزان TNF-α بهطور معکوسی با میزان سنتز پروتئین عضله در ارتباط است. TNF-α سبب کاهش سنتز پروتئین میشود. همچنین محتوای TNF-α بهطور معکوسی با محتوای LPL عضله در ارتباط است. تمرین بهویژه تمرین مقاومتی، از طریق تحریک اثرات مهاری TNF-α بر بیان LPL و سنتز پروتئین ممکن است به سنتز پروتئین جدید منجر شود و یک منبع ترجیحی انرژی (اسیدهای چرب آزاد ناشی از عمل LPL) را برای حمایت از سنتز پروتئین فراهم کند [48، 49].
نشان داده شده است TNF-α و TGF-β1 بر یکدیگر اثر متقابل دارند و افزایش بیان TNF-α از طریق افزایش بیان ژنی پروتئاز فورین [50] موجب افزایش سنتز TGF-β1 در بافت چربی میشود [51]. در پژوهش حاضر، سطوح TGF-β1 پس از 8 هفته تمرین راه رفتن به جلو و عقب تغییر معنیداری نکرد. با بررسی انجامشده تا این لحظه، دررابطهبا اثر تمرین بر سطوح TGF-β1 در افراد سالمند، تحقیقات اندکی انجام شده است [52-55]. در پژوهش حاضر، ممکن است عدم تغییر TNF-α در پاسخ به تمرین موجب عدم تغییر معنیدار TGF- β1 شده باشد. تحقیقات نشان دادهاند فورین یکی از عواملی است که به واسطه TNF-α قادر است سطوح پلاسمایی و بیان TGF-β1 را تنظیم کند، هرچند در تحقیق حاضر این شاخص اندازهگیری نشد [56]. دادههای ما با یافتههای قبلی که نشان دادند تمرینات قدرتی سطح TGF-β را تغییر نمیدهد، مطابقت دارد [55]. هالپر و همکاران [52] نیز نشان دادند سطوح TGF-β و همچنین بیان ژن TGF-β، تحت تأثیر تمرین مقاومتی با کش قرار نگرفت [52].
مطالعه دیگری که به بررسی تأثیر یک دوره تمرین ترکیبی در بیماران 55 ساله دیابتی نوع 2 پرداخته است، نشان داد سطوح TGF-β در اثر تمرین افزایش یافت [57]. رجبی و همکاران [53] نیز نشان دادند 8 هفته تمرین مقاومتی با تراباند در زنان سالمند، سبب کاهش معنیدار سطوح TGF-β شد [53]، اما بهدلیل اینکه جمعیت موردمطالعه و برنامه تمرینی در این تحقیقات متفاوت است، امکان مقایسه مستقیم را دشوار میسازد. هاینمر و همکاران [58]، نشان دادند 1 ساعت دویدن بر روی تردمیل غلظت پلاسمایی TGF-β را افزایش میدهد [58]. این افزایش در سطوح TGF-β در پاسخ به تمرین میتواند به چندین دلیل باشد. تمرین طولانیمدت، محتوا و فعالیت پلاکت ها را افزایش میدهد [59] و این افزایش در سطوح TGF-β در پاسخ به تمرین طولانیمدت، ممکن است بهدلیل ترشح TGF-β از پلاکتها باشد [59]. همچنین آنها بیان کردند TGF-β در سلولهای مختلفی بیان میشود [60] و مطالعات مختلفی یک ارتباط قوی و معنیدار را بین میزان فشار و بار مکانیکی اعمالشده در اثر تمرین و سنتز TGF-β در سلولهای مختلف نشان دادهاند. احتمالاً بافتهایی که در حین تمرین، فشار مکانیکی بر آنها اعمال میشود، ازجمله استخوان، عضله، تاندون، قلب و بافتهای عروقی ممکن است سبب افزایش سنتز TGF-β در پاسخ به تمرین شوند و درنتیجه سطوح گردش خونی TGF-β افزایش یابد. صرفنظر از علت، اینکه تمرین موجب افزایش سیستمیک TGF-b میشود، یک یافته جالب است، زیرا نشان داده شده است TGF-β موجب سرکوب عملکرد ایمنی میشود، بنابراین میتواند به دوره موقت کاهش عملکرد سلولهای ایمنی بدن که پس از یک جلسه تمرین طولانیمدت رخ میدهد، نسبت داده شود [61].
بهخوبی نشان داده شده است تمرینات ورزشی منظم سبب کاهش التهاب مزمن ناشی از پیری و عدم فعالیت بدنی میشود [62، 63]. به نظر میرسد بافت چربی نقش مهمی در این سناریو ایفا میکند، زیرا منبع اصلی هورمونها و سیتوکینهای متعدد است [64]. بهویژه، ذخایر چربی احشایی و ماکروفاژها که سیتوکینهای پیش و ضدالتهابی مانند TNF-α و TGF-β را آزاد میکنند [65]. افزایش در هزینههای انرژی ناشی از فعالیت بدنی، درصد چربی بدن را کاهش میدهد و درنتیجه ظرفیت تولید و ترشح فاکتورهای ضدالتهابی را تحت تأثیر قرار میدهد [65].
در تحقیق حاضر تغییری در میزان VDBP مشاهده نشد که این نتایج تقریباً ناهمسو با نتایج واشبیش و همکاران [66] بود که بیان کردند ارتباط مثبت و معنیداری بین سطح آمادگی بدنی و سطوح سرمی ویتامین D وجود دارد [66]. البته در این تحقیق تمرین ورزشی داده نشد و سطح ویتامین D برآورد شده است نه VDBP، لیکن ظاهراً تنها تحقیقی است که تاکنون درخصوص این شاخص انجام شده است. از طرفی مطالعه زو و همکاران که بر روی بافت کولون موشهای مبتلابه بیماری التهابی روده انجام شد نشان داد 1و 25 هیدروکسی ویتامین D قادر به تنظیم کاهشی چندین ژن مرتبط با TNF-α میباشد [67]. مطالعات انسانی نیز دررابطهبا مکملدهی ویتامین D برای یک دوره 6 ماهه در زنان مبتلابه پوکی استخوان در مرحله پس از یائسگی به کاهش قابلملاحظه در غلظت TNF-α منجر شد [68]. شاید بتوان گفت عدم تغییر VDBP یکی از دلایل عدم تغییر در شاخصهای التهابی باشد.
نتبجهگیری نهایی
سالمندی خوب و موفق احتمالاً بدون تمرین اتفاق نخواهد افتاد. تحقیقات نشان میدهند TNF-a توسط میوسیتهای انسانی رونویسی میشوند و در عضلات سالمندان افزایش مییابند و تمرین بدنی سبب کاهش سطوح آنها میگردد. بنابراین ممکن است تمرین بدنی از طریق تغییر غلظتهای بالقوه سیتوکین مضر در عضلات اسکلتی، روند سالمندی را بهبود دهد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق پژوهش پژوهشگاه تربیت بدنی و علوم ورزشی با کد اخلاق IR.SSRC.REC.1398.022 تصویب شده است. مشارکتکنندگان فرم رضایت آگاهانه مکتوب را قبل از شروع مطالعه تکمیل کردند. قبل از آن توضیحات شفاهی لازم درباره اهداف مطالعه به مشارککنندگان ارائه و به آنها اطمینان داده شد که بهصورت ناشناس و بینام در مطالعه شرکت خواهند کرد.
حامی مالی
این پژوهش از طرف دانشگاه کوثر بجنورد با شماره قرارداد NO.0111081950 حمایت شده است.
مشارکت نویسندگان
مفهومسازی، روششناسی، گردآوری دادهها و نگارش مقاله: میترا خادم الشریعه و اعظم ملانوروزی؛ تجزیهوتحلیل دادهها: مرضیه السادات آذرنیوه و ایوب سعیدی؛ ادیت مقاله و نظارت: میترا خادم الشریعه.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از همه سالمندان شرکتکننده در مطالعه، پرسنل مراکز جامع خدمات سلامت و معاونت تحقیقات و فناوری دانشگاه کوثر بجنورد تشکر و قدردانی میکنند.
دوره سالمندی با تغییرات مورفولوژیکی و فیزیولوژیکی شبیه به از دست دادن قدرت عضلانی، انعطافپذیری، تعادل و کاهش دیگر عملکردهای جسمانی بهویژه در زنان و همچنین تغییرات پیکرشناسی و ترکیب بدن مثل کاهش وزن، قد و چگالی مواد معدنی استخوان همراه است که اینها با شیوه زندگی کمتحرک تشدید میشود و باعث تغییر در کیفیت زندگی افراد و افزایش خطر افتادن بهخصوص در زنان خواهد شد [1].
امروزه با افزایش سن، سیستم ایمنی بدن باید برای مدت طولانیتری فعال باشد و این مدتزمان طولانی به آرامی به التهاب مزمن منجر میشود. این پدیده ویژهای است که مرتبط با سن و عامل خطر اصلی برای بیماریهای مزمن مرتبط با سن به شمار میرود، بهطوریکه علت بیماریهای آلزایمر، تصلب شرائین، دیابت و حتی سارکوپنیا و سرطان را بیشتر پدیده التهاب میدانند [2]. در بین مارکرهای متعدد التهاب مزمن، عامل نکروز تومور آلفا (TNF-α) به میزان بیشتری مورد توجه قرار گرفته است [3]. مشخص شده است سطوح بالای این سایتوکینها از عوامل قوی پیشبینی خطر مرگومیر در افراد میانسال و سالمند میباشد [4] و با عوامل خطر سایر بیماریها (دیابت، سرطان و ناتوانی) نیزارتباط دارند [5].
سیستم ایمنی نشانگر خوبی از سرعت رسیدن به سالمندی و سن بیولوژیکی هر فرد و در نتیجه طول عمر اوست. چنانکه ضعف سیستم ایمنی میتواند سرعت رسیدن به سالمندی را افزایش دهد و درنتیجه باعث کاهش طول عمر فرد شود. سلولهای لنفاوی، سلولهای التهابی و سلولهای خونساز در ایجاد یک پاسخ ایمنی موثر نقش دارند. سلولهای ایمنی ذاتی در طی مراحل نخستین و اجرایی پاسخهای ایمنی ذاتی و اکتسابی با دیگر سلولهای ایمنی ذاتی و نیز با سلولهای میزبان وارد تعامل میشوند. بسیاری از برهمکنشها بهواسطه پروتئینهایی ترشحی موسوم به سایتوکاینها صورت میگیرد [6]. ازجمله سایتوکاینهایی که به تغییر در سلولهای ایمنی منجر میشود TGF-β است. TGF-β نقشهای متنوعی در فرآیندهای سلولی دارد که شامل تکثیر، تمایز متابولیسم پروتئین و رشد و بازسازی و تغییر و تحول ماتریکس خارج سلولی میباشد. همچنین نقش مهمی در التهاب و عملکرد سیستم ایمنی دارد و تحت تأثیر سن قرار میگیرد [7].
از طرفی فرایند پیری با کاهش تراکم استخوان، افت ظرفیت کارکردی و افزایش خطر افتادن همراه است. ازآنجاکه زنان نسبت به مردان کمتر به اوج توده عضله و استخوان خود دست مییابند، آنها بیشتر مستعد اختلالات اسکلتی-عضلانی مرتبط با افزایش سن هستند. بنابراین شناخت مداخلاتی که احتمالاً با اختلالات اسکلتی-عضلانی مرتبط با سن مقابله میکند، ضروری به نظر میرسد [8، 9]. ویتامین D به شکل D2 (OH) 1/25یک هورمون استروسیدی است که عمدتاً بهواسطه نقش در هموستازکلسیم و متابولیسم استخوان شناخته میشود. بههرحال، شواهد رو به رشد نشان میدهد ویتامین D نقش مهمی در بسیاری از بافتهای بدن از جمله عضله اسکلتی دارد، بهطوریکه در سطح سلولهای عضله اسکلتی سطوح بالای گیرنده ویتامین D وجود دارد و تعداد این گیرندهها با افزایش سن کاهش مییابد [10]. روتئین متصل به ویتامین D(VDBP)، پروتئین پلاسمایی اصلی حامل ویتامین D و متابولیتهای آن میباشد که مسئول انتقال ویتامین D3 به کبد و 25 هیدروکسی ویتامین D به کلیه و 25 و 1 هیدروکسی ویتامین D به ارگانهای هدف میباشد [11].
فعالیت بدنی بهعنوان یک مداخله غیردارویی کم هزینه، میتواند وسیلهای برای جلوگیری از ضعف و مرگومیر در افراد مسن باشد [12، 13]. برنامههای ورزشی مختلفی برای افزایش آمادگی جسمانی و تعادل برای سالمندان استفاده شده است و بیشترین روشهای تمرینی برنامههای تمرین ترکیبی است که عمدتاً شامل تمرینات قدرت عضلانی، انعطافپذیری و برنامههای تعادلی میباشد و فقدان یک برنامه تمرینی ساده و تأثیرگذار برای افزایش آمادگی جسمانی در سالمندان احساس میشود [14].
تمرینات هوازی شبیه راه رفتن و دویدن در سالمندان، استقامت قلبیعروقی را در آنها بهبود میبخشد، راه رفتن چون نیروی ضربهای کمتری از دویدن ایجاد میکند، درنتیجه باعث فشار کمتر بر استخوان و مفاصل در اندام تحتانی میشود. راه رفتن کم هزینهترین و دردسترسترین نوع فعالیت بدنی است. راه رفتن علاوه بر اینکه برای تمام گروههای سنی مناسب است نیاز به زمان، مکان، هزینه و مهارت خاصی ندارد [15]. راه رفتن به عقب یک حرکت پویای برگرداننده با فواید مستند قلبیعروقی است [16] و باعث کنترل تعادل میشود [17]. درحالحاضر اغلب در برنامههای توانبخشی مختلف، راه رفتن به عقب بهویژه برای اختلالاتی که درآن راه رفتن به جلو باعث تشدید درد زانو میشود گنجانده شده است [18]. براساس گزارشهای پژوهشی، سبک زندگی فعالانه با کاهش سطح سایتوکینهای التهابی و بهبود وضعیت جسمانی و عملکرد سیستم ایمنی در افراد مسن همراه است [19].
مطالعات زیادی بر اثرات ورزش در افراد مسن انجام شده است، اما هنوز هیچ توافقی در نوع برنامه، شدت و مدت آن بهعنوان مؤثرترین روش در بهبود کیفیت زندگی و رفاه آنان و کاهش عوامل التهابی وجود ندارد [20]. به نظر میرسد راه رفتن به عقب برخلاف راه رفتن به جلو موجب درگیری بیشتر سیستم عصبی میشود و مغز را بیشتر درگیر میکند و بر عملکرد شناختی اثر بیشتری دارد. عوامل التهابی از طریق مسیرهای مختلفی میتوانند از سد خـونی-مغـزی عبـور کنند و باعـث کـاهش نـوروژنز و اختلال در حافظه و یادگیری شوند [21، 22]. ازطرفی تحقیقات نشان دادهاند ورزش سبب کاهش ســطوح سایتوکینهای پیشالتهابی [22] و تنظیم عملکرد سیستم ایمنی، به دنبال بیان TGF-β [23] و بهبود سطوح ویتامین D و VDBP [24] میشـود. ازآنجاکه برنامه تمرین راه رفتن به عقب بهعنوان یک روش پیشگیری و درمان عوارض سالمندی کمتر مورد توجه قرار گرفته است، هدف از این تحقیق پاسخ به این سؤال است که آیا بین راه رفتن به جلو و راه رفتن به عقب و آمادگی جسمانی زنان سالمند و فاکتورهای التهابی و ایمنی مرتبط با عملکرد مغز رابطهای وجود دارد؟
روش مطالعه
جامعه و نمونه آماری
تحقیق بهصورت نیمهآزمایشی با طرح پیشآزمون و پسآزمون در دو گروه آزمایش و کنترل انجام شد. تعداد 30 نفر از افرادی انتخاب شدندکه دارای چنین شرایطی بودند: سلامت عمومی و قلبیعروقی، توانایی حضور در جلسات تمرینی، پذیرش انجام تستهای موردنیاز، عدم مصرف دارو و عدم ابتلا به بیماریهای خاص و بیماریهای شدید ارتوپدی. از تمام افراد شرکتکننده در تحقیق، معاینه پزشکی (سلامت عمومی، سلامت قلبیعروقی و فشارخون) گرفته شد. تمام آزمودنیها فرم رضایتنامه کتبی مبنی بر شرکت در پژوهش را تکمیل کردند. جامعه آماری تحقیق حاضر شامل زنان سالمند یائسه بین 60 تا 75 سال بود که بهصورت روزانه فعالیت بدنی داشتند. 30 نفر بهطور تصادفی انتخاب شدند که 6 نفر از آنها از ادامه شرکت در تحقیق انصراف دادند و 24 نفر باقیمانده بهطور تصادفی در یکی از 3 گروه: تمرینات راه رفتن به جلو (8 نفر)، تمرینات راه رفتن به عقب (9 نفر) و کنترل (7 نفر) قرار گرفتند. برنامه تمرینی بهمدت 8 هفته انجام شد. 1 هفته قبل از شروع آزمون، 1 جلسه آشنایی با برنامه تمرینی برای آزمودنیها گذاشته شد.
روش اجرای پژوهش
پیشآزمون
قبل از شروع تمرینات ورزشی از آزمودنیها اندازهگیریهای پیکرسنجی شامل سن، قد، وزن و نمایه توده بدن و همچنین پیشآزمونهای قدرت عضلانی (30 ثانیه نشستن و ایستادن)، استقامت عضلانی (2 دقیقه گام برداشتن) و نمونهگیری خونی (جهت تجزیهوتحلیل بیوشیمایی) به عمل آمد. سپس آزمودنیها بهطور تصادفی در 3 گروه راه رفتن به جلو، راه رفتن به عقب و کنترل قرار گرفتند. در روز خونگیری، آزمودنیها در آزمایشگاه حاضر شدند، از آزمودنیها در حالت ناشتا مقدار 5 سیسی خون از ورید بازویی گرفته شد. 2 سی سی از خون تازه جهت اندازهگیری CBC به آزمایشگاه فرستاده شد. 3 سی سی باقیمانده سانتریفیوژ شد و در 3 الیکوت برای انجام آزمایشات بیوشیمیایی (اندازهگیری TGF-β ،TNF-α و VDBP) در یخچال 80- درجه نگهداری شد.
مقدار TGF-β ،TNF-α و VDBP سرم به روش الایزا و بهترتیب مطابق با دستورالعمل کشور سازنده ( فاکتور رشد تبدیلکننده انسانی بتا (TGF-β1)، کیت الایزا، تورنس، ایالات متحده آمریکا) (فاکتور نکروز تومور α (TNF-α)، کیت الایزا، تورنس، ایالات متحده امریکا) (پروتئین متصل به ویتامین d،VDBP، کیت الایزا، تورنس، ایالات متحده امریکا) با درجه حساسیت (1/52 نانوگرم بر لیتر) TNF-α، TGF-β1 (5/11 نانوگرم بر لیتر) VDBP(5/41 میکروگرم بر میلیلیتر) اندازهگیری شد. پس از این مرحله، آزمودنیهای 2 گروه تمرینات ورزشی بهمدت 8 هفته، تمرینات خود را و گروه کنترل تنها فعالیتهای روزمره و عادی خود را انجام دادند.
پروتکل تمرینی
دو گروه راه رفتن به جلو و راه رفتن به عقب 3 جلسه در هفته و بهمدت 8 هفته به تمرین پرداختند. برنامه تمرین در هر جلسه شامل 10 دقیقه گرم کردن عمومی برنامه تمرین اصلی و 10 دقیقه سرد کردن بود. آزمودنیها به 3 گروه کنترل، تمرین راه رفتن به جلو و تمرین راه رفتن به عقب تقسیم شدند. در گروه کنترل افراد غیرفعال بودند، در گروه تمرین راه رفتن به جلو آزمودنیها در 3 تکرار مسافت 300 متر راه رفتن به جلو انجام دادند و در گروه تمرین راه رفتن به عقب نیز آزمودنیها در 3 تکرار مسافت 300 متر راه رفتن به عقب را انجام دادند (جداول شماره 1 و 2). از مقیاس بورگ برای ارزیابی میزان درک فشار و درد، در ابتدا و انتهای هر برنامه تمرینی هنگام اجرای آزمونها استفاده شد.


پسآزمون
پس از 8 هفته، آزمودنیها تحت شرایط قبل از تمرینات ورزشی، یعنی عدم فعالیت بدنی در 48 ساعت قبل از خونگیری در آزمایشگاه حضور پیدا کردند و مانند پیشآزمون، از تمام آزمودنیها نمونه خونی گرفته شد. همچنین از تمام آزمودنیهای 3 گروه اندازهگیری پیکرسنجی و آزمونهای قدرت عضلانی، استقامت عضلانی همانند پیشآزمون گرفته شد.
روش اندازهگیری متغیرها
مقیاس درک فشار بورگ Borg RPE Scale:
این مقیاس در ورزش و مخصوصاً در تستهای بدنی فشار درکشده را اندازه میگیرد. در پزشکی این مقیاس برای ثبت فشار اعمالشده توسط بیمار حین انجام تست به کار میرود و مربیان ورزشی از این مقیاس برای تعیین شدت تمرین و مسابقه استفاده میکنند. مقیاس اصلی گونار بورگ، فشار را روی مقیاسی بین 6-20 نمرهدهی میکند [25، 26]. در این تحقیق، ما شدتی بین 14-15 را در نظر گرفتیم که نسبتاً سنگین محسوب میشد.
اندازهگیری درصد چربی بدن:
اندازهگیری درصد چربی با استفاده از کالیپر انجام شد. با استفاده از انگشت شست و اشاره، چینی از پوست و چربی زیرپوستی را گرفته و برای جدا کردن از بافت عضلانی زیرین بالا کشیده میشد. دهانه کالیپر، فشاری معادل 10/3 گرم بر سانتیمتر در محل تماس با دو لایه پوست و بافت زیرپوستی اعمال میکرد. در این تحقیق 2-4 ثانیه پس از اعمال فشار کامل کالیپر، ضخامت پوستی به میلیمتر اندازهگیری شد. محلهای اندازهگیری شامل 7 ناحیه: عضله سینهای، سهسر بازو، فوق خاصره، شکمی، تحت کتفی، زیربغل و بالای ران بود؛ درحالیکه شخص ایستاده بود، ۲ یا ۳ بار اندازهگیری در هر کدام از نواحی فوق و در سمت راست بدن انجام شد، سپس مقادیر بهدستآمده در فرمول شماره 1 قرار داده شد و درصد چربی بدن هر فرد به دست آمد [27].
1. درصد چربی بدن= (مجموع 4 ناحیه اندازهگیریشده ×0/29288)-(0/0005×مجموع جمع 4 ناحیه)+(سن×0/15845)-5/766377
برآورد قدرت عضلانی پا از طریق آزمون 30 ثانیه نشستن و برخاستن روی صندلی
هدف از این آزمون ارزیابی قدرت پایین تنه است که آزمونی مناسب افراد سالخورده میباشد. آزمون با نشستن روی صندلی و دست روی سینه بهصورت ضربدری، با فرمان حرکت آغاز میشود و زمان نیز بهمدت 30 ثانیه ثبت میشود و تعداد دفعاتی که فرد از روی صندلی بلند میشود و دوباره مینشیند شمرده میشود و با اتمام وقت آزمون به پایان میرسد [28].
برآورد استقامت عضلانی پا از طریق آزمون 2 دقیقه گام برداشتن
هدف از این آزمون ارزیابی استقامت عضلانی پایینتنه میباشد که برای افراد سالخورده مناسب است. در این تمرین باید زانوها تا سطح مشخصشده که نصف فاصله کشکک زانو و تاج خاصره بود بالا بیاید و بهطور متناوب این حرکت بهمدت 2 دقیقه ادامه داشته باشد و تعداد گامها شمرده شود [29].
روشهای آماری
به منظور تجزیهوتحلیل دادهها از آزمون آنووا با اندازهگیریهای مکرر استفاده شد. در صورت معنیدار بودن اثر زمان در گروه و برای مقایسه جفت گروهها آزمون تقیبی بونفرونی مورد استفاده قرار گرفت. سطح معنیداری 05/P≤0 در نظر گرفته شد و دادهها با استفاده از نرمافزار SPSS نسخه 23 تجزیهوتحلیل شدند. پذیرههای زیربنایی مدل شامل آزمونهای توزیع طبیعی با استفاده از آزمونهای کولوموگروف- اسمیرنوف و شاپیرو ویلک و همچنین برابری خطاهای واریانس با آزمون لون مورد ارزیابی و تأیید قرار گرفت.
یافتهها
نتایج آمار توصیفی گروههای تحقیق و درصد تغییرات متغیرها در جدول شماره 3 ارائه شد.

همانطور که در جدول شماره 4 مشخص شده است، برای متغیر وزن بدن، یافتههای آزمون تحلیل واریانس با اندازهگیری تکراری نشان داد که اثر زمان (F=41/62 و P=0/001) و اثر متفابل زمان در گروه (F=11/62 و P=0/0001) معنیدار بود. برای متغیر درصد چربی نیز اثر زمان (F=20/32 و P=0/0001) و اثر متفابل زمان در گروه (F=6/37 و P=0/007) معنیدار بود. باتوجهبه اثر معنیدار زمان در گروه، نتایج آزمون تعقیبی بونفرونی نشان داد افزایش درصد چربی در گروه کنترل معنیدار نبود (F=1/950 و P=0/077)، اما کاهش درصد چربی در گروه تمرین معنیدار بود (F=2/755 و P=0/019). در تجزیهوتحلیل فاکتورهای بیوشیمیایی (TNF-α، TGF-β، VDBP)، با استفاده از تحلیل واریانس با اندازهگیری تکراری، نشان داده شد که هیچیک از اثرات زمان، زمان در گروه و گروه برای این شاخصها معنیدار نبود. دررابطهبا شاخصهای عملکردی نشان داده شد برای متغیر استقامت عضلانی، بین گروه کنترل با هر دو گروه تمرینی، تفاوت معنیداری وجود داشت، همچنین در گروه کنترل قبل از تمرین نسبت به بعد از تمرین تفاوت معنیداری وجود داشت. اثر زمان در گروه برای این متغیر (F=29/15 و P=0/001) معنیدار بود. برای متغیر قدرت عضلانی نیز اثر متفابل زمان در گروه (F=14/3 و P=0/001) معنیدار بود و فقط بین گروه کنترل با BW تفاوت معنیداری مشاهده شد.

بحث
یافتههای پژوهش حاضر نشان داد که 8 هفته تمرین راه رفتن به جلو و عقب سبب بهبود معنیدار قدرت و استقامت عضلانی در گروه راه رفتن به عقب شد، اما تغییر معنیداری در سطوح TNF-α، TGF-β و VDBP در هیچیک از گروهها ایجاد نکرد. در مطالعه حاضر برنامه تمرین راه رفتن به جلو اثر معنیداری بر قدرت عضلانی نداشت و تنها راه رفتن به عقب باعث افزایش معنیدار قدرت عضلانی شد. همراستا با تحقیق حاضر، در مطالعهای که فخاریان و همکاران بر روی 30 دختر 15 تا 16 ساله که در دو گروه راه رفتن و دویدن به جلو و عقب بهمدت 6 هفته، 3 بار در هفته و جلسهای 15 دقیقه با سرعت دلخواه انجام دادند و قدرت را با استفاده از آزمون مدتزمان طیشده بهصورت لیلی در مسافت 6 متری آزمودند، افزایش قدرت تقریباً 10 درصد در گروه فعالیت رو به جلو و 20 درصد در فعالیت رو به عقب بعد از 6 هفته تمرین مشاهده کردند [30]. دلیل درصد تغییرات بیشتر قدرت در مطالعه حاضر نسبت به این مطالعه بهجز تفاوت در گروه های سنی آزمودنیها، میتواند میزان شدت تمرین مورد استفادهشده در مطالعه حاضر در مقایسه با سرعت دلخواه تمرین در مطالعه فخاریان و همکاران [30] باشد.
کاچاناتو و همکاران [31] نیز در تحقیقی که بر روی 30 مرد و 10 زن، 25 ساله انجام دادند، مشاهده کردندکه قدرت عضلات پلانتار فلکسورهای مچ و چهارسر در گروه راه رفتن به عقب در مقایسه با راه رفتن به جلو افزایش معنیداری داشت، اما قدرت عضلات همسترینگ در هر دو گروه تغییر معنیداری نداشت [31]. براساس این مطالعه و تحقیقات ویلنسکی و همکاران [32] یک دلیل افزایش قدرت عضلات با تمرین راه رفتن به عقب این است که عملکرد عضلات حین راه رفتن به جلو و راه رفتن به عقب متفاوت است. راه رفتن به عقب نیاز به فعالیت ایزومتریک و کانسنتریک گروه عضلات چهارسررانی و پلانتار فلکسورهای مچ پا دارد، فعالیت این عضلات درست بهعنوان کاهنده سرعت عمل میکند و بهصورت عمده عمل اکسنتریک دارند اما در راه رفتن به عقب عضلات چهار سر در ابتدا بهصورت ایزومتریک برای تثبیت زانو و بعد بهصورت کانسنتریک عمل میکنند. مطالعات نشان داده است که کار مثبت همراه با انقباضات کانسنتریک همیشه ارزش بیشتری از کار منفی همراه با انقباضات اکسنتریک دارد [31]. بنابراین مقدار افزایش فعالیت عضلانی کانسنتریک همراه با راه رفتن به عقب ممکن است تا حدی افزایش مشاهدهشده در هزینه سوختوساز را توضیح دهد. دلایل متعددی برای بهبود قدرت عضلانی وجود دارد، اسچوان و همکاران [33] نشان دادند یک کار حرکتی نسبتاً جدید بهکارگیری واحدهای حرکتی را افزایش میدهد و بنابراین باعث افزایش هزینه متابولیک فعالیت میشود و میتواند توجیهی برای افزایش قدرت عضلانی در گروه راه رفتن به عقب باشد [33].
در مطالعه حاضر هر دو نوع برنامه تمرین راه رفتن به جلو و راه رفتن به عقب نسبت به گروه کنترل باعث افزایش معنیدار عملکرد استقامتی شد، بهطوریکه عملکرد استقامتی در گروه راه رفتن به عقب نسبت به گروه راه رفتن به جلو افزایش بیشتری داشت. نتایج تحقیقات فلاین و سواتاس لیتل [34]، فخاریان و همکاران [30]، تربلانچ و همکاران [35]، چیلدز و همکاران [36]، وو و همکاران [37] و حسینی و همکاران [38] با نتایج مطالعه حاضر همخوانی داشت.
چیلدز و همکاران [36] بعد از بررسی تمرین راه رفتن به عقب با سرعت 60 درصد حداکثر اکسیژن مصرفی بر روی 7 مرد و زن 23 تا 49 ساله که بهمدت 6 هفته، به این نتیجه رسیدند که راه رفتن به عقب باعث کاهش هزینه متابولیکی و افزایش کارایی در آنها شد و این افزایش را ناشی از افزایش کارایی از واحدهای حرکتی باتوجهبه نوع تمرین دانستند [36]، به نظر میرسد افزایش عملکرد استقامتی مطالعه حاضر نیز ناشی از همین عامل باشد. ازآنجاکه تمرینات راه رفتن به عقب جدیدتر و ناآشناتر از تمرینات راه رفتن رو به جلو محسوب میشود، بنابراین راه رفتن به عقب مستلزم دقت و توجه بیشتری در حرکات است و درنتیجه ممکن است باعث بهبود عملکرد (استقامتی) شود [39].
در مطالعه حاضر هر دو نوع برنامه تمرین راه رفتن به جلو و راه رفتن به عقب نسبت به گروه کنترل تغییر معنیداری در سطوح TNF-α ایجاد نکرد. این یافتهها با یافتههای برخی تحقیقات انجامشده همسو میباشد. وایندسر و همکاران نشان دادند که یک جلسه تمرین دوچرخهسواری تداومی با شدت متوسط و اینتروال با شدت بالا، تغییر معنیداری در پاسخ سایتوکاینها در افراد مسن ایجاد نکرد و این پاسخها درسالمندان با سطوح بالا یا پایین آمادگی قلبی ریوی یکسان بود [40].
تحقیقات بهطورکلی نشان دادهاند فعالیت بدنی سبب کاهش سطح سایتوکینهای پیشالتهابی میشود [41، 42]. ناهمسو با تحقیق حاضر، کراب و همکاران [43] در تحقیق خود نشان دادند، افزایش نیم ساعت فعالیت ورزشی در هفته میتواند سطح TNF-α را در زنان سالمند کاهش دهد[43]. درخصوص مکانیسم عملکرد تمرین در تغییر عوامل التهابی ازجمله TNF-α موارد متعددی بیان شده است. تحقیقات مختلف نشان دادهاند با افزایش سن، بافت چربی شکمی افزایش و بافت عضلانی بدن کاهش مییابد [43]. به نظر میرسد انجام تمرین در سالمندان موجب بهکارگیری بیشتر عضلات برای انجام فعالیت میشود. ازآنجاکه تمرینات مقاومتی و استقامتی باعث افزایش اکسیداسیون چربی میشود، میتواند باعث کاهش سایتوکاینهای پیشالتهابی [44] و افزایش سایتوکینهای ضدالتهابی گردد [45، 46]. مکماهون و همکاران [47] بیان کردند که بعد از 12 هفته تمرین قدرتی در افراد مسن، سطوح پایه گیرنده TNF-α با افزایش قدرت عضله ارتباط معکوس و معنیداری دارد [47].
تحقیقات مختلف نشان دادهاند میزان TNF-α بهطور معکوسی با میزان سنتز پروتئین عضله در ارتباط است. TNF-α سبب کاهش سنتز پروتئین میشود. همچنین محتوای TNF-α بهطور معکوسی با محتوای LPL عضله در ارتباط است. تمرین بهویژه تمرین مقاومتی، از طریق تحریک اثرات مهاری TNF-α بر بیان LPL و سنتز پروتئین ممکن است به سنتز پروتئین جدید منجر شود و یک منبع ترجیحی انرژی (اسیدهای چرب آزاد ناشی از عمل LPL) را برای حمایت از سنتز پروتئین فراهم کند [48، 49].
نشان داده شده است TNF-α و TGF-β1 بر یکدیگر اثر متقابل دارند و افزایش بیان TNF-α از طریق افزایش بیان ژنی پروتئاز فورین [50] موجب افزایش سنتز TGF-β1 در بافت چربی میشود [51]. در پژوهش حاضر، سطوح TGF-β1 پس از 8 هفته تمرین راه رفتن به جلو و عقب تغییر معنیداری نکرد. با بررسی انجامشده تا این لحظه، دررابطهبا اثر تمرین بر سطوح TGF-β1 در افراد سالمند، تحقیقات اندکی انجام شده است [52-55]. در پژوهش حاضر، ممکن است عدم تغییر TNF-α در پاسخ به تمرین موجب عدم تغییر معنیدار TGF- β1 شده باشد. تحقیقات نشان دادهاند فورین یکی از عواملی است که به واسطه TNF-α قادر است سطوح پلاسمایی و بیان TGF-β1 را تنظیم کند، هرچند در تحقیق حاضر این شاخص اندازهگیری نشد [56]. دادههای ما با یافتههای قبلی که نشان دادند تمرینات قدرتی سطح TGF-β را تغییر نمیدهد، مطابقت دارد [55]. هالپر و همکاران [52] نیز نشان دادند سطوح TGF-β و همچنین بیان ژن TGF-β، تحت تأثیر تمرین مقاومتی با کش قرار نگرفت [52].
مطالعه دیگری که به بررسی تأثیر یک دوره تمرین ترکیبی در بیماران 55 ساله دیابتی نوع 2 پرداخته است، نشان داد سطوح TGF-β در اثر تمرین افزایش یافت [57]. رجبی و همکاران [53] نیز نشان دادند 8 هفته تمرین مقاومتی با تراباند در زنان سالمند، سبب کاهش معنیدار سطوح TGF-β شد [53]، اما بهدلیل اینکه جمعیت موردمطالعه و برنامه تمرینی در این تحقیقات متفاوت است، امکان مقایسه مستقیم را دشوار میسازد. هاینمر و همکاران [58]، نشان دادند 1 ساعت دویدن بر روی تردمیل غلظت پلاسمایی TGF-β را افزایش میدهد [58]. این افزایش در سطوح TGF-β در پاسخ به تمرین میتواند به چندین دلیل باشد. تمرین طولانیمدت، محتوا و فعالیت پلاکت ها را افزایش میدهد [59] و این افزایش در سطوح TGF-β در پاسخ به تمرین طولانیمدت، ممکن است بهدلیل ترشح TGF-β از پلاکتها باشد [59]. همچنین آنها بیان کردند TGF-β در سلولهای مختلفی بیان میشود [60] و مطالعات مختلفی یک ارتباط قوی و معنیدار را بین میزان فشار و بار مکانیکی اعمالشده در اثر تمرین و سنتز TGF-β در سلولهای مختلف نشان دادهاند. احتمالاً بافتهایی که در حین تمرین، فشار مکانیکی بر آنها اعمال میشود، ازجمله استخوان، عضله، تاندون، قلب و بافتهای عروقی ممکن است سبب افزایش سنتز TGF-β در پاسخ به تمرین شوند و درنتیجه سطوح گردش خونی TGF-β افزایش یابد. صرفنظر از علت، اینکه تمرین موجب افزایش سیستمیک TGF-b میشود، یک یافته جالب است، زیرا نشان داده شده است TGF-β موجب سرکوب عملکرد ایمنی میشود، بنابراین میتواند به دوره موقت کاهش عملکرد سلولهای ایمنی بدن که پس از یک جلسه تمرین طولانیمدت رخ میدهد، نسبت داده شود [61].
بهخوبی نشان داده شده است تمرینات ورزشی منظم سبب کاهش التهاب مزمن ناشی از پیری و عدم فعالیت بدنی میشود [62، 63]. به نظر میرسد بافت چربی نقش مهمی در این سناریو ایفا میکند، زیرا منبع اصلی هورمونها و سیتوکینهای متعدد است [64]. بهویژه، ذخایر چربی احشایی و ماکروفاژها که سیتوکینهای پیش و ضدالتهابی مانند TNF-α و TGF-β را آزاد میکنند [65]. افزایش در هزینههای انرژی ناشی از فعالیت بدنی، درصد چربی بدن را کاهش میدهد و درنتیجه ظرفیت تولید و ترشح فاکتورهای ضدالتهابی را تحت تأثیر قرار میدهد [65].
در تحقیق حاضر تغییری در میزان VDBP مشاهده نشد که این نتایج تقریباً ناهمسو با نتایج واشبیش و همکاران [66] بود که بیان کردند ارتباط مثبت و معنیداری بین سطح آمادگی بدنی و سطوح سرمی ویتامین D وجود دارد [66]. البته در این تحقیق تمرین ورزشی داده نشد و سطح ویتامین D برآورد شده است نه VDBP، لیکن ظاهراً تنها تحقیقی است که تاکنون درخصوص این شاخص انجام شده است. از طرفی مطالعه زو و همکاران که بر روی بافت کولون موشهای مبتلابه بیماری التهابی روده انجام شد نشان داد 1و 25 هیدروکسی ویتامین D قادر به تنظیم کاهشی چندین ژن مرتبط با TNF-α میباشد [67]. مطالعات انسانی نیز دررابطهبا مکملدهی ویتامین D برای یک دوره 6 ماهه در زنان مبتلابه پوکی استخوان در مرحله پس از یائسگی به کاهش قابلملاحظه در غلظت TNF-α منجر شد [68]. شاید بتوان گفت عدم تغییر VDBP یکی از دلایل عدم تغییر در شاخصهای التهابی باشد.
نتبجهگیری نهایی
سالمندی خوب و موفق احتمالاً بدون تمرین اتفاق نخواهد افتاد. تحقیقات نشان میدهند TNF-a توسط میوسیتهای انسانی رونویسی میشوند و در عضلات سالمندان افزایش مییابند و تمرین بدنی سبب کاهش سطوح آنها میگردد. بنابراین ممکن است تمرین بدنی از طریق تغییر غلظتهای بالقوه سیتوکین مضر در عضلات اسکلتی، روند سالمندی را بهبود دهد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق پژوهش پژوهشگاه تربیت بدنی و علوم ورزشی با کد اخلاق IR.SSRC.REC.1398.022 تصویب شده است. مشارکتکنندگان فرم رضایت آگاهانه مکتوب را قبل از شروع مطالعه تکمیل کردند. قبل از آن توضیحات شفاهی لازم درباره اهداف مطالعه به مشارککنندگان ارائه و به آنها اطمینان داده شد که بهصورت ناشناس و بینام در مطالعه شرکت خواهند کرد.
حامی مالی
این پژوهش از طرف دانشگاه کوثر بجنورد با شماره قرارداد NO.0111081950 حمایت شده است.
مشارکت نویسندگان
مفهومسازی، روششناسی، گردآوری دادهها و نگارش مقاله: میترا خادم الشریعه و اعظم ملانوروزی؛ تجزیهوتحلیل دادهها: مرضیه السادات آذرنیوه و ایوب سعیدی؛ ادیت مقاله و نظارت: میترا خادم الشریعه.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از همه سالمندان شرکتکننده در مطالعه، پرسنل مراکز جامع خدمات سلامت و معاونت تحقیقات و فناوری دانشگاه کوثر بجنورد تشکر و قدردانی میکنند.
References
- Negm AM, Lee J, Hamidian R, Jones CA, Khadaroo RG. Management of sarcopenia: A network meta-analysis of randomized controlled trials. Journal of the American Medical Directors Association. 2022; 23(5):707-14. [DOI:10.1016/j.jamda.2022.01.057] [PMID]
- Rana MN, Neeland IJ. Adipose tissue inflammation and cardiovascular disease: An update. Current Diabetes Reports. 2022; 22(1):27-37. [DOI:10.1007/s11892-021-01446-9] [PMID]
- Su J, Li Z, Huang M, Wang Y, Yang T, Ma M, et al. Triglyceride glucose index for the detection of the severity of coronary artery disease in different glucose metabolic states in patients with coronary heart disease: A RCSCD-TCM study in China. Cardiovascular Diabetology. 2022; 21(1):96. [DOI:10.1186/s12933-022-01523-7] [PMID]
- Lage VKDS, de Paula FA, Lima LP, Santos JNV, Dos Santos JM, Viegas ÂA, et al. Plasma levels of myokines and inflammatory markers are related with functional and respiratory performance in older adults with COPD and sarcopenia. Experimental Gerontology. 2022; 164:111834. [DOI:10.1016/j.exger.2022.111834] [PMID]
- Dziedzic EA, Gąsior JS, Tuzimek A, Paleczny J, Junka A, Dąbrowski M, et al. Investigation of the associations of novel inflammatory biomarkers-Systemic Inflammatory Index (SII) and Systemic Inflammatory Response Index (SIRI)-with the severity of Coronary Artery disease and Acute Coronary syndrome occurrence. International Journal of Molecular Sciences. 2022; 23(17):9553. [DOI:10.3390/ijms23179553] [PMID]
- Gok M, Kurtul A. A novel marker for predicting severity of acute pulmonary embolism: Systemic Immune-Inflammation Index. Scandinavian Cardiovascular Journal: SCJ. 2021; 55(2):91-6. [DOI:10.1080/14017431.2020.1846774] [PMID]
- Tzavlaki K, Moustakas A. TGF-β Signaling. Biomolecules. 2020; 10(3):487. [DOI:10.3390/biom10030487] [PMID]
- Silva Neto LS, Karnikowiski MG, Tavares AB, Lima RM. Association between sarcopenia, sarcopenic obesity, muscle strength and quality of life variables in elderly women. Revista brasileira de fisioterapia (Sao Carlos (Sao Paulo, Brazil)). 2012; 16:360-7. [DOI:10.1590/S1413-35552012005000044] [PMID]
- Chagas CS, Ohara DG, Matos AP, Oliveira MSR, Lopes MGR, Marmo FAD, Pinto ACPN, et al. Association between sarcopenia and health-related quality of life in community-dwelling older adults. Acta Paul Enferm. 2021; 34:eAPE002125. [DOI:10.37689/acta-ape/2021AO002125]
- Montenegro KR, Cruzat V, Carlessi R, Newsholme P. Mechanisms of vitamin D action in skeletal muscle. Nutrition Research Reviews. 2019; 32(2):192-204. [DOI:10.1017/S0954422419000064] [PMID]
- Chang SW, Lee HC. Vitamin D and health-The missing vitamin in humans. Pediatrics and Neonatology. 2019; 60(3):237-44. [DOI:10.1016/j.pedneo.2019.04.007] [PMID]
- Maula A, LaFond N, Orton E, Iliffe S, Audsley S, Vedhara K, et al. Use it or lose it: A qualitative study of the maintenance of physical activity in older adults. BMC Geriatrics. 2019; 19(1):349. [DOI:10.1186/s12877-019-1366-x] [PMID]
- He D, Sun G, De Vos J, Webster C. The effects of metro interventions on physical activity and walking among older adults: A natural experiment in Hong Kong. Health & Place. 2022; 78:102939. [DOI:10.1016/j.healthplace.2022.102939] [PMID]
- Park WY. The effects of 12-weeks complex training using swiss ball and elastic band on senior fitness and sarcopenia index in elderly women. Journal of the Korean Applied Science and Technology. 2020; 37(6):1465-74. [DOI:10.12925/jkocs.2020.37.6.1465]
- Kelly P, Murphy M, Mutrie N. The health benefits of walking. Leeds: Emerald Publishing Limited; 2017. [DOI:10.1108/S2044-994120170000009004]
- Elnahhas AM, Elshennawy S, Aly MG. Effects of backward gait training on balance, gross motor function, and gait in children with cerebral palsy: A systematic review. Clinical Rehabilitation. 2019; 33(1):3-12. [DOI:10.1177/0269215518790053] [PMID]
- Wang J, Xu J, An R. Effectiveness of backward walking training on balance performance: A systematic review and meta-analysis. Gait & Posture. 2019; 68:466-75. [DOI:10.1016/j.gaitpost.2019.01.002] [PMID]
- Toots A, Domellöf ME, Lundin-Olsson L, Gustafson Y, Rosendahl E. Backward relative to forward walking speed and falls in older adults with dementia. Gait & Posture. 2022; 96:60-6. [DOI:10.1016/j.gaitpost.2022.05.013] [PMID]
- Scartoni FR, Sant'Ana LO, Murillo-Rodriguez E, Yamamoto T, Imperatori C, Budde H, et al. Physical exercise and immune system in the elderly: Implications and importance in COVID-19 pandemic period. Frontiers in Psychology. 2020; 11:593903. [DOI:10.3389/fpsyg.2020.593903] [PMID]
- Choiriah AN, Irhamna NA, Dewanto D, Amalia R. The effect of physical exercise on the quality of life of the elderly: Systematic review. Muhammadiyah Journal of Epidemiology. 2021; 1(1):43-54. [link]
- Liu W, Wang X, O’Connor M, Wang G, Han F. Brain-derived neurotrophic factor and its potential therapeutic role in stroke comorbidities. Neural Plasticity. 2020; 2020:1969482. [DOI:10.1155/2020/1969482] [PMID]
- Jiang Y, Wei N, Lu T, Zhu J, Xu G, Liu X. Intranasal brain-derived neurotrophic factor protects brain from ischemic insult via modulating local inflammation in rats. Neuroscience. 2011; 172:398-405. [DOI:10.1016/j.neuroscience.2010.10.054] [PMID]
- Chen J, Gingold JA, Su X. Immunomodulatory TGF-β signaling in hepatocellular carcinoma. Trends in Molecular Medicine. 2019; 25(11):1010-23. [DOI:10.1016/j.molmed.2019.06.007] [PMID]
- Yosaee S, Soltani S, Esteghamati A, Motevalian SA, Tehrani-Doost M, Clark CCT, et al. Effects of zinc, vitamin D, and their co-supplementation on mood, serum cortisol, and brain-derived neurotrophic factor in patients with obesity and mild to moderate depressive symptoms: A phase II, 12-wk, 2×2 factorial design, double-blind, randomized, placebo-controlled trial. Nutrition (Burbank, Los Angeles County, Calif.). 2020; 71:110601. [DOI:10.1016/j.nut.2019.110601] [PMID]
- Grant S, Aitchison T, Henderson E, Christie J, Zare S, McMurray J, et al. A comparison of the reproducibility and the sensitivity to change of visual analogue scales, Borg scales, and Likert scales in normal subjects during submaximal exercise. Chest. 1999; 116(5):1208-17. [DOI:10.1378/chest.116.5.1208] [PMID]
- Yusof NA, Jamil PA, Hashim NM, Karuppiah K, Rasdi I, Tamrin SB, et al. Likert Scale vs. visual analogue scale on Vehicle Seat Discomfort Questionnaire: A review. Malaysian Journal of Medicine and Health Sciences. 2019; 15(SP4):159-64. [Link]
- Jackson AS, Pollock ML, Ward A. Generalized equations for predicting body density of women. Medicine and Science in Sports and Exercise. 1980; 12(3):175-81. [DOI:10.1249/00005768-198023000-00009] [PMID]
- Jones CJ, Rikli RE. Measuring functional: Fitness in older adults. The Journal on Active Aging. 2002; 24-30. [Link]
- Różańska-Kirschke A, Kocur P, Wilk M, Dylewicz P. The Fullerton Fitness Test as an index of fitness in the elderly. Medical Rehabilitation. 2006; 10(2):9-16. [Link]
- Fakharian Z, Ebrahimi E, Shaterzadeh M J, Salavati M. [Comparative study of forward walking and running with backward walking and running on lower limbs function (Persian)]. Feyz. 2000; 4(2) :1-10. [Link]
- Kachanathu SJ, Hafez AR, Zakaria AR. Efficacy of backward versus forward walking on hamstring strain rehabilitation. International Journal of Therapies and Rehabilitation Research. 2013; 2(1):8-14. [DOI:10.5455/ijtrr.00000017]
- Vilensky JA, Cook JA. Do quadrupeds require a change in trunk posture to walk backward? Journal of Biomechanics. 2000; 33(8):911-6. [DOI:10.1016/S0021-9290(00)00071-3]
- Schwane JA, Johnson SR, Vandenakker CB, Armstrong RB. Delayed-onset muscular soreness and plasma CPK and LDH activities after downhill running. Medicine and Science in Sports and Exercise. 1983; 15(1):51-6. [DOI:10.1249/00005768-198315010-00010] [PMID]
- Flynn TW, Soutas-Little RW. Patellofemoral joint compressive forces in forward and backward running. Journal of Orthopaedic & Sports Physical Therapy, 1995; 21(5):277-82. [DOI:10.2519/jospt.1995.21.5.277]
- Terblanche E, Cloete WA, du Plessis PA, Sadie JN, Strauss A, Unger M. The metabolic transition speed between backward walking and running. European Journal of Applied Physiology. 2003; 90, 520-5. [Link]
- Childs JD, Gantt C, Higgins D, Papazis JA, Franklin R, Metzler T, et al. The effect of repeated bouts of backward walking on physiologic efficiency. The Journal of Strength & Conditioning Research. 2002; 16(3):451-5. [DOI:10.1519/1533-4287(2002)0162.0.CO;2]
- Woo TY, Tseng HY, Liu BS. Evaluating the difference of physiological load between forward and backward exercise. Asia Pacific Industrial Engineering & Management Society. 2009; 464-72. [Link]
- Najjarian Kakhki A, Hosseini Kakhak SA, Khajeei R, Vakilian Aghouee F. [The comparison of the effect of strength training, strength training-forward walking/running and strength training-backward walking/running on body composition and functional fitness of middle age men (Persian)]. Journal of Sports and Biomotor Sciences. 2022; 14(27):82-91. [DOI:10.22034/SBS.2022.162732]
- Ebrahimi Takamjani E, Taghipoor M, Salavati M, Shaterzadeh M, Farahini H. [Comparison of forward and backward running on the static balance (Persian)]. Razi Journal of Medical Sciences. 2004; 10(37):677-84. [Link]
- Windsor MT, Bailey TG, Perissiou M, Meital L, Golledge J, Russell FD, et al. Cytokine responses to acute exercise in healthy older adults: The effect of cardiorespiratory fitness. Frontiers in Physiology. 2018; 9:203. [DOI:10.3389/fphys.2018.00203] [PMID]
- Kohut M, McCann D, Russell D, Konopka D, Cunnick J, Franke W, et al. Aerobic exercise, but not flexibility/resistance exercise, reduces serum IL-18, CRP, and IL-6 independent of β-blockers, BMI, and psychosocial factors in older adults. Brain, Behavior, and Immunity. 2006; 20(3):201-9. [DOI:10.1016/j.bbi.2005.12.002] [PMID]
- Huntula S, Lalert L, Punsawad C. The Effects of exercise on aging-induced exaggerated cytokine responses: An interdisciplinary discussion. Scientifica. 2022; 2022:3619362. [DOI:10.1155/2022/3619362] [PMID]
- Krabbe KS, Pedersen M, Bruunsgaard H. Inflammatory mediators in the elderly. Experimental Gerontology. 2004; 39(5):687-99. [DOI:10.1016/j.exger.2004.01.009] [PMID]
- Nicklas BJ, You T, Pahor M. Behavioural treatments for chronic systemic inflammation: Effects of dietary weight loss and exercise training. CMAJ: Canadian Medical Association Journal = Journal de l'Association medicale canadienne. 2005; 172(9):1199-209. [DOI:10.1503/cmaj.1040769] [PMID]
- Flack KD, Davy KP, Hulver MW, Winett RA, Frisard MI, Davy BM. Aging, resistance training, and diabetes prevention. Journal of Aging Research. 2011; 2011:127315. [DOI:10.4061/2011/127315] [PMID]
- Fragala MS, Cadore EL, Dorgo S, Izquierdo M, Kraemer WJ, Peterson MD, et al. Resistance training for older adults: Position statement from the national strength and conditioning association. The Journal of Strength & Conditioning Research. 2019; 33(8):2019-52. [DOI:10.1519/JSC.0000000000003230] [PMID]
- McMahon G, Morse CI, Winwood K, Burden A, Onambélé GL. Circulating tumor necrosis factor alpha may modulate the short-term detraining induced muscle mass loss following prolonged resistance training. Frontiers in Physiology. 2019; 10:527. [DOI:10.3389/fphys.2019.00527] [PMID]
- Frost RA, Lang CH, Gelato MC. Transient exposure of human myoblasts to tumor necrosis factor-alpha inhibits serum and insulin-like growth factor-I stimulated protein synthesis. Endocrinology. 1997; 138(10):4153-9. [DOI:10.1210/endo.138.10.5450] [PMID]
- Khalafi M, Malandish A, Rosenkranz SK. The impact of exercise training on inflammatory markers in postmenopausal women: A systemic review and meta-analysis. Experimental Gerontology. 2021; 150:111398. [DOI:10.1016/j.exger.2021.111398] [PMID]
- Dubois CM, Laprise M-H, Blanchette F, Gentry LE, Leduc R. Processing of transforming growth factor β1 precursor by human furin convertase. The Journal of Biological Chemistry. 1995; 270(18):10618-24. [DOI:10.1074/jbc.270.18.10618] [PMID]
- Enomoto T, Ohashi K, Shibata R, Higuchi A, Maruyama S, Izumiya Y, et al. Adipolin/C1qdc2/CTRP12 protein functions as an adipokine that improves glucose metabolism. The Journal of Biological Chemistry. 2011; 286(40):34552-8. [DOI:10.1074/jbc.M111.277319] [PMID]
- Schober-Halper B, Hofmann M, Oesen S, Franzke B, Wolf T, Strasser EM, et al. Elastic band resistance training influences transforming growth factor-ß receptor I mRNA expression in peripheral mononuclear cells of institutionalised older adults: The Vienna Active Ageing Study (VAAS). Immunity & Ageing: I & A. 2016; 13:22. [DOI:10.1186/s12979-016-0077-9] [PMID]
- Rajabi P, Isanejad A, Samadi A, Amini H. The effect of resistance training with theraband on the transforming growth factor-β in the elderly women. Immunoregulation. 2019; 1(2):81-6. [DOI:10.32598/IMMUNOREGULATION.1.2.75]
- Marshall RN, Morgan PT, Smeuninx B, Quinlan JI, Brook MS, Atherton PJ, et al. Myofibrillar protein synthesis and acute intracellular signaling with elastic band resistance exercise in young and older men. Medicine & Science in Sports & Exercise. 2023; 55(3):398-408. [DOI:10.1249/MSS.0000000000003061] [PMID]
- Bautmans I, Njemini R, Vasseur S, Chabert H, Moens L, Demanet C, et al. Biochemical changes in response to intensive resistance exercise training in the elderly. Gerontology. 2005; 51(4):253-65. [DOI:10.1159/000085122] [PMID]
- Cigolini M, Tonoli M, Borgato L, Frigotto L, Manzato F, Zeminian S, et al. Expression of plasminogen activator inhibitor-1 in human adipose tissue: A role for TNF-α? Atherosclerosis. 1999; 143(1):81-90. [DOI:10.1016/S0021-9150(98)00281-0] [PMID]
- Touvra AM, Volaklis KA, Spassis AT, Zois CE, Douda HT, Kotsa K, et al. Combined strength and aerobic training increases transforming growth factor-β1 in patients with type 2 diabetes. Hormones (Athens, Greece). 2011; 10(2):125-30. [DOI:10.14310/horm.2002.1302] [PMID]
- Heinemeier K, Langberg H, Olesen JL, Kjaer M. Role of TGF-β1 in relation to exercise-induced type I collagen synthesis in human tendinous tissue. Journal of Applied Physiology (Bethesda, Md.: 1985). 2003; 95(6):2390-7. [DOI:10.1152/japplphysiol.00403.2003] [PMID]
- Skouras AZ, Antonakis-Karamintzas D, Tsantes AG, Triantafyllou A, Papagiannis G, Tsolakis C, et al. The acute and chronic effects of resistance and aerobic exercise in hemostatic balance: A brief review. Sports (Basel, Switzerland). 2023; 11(4):74. [DOI:10.3390/sports11040074] [PMID]
- Bonewald LF. Regulation and regulatory activities of transforming growth factor β. Critical Reviews in Eukaryotic Gene Expression. 1999; 9(1):33–44. [DOI:10.1615/CritRevEukaryotGeneExpr.v9.i1.30] [PMID]
- Cillo JE Jr, Gassner R, Koepsel RR, Buckley MJ. Growth factor and cytokine gene expression in mechanically strained human osteoblast-like cells: Implications for distraction osteogenesis. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 2000; 90(2):147-54. [DOI:10.1067/moe.2000.107531] [PMID]
- Jahromi AS, Zar A, Ahmadi F, Krustrup P, Ebrahim K, Hovanloo F, Amani D. Effects of Endurance Training on the Serum Levels of Tumour Necrosis Factor-α and Interferon-γ in Sedentary Men. Immune Network. 2014; 14(5):255-9. [PMID]
- Wang CH, Chung MH, Chan P, Tsai JC, Chen FC. Effects of endurance exercise training on risk components for Metabolic syndrome, interleukin-6, and the exercise capacity of postmenopausal women. Geriatric Nursing (New York, N.Y.). 2014; 35(3):212-8. [DOI:10.1016/j.gerinurse.2014.02.001] [PMID]
- Czarkowska-Paczek B, Zendzian-Piotrowska M, Bartlomiejczyk I, Przybylski J, Gorski J. The influence of physical exercise on the generation of TGF-β1, PDGF-AA, and VEGF-A in adipose tissue. European Journal of Applied Physiology. 2011; 111(5):875-81. [DOI:10.1007/s00421-010-1693-2] [PMID]
- Sallam N, Laher I. Exercise modulates oxidative stress and inflammation in aging and cardiovascular diseases. Oxidative Medicine and Cellular Longevity. 2016; 2016:7239639. [DOI:10.1155/2016/7239639] [PMID]
- Waschbisch A, Wenny I, Tallner A, Schwab S, Pfeifer K, Mäurer M. Physical activity in multiple sclerosis: A comparative study of vitamin D, brain-derived neurotrophic factor and regulatory T cell populations. European Neurology. 2012; 68(2):122-8. [DOI:10.1159/000337904] [PMID]
- Zhu Y, Mahon BD, Froicu M, Cantorna MT. Calcium and 1α, 25‐dihydroxyvitamin D3 target the TNF-alpha pathway to suppress experimental inflammatory bowel disease. European Journal of Immunology. 2005; 35(1):217-24. [DOI:10.1002/eji.200425491] [PMID]
- Inanir A, Ozoran K, Tutkak H, Mermerci B. The effects of calcitriol therapy on serum interleukin-1, interleukin-6 and tumour necrosis factor-α concentrations in post-menopausal patients with osteoporosis. Journal of International Medical Research. 2004; 32(6):570-82. [DOI:10.1177/147323000403200602] [PMID]
نوع مطالعه: پژوهشي |
موضوع مقاله:
طب سالمندی
دریافت: 1402/2/4 | پذیرش: 1402/5/10 | انتشار: 1403/4/11
دریافت: 1402/2/4 | پذیرش: 1402/5/10 | انتشار: 1403/4/11
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








