دوره 20، شماره 4 - ( زمستان 1404 )
جلد 20 شماره 4 صفحات 499-480 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fasihiyan M, Morais J A, Goli A, Taheri M, Asadi Y, Nourshahi M. Different Exercises for Prevention and Treatment of Brain Disorders in Older Adults: A Review Study. Salmand: Iranian Journal of Ageing 2026; 20 (4) :480-499
URL: http://salmandj.uswr.ac.ir/article-1-2936-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-2936-fa.html
فصیحیان معین، موراییس ژوزه آ، گلی علیرضا، طاهری مریم، اسدی یاسمین، نورشاهی مریم. ورزش بهعنوان یک استراتژی برای پیری مغز: بینشهای پیشگیری و درمان. سالمند: مجله سالمندی ایران. 1404; 20 (4) :480-499
معین فصیحیان1 

 ، ژوزه آ موراییس2
، ژوزه آ موراییس2 

 ، علیرضا گلی1
، علیرضا گلی1 

 ، مریم طاهری1
، مریم طاهری1 

 ، یاسمین اسدی1
، یاسمین اسدی1 

 ، مریم نورشاهی*3
، مریم نورشاهی*3 




 ، ژوزه آ موراییس2
، ژوزه آ موراییس2 

 ، علیرضا گلی1
، علیرضا گلی1 

 ، مریم طاهری1
، مریم طاهری1 

 ، یاسمین اسدی1
، یاسمین اسدی1 

 ، مریم نورشاهی*3
، مریم نورشاهی*3 


1- گروه علوم زیستی در ورزش، دانشکده علوم ورزشی و تندرستی، دانشگاه شهید بهشتی، تهران، ایران.
2- گروه حرکت شناسی و تربیت بدنی، دانشگاه مک گیل، مونترال، کبک، کانادا.
3- گروه علوم زیستی در ورزش، دانشکده علوم ورزشی و تندرستی، دانشگاه شهید بهشتی، تهران، ایران. ،m_nourshahi@yahoo.com
2- گروه حرکت شناسی و تربیت بدنی، دانشگاه مک گیل، مونترال، کبک، کانادا.
3- گروه علوم زیستی در ورزش، دانشکده علوم ورزشی و تندرستی، دانشگاه شهید بهشتی، تهران، ایران. ،
متن کامل [PDF 9597 kb]
(1350 دریافت)
| چکیده (HTML) (3007 مشاهده)
تغییرات ساختاری و عملکردی مغز در دوران سالمندی
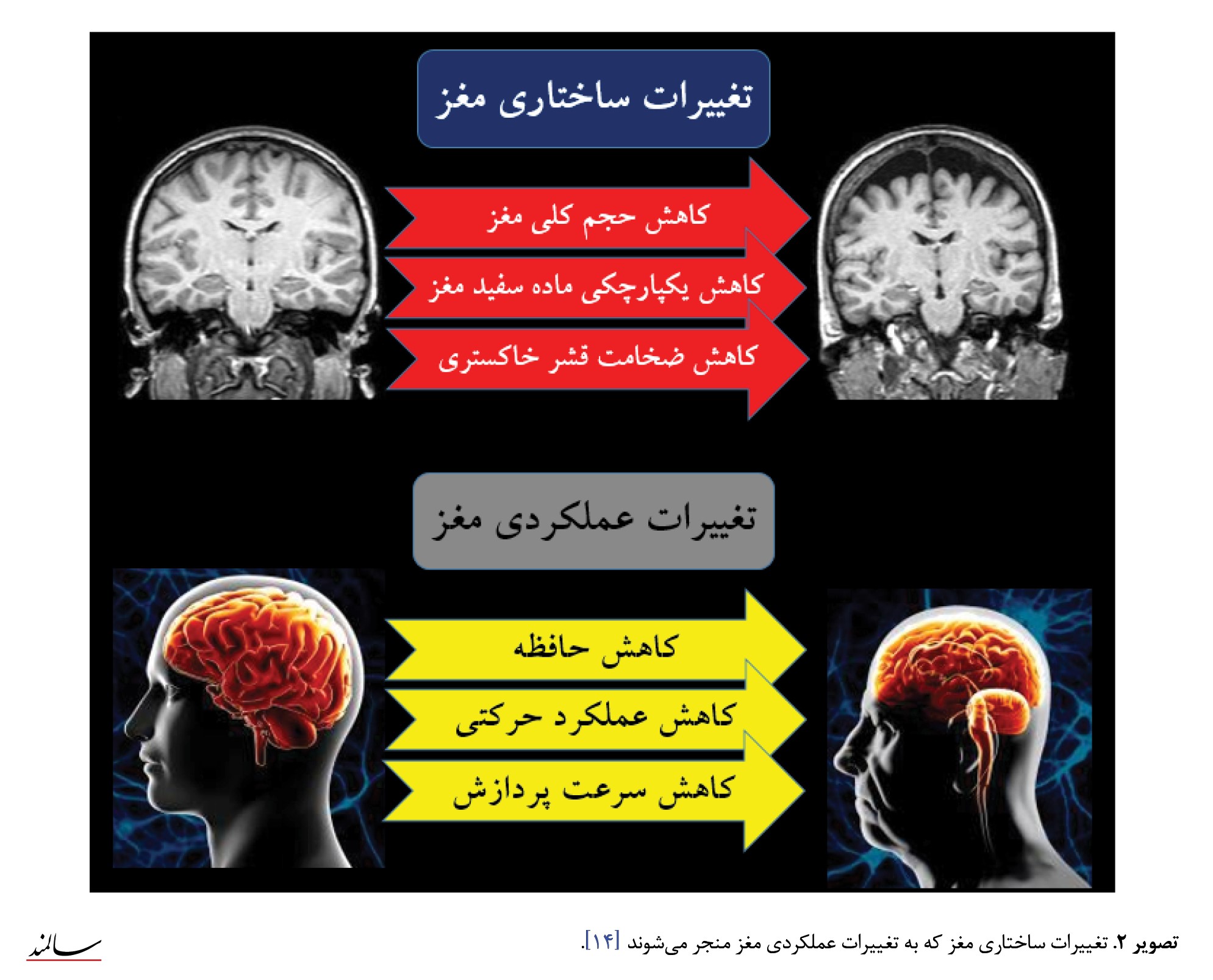
همانند سایر ارگانهای بدن، قابلیت عملکردی مغز نیز با افزایش سن بهطور پیشروندهای کاهش مییابد. این تغییرات عملکردی در واقع بهدلیل تغییر در ساختار مغز میباشند. تغییرات ساختاری مغز بر اثر افزایش سن بهطورکلی میتواند ناشی از کاهش حجم کلی مغز، کاهش ضخامت قشر خاکستری و کاهش یکپارچگی ماده سفید مغز باشد [8]. این تغییرات ساختاری به مراتب بر عملکرد مغز و اعمال شناختی افراد ازجمله عملکرد اجرایی، حافظه و سرعت پردازش اطلاعات توسط مغز تأثیر میگذارد [9، 10]. افراد از دهه ششم زندگی به بعد، بهطور فزایندهای در معرض تخریب عصبی (اختلالهای نوروژنیک)، مانند بیماری آلزایمر [11] و بیماری پارکینسون [12] قرار میگیرند. سالمندی همچنین یکی از عوامل اصلی در بروز سکته مغزی میباشد. بسیاری از پژوهشگران بازه سنی بالای 65 سال را بهعنوان «حاشیه خطر» بیماریهای آلزایمر، پارکینسون و سکته میشناسند (تصویر شماره 2) [13].
آلزایمر
آلزایمر بیماری پیشروندهای است که علاوهبر جنبههای شناختی مغز (مانند حافظه، زبان، توجه و سرعت پردازش اطلاعات)، بر اعمال حرکتی افراد نیز تأثیر میگذارد و درنهایت به زوال عقل و حافظه منجر میشود. مطالعات گسترده در این زمینه نشان داده است تجمع آمیلوییدبتا، پروتئین تاو و اختلال در فعالیت سلولهای گلیا، نقش اصلی در بیماری آلزایمر ایفا میکنند [15]. اولین نشانههای این بیماری چندین سال قبل از ظهور علائم بالینی آن اتفاق میافتد که شامل تغییر در متابولیسم سلول عصبی میشود. این تغییرات دو بخش دارند که یک بخش آن شامل تجمع پلاکهایی به نام آمیلویید بتا در فضای خارج سلولی و یک بخش دیگر آن تجمع تودههاینوروفیبریلار در فضای درون سلولی میباشد [16]. طبق نتایج تحقیقات در زمینه تأثیرات سالمندی بر سیستم عصبی مرکزی مشخص شده است که سالمندی مهمترین عامل بروز بیماری آلزایمر میباشد [14].
طبق آمارهای موجود، احتمال ابتلای افراد به بیماری آلزایمر در سنین بالای 65 سال 10 درصد، بالای 85 سال 32 درصد و بالای 95 سال 50 درصد میباشد [17]. پژوهشهای بسیاری در راستای نحوه درمان و پیشگیری این بیماری انجام شده است، اما هنوز درمان قطعی یافت نشده است. در این راستا پژوهشی که بر روی افراد در فاز اولیه بیماری صورت گرفته، گزارش شده است که با استفاده از تزریق درونوریدی نوعی آنتیبادی، توانستهاند مارکرهای مرتبط با اختلالات ناشی از آلزایمر را کاهش دهند، اما توصیه شده است برای تأیید همهجانبه این دارو نیاز به تحقیقات بیشتر میباشد [18].
پژوهشگران حوزه فعالیت بدنی و ورزش نیز تحقیقات بسیاری در زمینه بیماری آلزایمر انجام دادهاند و بهطرز شگفتانگیزی نشان داده شده است فعالیت بدنی میتواند بهعنوان یک عامل کاهنده و مؤثر بر سرعت پیشرفت این بیماری عمل کند و همچنین فعالیت ورزشی میتواند اختلالات شناختی موجود در فاز گسترش یافته بیماری را کاهش دهد [19]. بااینحال، در چند دهه اخیر، فعالیت بدنی بهعنوان یکی از مؤثرترین راهها برای جلوگیری از پیشرفت پاتولوژی بیماری آلزایمر شناخته شده است و دراینرابطه مشخص شده است که تمرینات ورزشی با نوع، مدت و شدتهای مختلف دارای اثرات متنوعی در جهت کاهش علائم بیماری آلزایمر میباشند و بین محققان در این زمینه جهت مشخص شدن بهترین روش تمرینی، اختلافنظرهایی صورت گرفته است که نیاز به بررسی جامعی در این باره میباشد (جدول شماره 1) [19].
بااینحال مشخص شده است انجام فعالیتهای ورزشی در دوران سالمندی، از طریق نورونزایی باعث کاهش علائم بیماریهای وابسته به نورون از جمله آلزایمر و پارکینسون میشود [20]. در این خصوص گزارش شده است عامل نروتروپیک مشتق از مغز(BDNF) مسئول فرآیندهایی ازجمله نورونزایی، انعطافپذیری سیناپسی و سیناپسزایی در مغز میباشد [21، 22]. BDNF نقش مهمی در اعمال شناختی، حافظه و یادگیری ایفا میکند [23-25]. مطالعات نشان دادهاند در طی فرآیند سالمندی، میزان BDNF در بخشهای مختلفی از مغز ازجمله هیپوکمپ کاهش میباید که این امر بهنوبهخود احتمال بروز بیماری آلزایمر را افزایش میدهد [26]. یکی از راههای افزایش میزان BDNF در مغز، افزایش فعالیت بدنی و فعالیت ورزشی میباشد [27]. دیده شده که یک رابطه شدت-پاسخ بین فعالیت ورزشی و میزان BDNF در گردش خون وجود دارد [28]. مشخص شده است، حجم و شدت فعالیت ورزشی هر دو بر میزان BDNF در گردش تأثیرگذار هستند اما شدت فعالیت رابطه بیشتر و بزرگتری نسبت به مدت فعالیت ورزشی با میزان BDNF دارد [29]. همچنین نشان داده شده است فعالیت ورزشی فوق بیشینه سرعتی، افزایش و ماندگاری بیشتری در میزان BDNF در گردش پس از یک وهله تمرین نسبت به فعالیتهای با شدت متوسط (65 درصد حداکثر اکسیژن مصرفی) و شدت بالا (85 درصد حداکثر اکسیژن مصرفی) داشتهاند [28]. بااینحال، شدت و حجم تمرینات دو فاکتور بسیار مهم در طراحی تمرین میباشند. فعالیت ورزشی با شدت بالا افزایش و تجمع لاکتات در عضلات و جریان خون را به همراه دارد. بسیاری از مطالعات لاکتات را بهعنوان عامل اصلی میانجیگر تأثیرات مفید فعالیت ورزشی شدت بالا میدانند [30].
لاکتات بهنوبهخود باعث افزایش BDNF در مغز میشود. این افزایش BDNF، با بهبود خلقوخو در بیماریهای وابسته به روان و بهبود علائم بیماریهای نورونی ازجمله آلزایمر، پارکینسون و سکته مغزی در ارتباط میباشد [31]. در این راستا شیلو و همکاران در یک مطالعه فراتحلیل به بررسی تأثیر انواع تمرینات ورزشی بر عملکرد مغزی و حافظه پرداختند که در این مطالعه جامع گزارش شد تمرینات با فشار مکانیکی بالا مانند تمرینات مقاومتی بیشترین تأثیر را بر عملکرد حافظه در بیماران آلزایمری داشتند، درحالیکه تمرینات ترکیبی که شامل تمرینات مقاومتی، تداومی، تعادلی و شناختی بود، بیشترین تأثیر را بر عملکرد اجرایی و حرکتی در این بیماران داشتند [32].
سیلوا و همکاران در مطالعهای به بررسی تغییرات مهمترین مارکرهای مؤثر در بیماری آلزایمر و سالمندی پرداختند که در این مطالعه به بررسی تأثیر تمرینات هوازی با شدت بالا با وزن بدن بر مقادیر مارکرهای BDNF و Phosphorylated-TAU پرداخته شد و درنهایت مشخص شد انجام تمرینات با شدت بالا باعث افزایش معنیداری در مقادیر این عوامل و بهبود عملکرد حرکتی بیماران سالمند دچار آلزایمر شد [33]، درحالیکه اخیراً مطالعات نشان دادهاند تمرینات هوازی همراه با مهارتهای شناختی، تأثیرات مهاری بیشتری بر اختلالات ناشی از آلزایمر در افراد بالای 65 سال داشتهاند [34].
بااینحال به نظر میرسد باتوجهبه مسیرها و تأثیرات مختلف تمرینات ورزشی در این زمینه طبق مطالعات انجامشده، تمرینات با شدت بالا و فشارهای مکانیکی-متابولیکی بالاتر همراه با درگیری مهارتهای شناختی در زمینه اثرگذاری جهت کاهش و بهبود علائم بیماری آلزایمر، میتوانند دارای برتری نسبت به سایر تمرینات با شدتهای متوسط و کم باشند که علیرغم مطالعات در این زمینه همچنان به بررسی تأثیرات تمرینات ورزشی در بازههای زمانی مختلف و انواع متنوع، نیاز میباشد.
پارکینسون
پارکینسون نوعی اختلال عصبی محسوب میشود که بر اثر از دست دادن نورونهای تولیدکننده دوپامین واقع در عقدههایقاعدهای و گسترش و انباشت پروتئینی به نام آلفاسینوکلیئین در بخشهای مختلف مغز ایجاد میشود. بیماری پارکینسون شایعترین اختلال حرکتی و دومین بیماری شایع مرتبط با از دست دادن نورون در مغز بعد از آلزایمر میباشد [42].
شیوع بیماری پارکینسون در جمعیت عمومی 0/3 درصد، در افراد بالای 60 سال 1 درصد و در افراد بالای 80 سال 3 درصد گزارش شده است. ابتلا به بیماری پارکینسون قبل از 50 سالگی نادر است، اما بروز آن از دهه ششم تا نهم زندگی 5 تا 10 برابر افزایش مییابد و امکان وقوع آن در مردان 2 برابر زنان میباشد [43]. عوامل مختلفی از جمله نژاد، قومیت، ژنتیک، محیط و سبک زندگی بر احتمال وقوع بیماری پارکینسون تأثیر دارند. برایمثال تقابل ژن-محیط یکی از عوامل تأثیرگذار بر بروز این بیماری میباشد. احتمال بروز این بیماری در مردان ژاپنی و اوکیناوا تباری که در هاوایی زندگی میکنند بیشتر از مردان ساکن ژاپن بوده و این امر میتواند نشاندهنده تعامل و تأثیر ژن و محیط بر یکدیگر و ظهور بیماری پارکینسون باشد [44]. احتمال ابتلا و بروز بیماری پارکینسون در افرادی که در معرض عوامل محیطی خاصی مانند آفتکشها و آسیبهای مغزی قرار دارند بهطور قابلتوجهی بیشتر و در افراد سیگاری یا مصرفکنندگان کافئین کمتر میباشد [45].
دارودرمانی مداخله اصلی درمان بیماری پارکینسون است. لوودوپا داروی اصلی درمان پارکینسون و مؤثرترین دارو برای درمان همه علائم اصلی بیماری است. با وجود فواید زیاد و مؤثر این دارو، عوارض جانبی بسیاری با خود به همراه دارد. از طرفی پژوهشهایی با همکاری متخصصان این بیماری و فیزیولوژیستهای ورزشی انجام شده، نشان داده که انواع فعالیت و تمرینات ورزشی یکی از بهترین روشها برای کنترل و کاهش علائم بیماری میباشد [46-48].
ازآنجاییکه بیشتر مبتلایان بیماری پارکینسون در بازه سنی سالمندی هستند، تجویز پروتکل ورزشی خاص با در نظر گرفتن شرایط و ویژگیهای روانی و جسمانی افراد سالمند، از چالشهای پیشرو در این زمینه میباشد که در این زمینه به تازگی راموس و همکاران در تحقیقی به بررسی تأثیر تمرینات مقاومتی و تمرینات تناوبی با شدت بالا بر روی بیماری پارکینسون در افراد سالمند پرداختهاند که در نهایت گزارش شد انجام هر دو نوع تمرینات باعث بهبود عملکرد حرکتی و شناختی افراد سالمند دارای علائم بیماری پارکینسون شد؛ درنهایت پس از ارزیابی جامع مطالعات در این زمینه گزارش شد انجام تمرینات تناوبی با شدت بالا همراه با تمرینات مقاومتی دارای تأثیرات همافزایی (سینرژیک) بودند و باعث تغییرات بیشتر نسبت به هر کدام از این نوع تمرینات بهصورت مجزا شدند [49].
دررابطهبا تأثیر شدت تمرینات جهت افزایش قابلیتهای جسمانی و عوامل مرتبط با بیماری پارکینسون در مطالعه دیگری کاتینا و همکاران به بررسی تأثیر 10 هفته تمرینات تناوبی با شدت بالا و تمرینات تداومی با شدت متوسط پرداختند که در نهایت گزارش کردند در بیماران پارکینسون بین گروه تمرینات تناوبی با شدت بالا و تمرینات تداومی تفاوت معنیداری بین مقادیر عوامل فیزیولوژیکی مانند استقامت قلبی تنفسی و استقامت عضلانی و همچنین بین مقادیر عوامل مرتبط با بیماری پارکینسون مانند شاخص بیماری پارکینسون (UPDRS) و شاخص خستگی بیماری پارکینسون (PFS-16) ، مشاهده نشد، درحالیکه نویسندگان اشاره کردند که تمرینات با شدت بالا دارای مزایای بیشتری نسبت به تمرینات با شدت متوسط بودند [50].
بااینحال مطالعات دیگری به بررسی تأثیرات حاد تمرینات ورزشی پرداختهاند که در مطالعهای تسایی و لین به بررسی تغییرات نروترنسیمترها و عوامل عصبی-شناختی پرداختهاند که گزارش شده است تمرینات با شدت متوسط باعث افزایش معنیدار مقادیر دوپامین در بیماران پارکینسون نسبت به گروه تمرینات با شدت بالا شد، درحالیکه گزارش شد تغییرات نسبی عوامل عصبی-شناختی و نروترنسیمترها بهصورت وابسته به شدت بود و در تمرینات با شدت بالاتر این تغییرات در جهت بهبود علائم بیماری مؤثرتر به نظر میرسند (جدول شماره 2) [51].
بااینحال، طبق نتایج مطالعات در این زمینه به نظر میرسد انجام تمرینات با شدت بالاتر بهصورت نسبی، راهکار مؤثری نسبت به سایر شدت تمرینات ورزشی باشد و باتوجهبه روشهای نوین تمرینات شناختی، به نظر میرسد انجام تمرینات شناختی همراه با تمرینات با شدت بالا میتوانند دارای تأثیرات مؤثری بر بهبود علائم بیماری پارکینسون در افراد سالمند باشند.
سکته مغزی
سکته مغزی، یکی از دلایل عمده مرگ و ناتوانی طولانیمدت و اختلال شناختی قلمداد شده [57] و به اختلالات عملکردی منجر میشود [58]. میزان بروز سکته مغزی باتوجهبه ساختار سنی جمعیت موردمطالعه بسیار متفاوت است [59]. سکته مغزی دومین علت شایع مرگومیر در جهان پس از بیماری ایسکمیک قلبی است و اغلب با پیامدهای طولانیمدت ناتوانی حرکتی و اختلالات شناختی همراه است [59] و همچنین بر تمام گروههای سنی ، از قبیل نوزادان تا افراد مسن تأثیر میگذارد [60].
در بین سکتههای مغزی 80 درصد از آن را سکته مغزی ایسکمیک شامل میشود که بهعلت کاهش جریان خون مغزی با نقایص عملکردی و متابولیک همراه است [61]. سکته مغزی ایسکمیک باعث ایجاد تغییرات پاتوفیزیولوژیکی در مناطق دچار ایسکمی میشود که در مرکز ناحیهای که جریان خون آن مسدود گردیده جریان خون بهشدت کاهش مییابد و اکثر سلولها تحت آسیب شدید قرار میگیرند که قابلیت برگشتپذیری نخواهند داشت، درحالیکه نواحی دور از مرکز (پنومبرا)، بهدلیل پرفیوژن خون بهوسیله عروق جانبی حمایت میگردد و در این نواحی تغییرات مرتبط با بازتوانی سلولهای عصبی، میتواند باعث بهبود سلولهای عصبی آسیبدیده شود [62].
کاهش جریان خون در سکته مغزی ایسکمیک عمدتاً به دو فرآیند آسیب شناختی متقابل نسبت داده میشود: کاهش اکسیژنرسانی و اختلال در تأمین گلوکز به مناطق مغز آسیبدیده که این عوامل باعث فعالسازی مسیرهای پروتئولیتیکی و آپوپتوزی میشود که دلایل آن افزایش لاکتات تولیدی ناشی از مسیر گلیکولیز بیهوازی و افزایش اسیدوز، تشکیل رادیکالهای آزاد، سمیت سلولی و فعال شدن عوامل التهابی میباشد که پیامد آن اثرگذاری بر سنتز پروتئین و افزایش تخریب سلولهای عصبی خواهد بود و همچنین فقدان انرژی باعث تخریب عملکرد پمپ سدیم پتاسیم و پمپ کلسیم وابسته به انرژی و افزایش Ca++،Na+ و Cl- درون سلولی و K+ برون سلولی میگردد که تمام این عوامل به فعالسازی مسیرهای آپوپتوتیک در سلولهای مختلف موجود در سیستم عصبی، ختم خواهند شد [63].
تحقیقات جدید نشان میدهد وقوع سکته مغزی در حال افزایش بوده و از هر 4 نفر در سراسر جهان 1 نفر در طول زندگی خود سکته مغزی را تجربه میکند [64]؛ عوامل خطر مختلفی مانند وراثت، بیماریهای زمینهای مانند فشار خون و بیماریهای قلبیعروقی به افزایش بروز سکته مغزی منجر میشود که گزارش شده است افزایش سن یکی از عوامل اثرگذار بر بروز سکته مغزی میباشد. بروز سکته در بازههای سنی مختلف، متفاوت است و طبق نتایج تحقیقات در این زمینه، بروز سکته مغزی پس از سن 55 سال، با گذشت هر دهه از زندگی 2 برابر میشود [57]. دررابطهبا مهار و کاهش عوامل مرتبط با سکته مغزی، تحقیقات متعددی تابهحال صورت گرفته است که در این مطالعات از مداخلات مختلفی استفاده شده است که یکی از کمخطرترین، کمهزینهترین و مؤثرترین روش، تمرینات ورزشی شناخته شده است.
در این زمینه، مطالعات نشان دادهاند فعالیت ورزشی یک راهکار امیدوارکننده در جهت کاهش احتمال وقوع سکته و بازتوانی سریعتر پس از سکته میباشد [65] فعالیت و تمرینات ورزشی از طریق عوامل مختلف فیزیولوژیکی مانند نروژنز، آنژیوژنز، سیناپتوژنز و غیره، باعث مهار و بهبود تغییرات فیزیولوژیکی مرتبط با سالمندی و سکته مغزی میشوند [65، 66]، درحالیکه مشخص شده انواع تمرینات ورزشی با فشارهای متابولیکی، مکانیکی و روانی مختلف، دارای تأثیرات متنوعی بر عملکرد مغز در سالمندی هستند که هرکدام میتوانند باعث تحریک و مهار یک مسیر سیگنالینگ اختصاصی در جهت بهبود عملکرد عصبی مغز در سالمندی شوند (جدول شماره 3) [67].
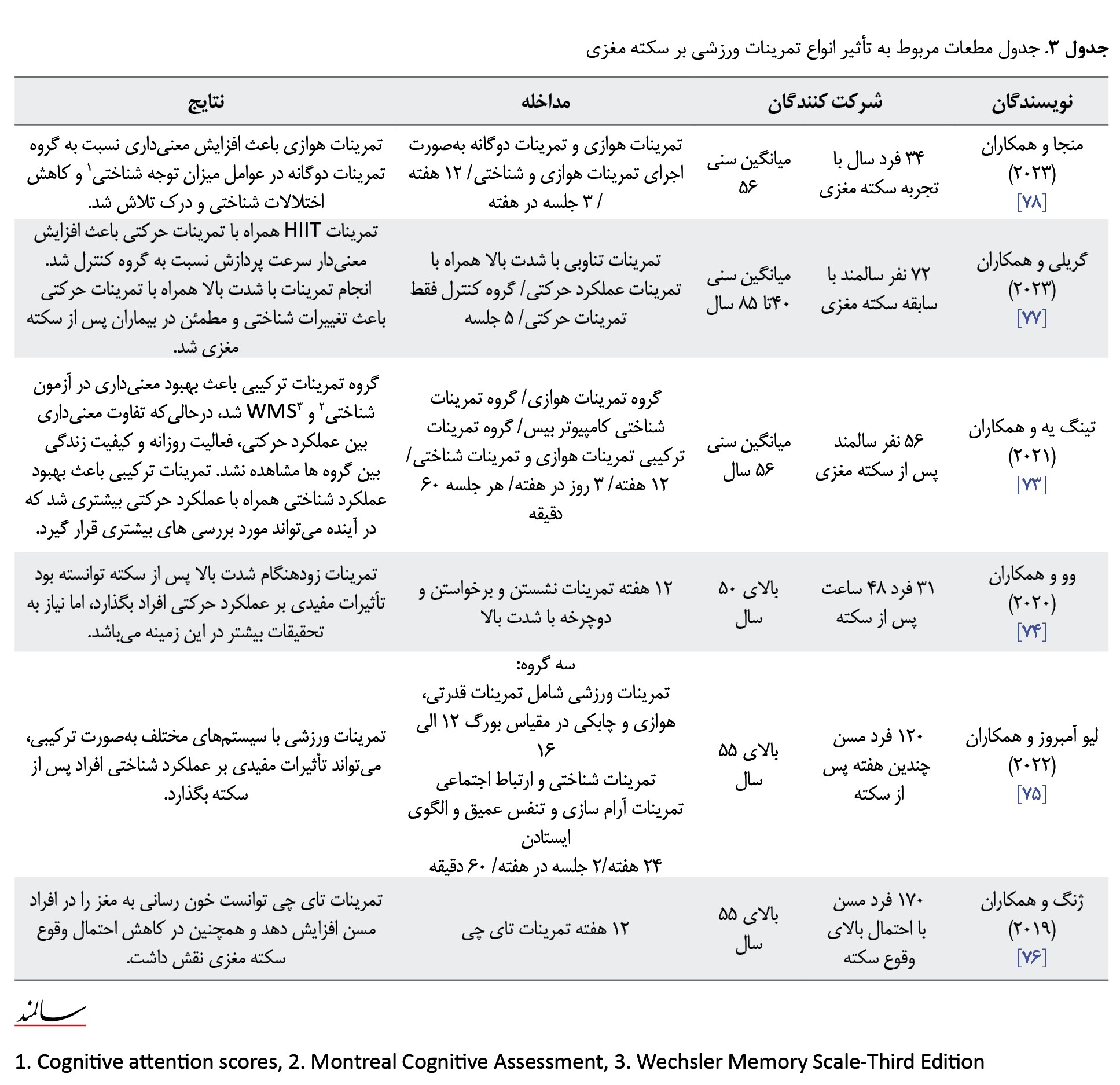
بهطورکلی تحقیقات در زمینه تأثیر تمرینات ورزشی بر روی عوامل مرتبط با سکته مغزی بهصورت پیششرطیسازی که تأثیر تمرینات ورزشی قبل از وقوع سکته سنجیده میشود و تمرینات در دوران توانبخشی که تأثیر تمرینات پس از سکته مورد بررسی قرار میگیرد که در این خصوص مطالعات حیوانی نیز نتایج قابلتأملی را ارائه کردهاند؛ در این خصوص در مطالعهای فصیحیان و نورشاهی گزارش کردهاند تمرینات تداومی با شدت متوسط و مدت فزاینده در مقایسه با تمرینات با شدت فزاینده، دارای تأثیرات معنیداری بر مهار مسیر آپوپتوز و بهبود عملکرد حسی حرکتی پس از سکته مغزی بودند [68]. همچنین در مطالعهای بهصورت کیفی به بررسی تأثیر تمرینات در منزل توسط افراد دچار سکته مغزی و سالمند پرداخته شد که درنهایت محققان گزارش کردند انجام تمرینات پس از سکته مغزی نیازمند بررسی دقیق شرایط بیماران از جنبههای مختلفی میباشد [69].
در این راستا در تحقیق دیگری گریلی و همکاران به بررسی تأثیر تمرینات تناوبی با شدت بالا همراه با تمرینات شناختی در افراد سالمند دچار سکته مغزی پرداختند که پس از 5 جلسه گزارش کردند انجام تمرینات تناوبی با شدت بالا(HIIT) همراه با تمرینات شناختی باعث افزایش معنیدار بهبود عملکرد حرکتی و شناختی بیماران سالمند پس از سکته مغزی شد [70]. برخلاف این نتایج در پژوهشی مینجا و همکاران گزارش کردند انجام 12 هفته تمرینات هوازی با شدت متوسط نسبت گروه تمرینات دوگانه شناختی راه رفتن دارای تأثیرات معنیداری در عملکرد حرکتی و شناختی در بیماران سکته مغزی بود [71]. علاوهبر آن دررابطهبا تمرینات پیشآمادهسازی در مقاله با سکته مغزی مطالعهای در این زمینه نشان داده است تمرینات با شدت بالا دارای اثربخشی بیشتری نسبت به تمرینات با شدت متوسط هستند [72].
بااینحال باتوجهبه نتایج گزارششده توسط محققان در این زمینه، به نظر میرسد انجام تمرینات با شدت بالا همراه با تمرینات شناختی بهصورت پیششرطیسازی جهت پیشگیری از سکته مغزی، میتوانند دارای تأثیرات زیادی در جهت پیشگیری و بهبود اختلالات ناشی از سکته مغزی باشند و به نظر میرسد انجام تمرینات ورزشی در شرایط پیشآمادهسازی و توانبخشی دارای تفاوتهای وابسته بهشدت میباشند که در این خصوص نیاز به مطالعات بیشتر میباشد.
سالمندی و فعالیت ورزشی
فعالیت بدنی یک عامل بسیار مهم و تأثیرگذار بر فرآیند سالمندی میباشد. بااینحال باتوجهبه شیوههای نوین تمرینات ورزشی، تاکنون تأثیرات مختلف تمرینات ورزشی بهخوبی شناسایی نشده است [77]، درحالیکه فعالیت ورزشی بهنوبهخود با سازوکارهای مختلفی که دارد باعث بهبود قابلیتهای فیزیولوژیکی میشود که در طول فرآیند سالمندی تحت تأثیر قرار میگیرند و بهصورت پیشرونده عملکرد ارگانهای مختلف را کنترل میکنند [78]. کاهش قابلیت و عملکرد فیزیولوژیکی با افزایش احتمال بروز بیماریهای مزمن در ارتباط بوده و ازاینرو فعالیت ورزشی به یکی از بهترین روشها برای معکوس کردن تأثیرات مخرب سالمندی تبدیل شده است. در طی فرآیند سالمندی افزایش سن با اختلالات شناختی و همچنین اضطراب همراه میباشد. فعالیت ورزشی با سازوکارهای مختلف میتواند باعث کاهش استرس و افزایش تابآوری نسبت به عوامل استرسزا نیز شود [79].
طبق نتایج مطالعات انجامشده، انواع مختلف فعالیتهای ورزشی میتواند بر اختلالات پاتولوژیکی مرتبط با سالمندی و سیستم عصبی مانند بیماریهای آلزایمر، پارکینسون و سکته مغزی تأثیر چشمگیری داشته باشد. با وجود اینکه هنوز علت اصلی بروز این بیماریها بهطور کامل مشخص نشده است، اما تحقیقات توانستهاند ارتباط مثبتی بین فعالیت ورزشی و کاهش علائم این بیماریها کشف کنند. کمتحرکی یکی از مهمترین دلایل بروز بیماریهای مختلف میباشد، ازطرفی افزایش سن هم بهنوبهخود باعث کاهش تواناییهای حرکتی و جسمی میشود که این امر کمتحرکی فرد سالمند را به همراه خواهد داشت.
مطالعات در این زمینه نشان دادهاند کمتحرکی یکی از دلایل مؤثر در بروز زود هنگام بیماری آلزایمر میباشد و از طرفی فعالیت ورزشی به کاهش شاخصهای زیستی مرتبط با این بیماری، ازجمله پروتئین تاو و آمیلویید بتا در مایع مغزی-نخاعی افراد سالمند سالم منجر شده است [80]. در مطالعات بالینی مرتبط با بیماری پارکینسون نیز فعالیت ورزشی باعث بهبود علائم این بیماری شده است [81]. در این مطالعات مشاهده شده است فعالیت ورزشی با شدت بالا علاوهبر ایمن بودن، تأثیرات مثبت چشمگیری بر شاخصههای بیماری پارکینسون داشته است [82]. همچنین مطالعات حیوانی در این زمینه نشان دادهاند فعالیت ورزشی از طریق حفاظت از نورونهای تولیدکننده دوپامین، میتوکندریها و جلوگیری از تجمع پروتئین آلفاسینوکلئین باعث بهبود عملکرد حرکتی و علائم مرتبطه با بیماری پارکینسون میشوند [83، 84].
درخصوص تأثیر فعالیت ورزشی بر سکته مغزی نیز مطالعات بسیاری انجام شده است. مطالعات بالینی اخیر نشان دادهاند فعالیت ورزشی تأثیر مثبتی بر پیشگیری از وقوع سکته و همچنین پیامدهای ناشی از آن در صورت وقوع سکته دارد که همچنین گزارش شده است شدت سکته در افراد فعال کمتر بوده و بهبود پس از سکته نیز در افراد فعال بهتر از افراد غیرفعال میباشد [85، 86]. فعالیت ورزشی از طریق افزایش خونرسانی و بهبود انتشار خون به مغز نقش پیشگیریکننده در وقوع سکته دارد و همچنین در بهبود آسیبهای وارده پس از وقوع سکته مؤثر میباشد [31، 72]. فعالیت ورزشی میتواند باعث بهبود متابولیسم گلوکز مغز، افزایش ظرفیت آنتیاکسیدانی، سطح هموگلوبین، پاسخهای التهابی و مرتبط با سیستم ایمنی، تعدیل غلظت نوروتروفینها و پپتیدهای در گردش خون و همچنین کاهش غلظت پروتئین تاو و سطح کورتیزول شود [87].
درخصوصی طراحی و تجویز فعالیت ورزشی، دو مؤلفه بسیار مهم شامل حجم و شدت فعالیت میباشند که باتوجهبه هدف تمرین متغیر خواهد بود. شدت فعالیت ورزشی نقش مهمی در میانجیگری اثرات مثبت ورزش بر اعمال شناختی دارد. مطالعات نشان دادهاند تنها تمرینات ورزشی با شدت متوسط و بالا میتوانند تأثیرات چشمگیری بر اعمال شناختی داشته باشند [88]. مقایسه تمرینات تناوبی با شدت بالا و شدت متوسط تداومی نشان داد هرچه شدت فعالیت بیشتر باشد بهبود بیشتری در عملکرد قلبی تنفسی ایجاد خواهد شد و این امر میتواند کارکرد بهتر اعمال شناختی را با خود به همراه داشته باشد [89]. درخصوص حجم تمرین نیز نتایج تقریباً مشابهای یافت شد که نشان میدهد افزایش حجم تمرین با بهبود بیشتر عملکرد قلبی-تنفسی و اعمال شناختی همراه بوده است [90].
نکته حائز اهمیت درخصوص حجم و شدت تمرین، تأثیرگذاری آن بر عملکرد سیستم عصبی میباشد. شدت و حجم بالاتر تمرینات با رعایت اصول تمرین (اضافه بار) میتواند بهبود بیشتری در عملکرد سیستم عصبی ایجاد کند که این اصل خود یک عامل تأثیرگذار بر اعمال شناختی میباشد که در تمرینات دوره توانبخشی و هم تمرینات پیشآماداهسازی مرتبط با سکته مغزی از اهمیت بالایی برخوردارند [91، 92]. در بیماری پارکینسون نیز نتایج مشابهی یافت شده است که نشان میدهد حجم و شدت فعالیت ورزشی نقش مهمی در مدیریت بیماری پارکینسون ایفا میکنند، بهطوریکه ورزش هوازی با شدت بالا در مقایسه با شدت متوسط در کاهش سرعت پیشرفت بیماری مؤثرتر بوده است و همچنین حجم بیشتر فعالیت بدنی با کاهش خطر ابتلا به بیماری پارکینسون مرتبط میباشد [93].
دررابطهبا سکته مغزی نیز براساس نتایج بهدستآمده در مطالعات، تمرینات ورزشی با شدت کم در فاز حاد تا 1 هفته پس از سکته مغزی و تمرینات با شدت بالا در فاز مزمن، بیش از 1 هفته پس از سکته مغزی میتواند برای رشد سلولهای عصبی آسیبدیده مفید باشد. فعالیتهای ورزشی با حجم و شدت فزاینده را میتوان یک استراتژی مناسب برای بهرهمندی از این اثرات مفید در نظر گرفت [65، 94].
سالمندی و تمرینات دوگانه
تمرینات دوگانه شامل تمریناتی میباشند که اعمال شناختی و حرکتی فرد را بهصورت همزمان درگیر میکنند. مطالعات نشان دادهاند این نوع تمرینات میتوانند تأثیرات مفید بسیاری بر سالمندی بگذارند [95]. ترکیب تمرینات هوازی همراه با تمرینات مهارتی و شناختی میتواند یکی از بهترین روشها برای بهبود اعمال شناختی و حرکتی افراد در طول دوره سالمندی باشد [96]. سازوکار مؤثر این تمرینات از طریق اصول یادگیری حرکتی و انجام وظیفه میباشد. افراد با انجام این تمرینات قابلیتهای شناختی و حرکتی خود را برای انجام کارهای روزانه افزایش میدهند. مطالعات نشان دادهاند این تمرینات میتواند باعث افزایش نوروپلاستیسیتی و رگزایی در بخشهای مختلفی از مغز شود، ازاینرو روش تمرینی مناسب و بهینهای برای به حداقل رساندن تأثیرات مخرب سالمندی میباشد [97، 98]. در این راستا هانگ و همکاران در یک مطالعه فراتحلیلی گزارش کردند که انجام تمرینات دوگانه در افراد سالمند باعث تغییرات معنیداری در قابلیت شناختی و عملکرد حرکتی شد [99].
ازلحاظ اصول فیزیولوژیکی انجام تمرینات با فشارهای متابولیکی همراه با تمرینات شناختی و مهارتی باعث درگیری سیستم عصبی مرکزی و همچنین سایر ارگانهای اسکلتی-عضلانی و قلبی-تنفسی میشود که به نظر میرسد انجام همزمان این نوع تمرینات نسبت به تمرینات بهصورت مجزا، دارای اثربخشی بسیار زیادتری بر سیستم عصبی و اختلالات ایجادشده در اثر سالمندی مانند بیماریهای آلزایمر، پارکینسون و سکته مغزی خواهند بود که در تحقیقی در این زمینه لانگهارتس و همکاران در یک مطالعه به بررسی تأثیر تمرینات دوگانه بر روی بیماران پارکینسون و آلزایمر پرداختند که درنهایت گزارش کردند انجام تمرینات دوگانه باعث تغییرات متفاوتی بین بیماریهای آلزایمر و پارکینسون شد، درحالیکه باعث بهبود قابلیتهای حرکتی و شناختی در هر دو گروه شد [100].
بااینحال علیرغم مشخص شدن تأثیرات تمرینات دوگانه و در نظر گرفتن فرضیه مرتبط با فعالسازی عصبی و شناختی از لحاظ فیزیولوژیکی، به نظر میرسد انجام این نوع تمرینات دارای برتری چشمگیری نسبت به تمرینات استقامتی و قدرتی بهصورت مجزا باشند، درحالیکه تاکنون مطالعات محدودی در این زمینه صورت گرفته است و از لحاظ کاربردی در بسیاری از مراکز درمانی سالمندان، همچنان از روشهای سنتی تمرینات ورزشی استفاده میشود که در این صورت به نظر میرسد انجام تحقیقات گسترده و دقیقتر در این زمینه جهت تجویز بهترین نوع تمرینات برای افراد سالمند و دارای اختلالات عصبی، موردنیاز میباشد.
یافتهها
نتایج بررسی مروری مطالعه حاضر نشان داد بهطورکلی انجام تمرینات ورزشی باعث بهبود و پیشگیری اختلالات مغزی در بین افراد سالمند میشود که در این بین تمرینات ورزشی باتوجهبه فشارهای متابولیکی، مکانیکی و درگیری قسمتهای مختلف سیستم عصبی مرکزی، میتوانند تأثیرات متفاوتی را بر سلولهای عصبی و عملکرد شناختی داشته باشند. طبق نتایج مطالعات گسترده در این زمینه، تمرینات ورزشی ترکیبی که مسیرهای مختلف فیزیولوژیکی مانند درگیری عملکرد شناختی، تعادلی، قدرتی و حرکتی را دربر میگیرند، میتوانند تأثیرات جامعتری نسبت به سایر تمرینات ورزشی که تنها یک عامل فیزیولوژیکی را دربر میگیرند، داشته باشند.
بحث
باتوجهبه افزایش جمعیت سالمندان در جوامع مختلف، اخیراً مداخلات زیادی در جهت مهار سیر رو به رشد عوامل پاتولوژیک در سالمندان مورد بررسی قرار گرفته است که طبق بررسی مطالعات انجامشده در این زمینه، مشخص شده است در بین عوامل فیزیولوژیکی مرتبط با سالمندی، تغییرات ساختاری و عملکردی سیستم عصبی مرکزی، نقش کلیدی در فرایند سالمندی را بازی میکند که در این بین گزارشهای متعددی نشان دادهاند که تمرینات ورزشی در مهار اختلالات سیستم عصبی در سالمندی نقش مهمی دارند.
از عمده اختلالات عصبی ناشی از سالمندی میتوان آلزایمر، پارکینسون و سکته مغزی را نام برد که بهطور شگفت انگیزی هر کدام از انواع تمرینات ورزشی میتوانند اختصاصاً بر روی یک مسیر خاص، تأثیرات خود را جهت مهار فیزیولوژیکی این نوع اختلالات عصبی، لحاظ کنند؛ بهطورمثال مشخص شده است در سالمندی مقادیر عامل نروتروفیک مشتق از مغز که در بازسازی و محافظت از سلولهای عصبی نقش دارد کاهش مییابد [35] و در اثر انجام تمرینات ورزشی این عامل در مغز افزایش مییابد که در بین تمرینات ورزشی، مشخص شده است تمرینات ورزشی با شدت بالاتر باعث ترشح بیشتر این عامل مهم جهت مهار پیشرونده زوال سلولهای عصبی از طریق فرایند نروژنز، محافظت نرونی، مهار آپوپتوز در سالمندی شود [37].
در این راستا در مطالعهای به بررسی تغییرات مهمترین مارکرهای مؤثر در بیماری آلزایمر و سالمندی، پرداخته شده است که در این مطالعه به بررسی تأثیر تمرینات هوازی با شدت بالا با وزن بدن بر مقادیر مارکرهای BDNF و phosphorylated-TAU پرداخته شد و درنهایت مشخص شد انجام تمرینات با شدت بالا باعث افزایش معنیداری در مقادیر این عوامل و بهبود عملکرد حرکتی بیماران سالمند دچار آلزایمر شد [33]، درحالیکه مشخص شده است انجام تمرینات شناختی همراه با هرگونه از تمرینات جسمانی با شدتهای مختلف، میتواند اثربخشی تمرینات ورزشی را چندین برابر کند [43]. در مطالعهای بوردهاوس و همکاران گزارش کردهاند که انجام تمرینات مقاومتی با شدت فزاینده+تمرینات شناختی کامپیوتری باعث تغییرات حرکتی و شناختی معنیداری نسبت به گروههای تمرینات مجزا در افراد سالمند شد [48].
همچنین، دررابطهبا تأثیر انواع مختلف تمرینات ورزشی بر روی بیماری پارکینسون در دوران سالمندی در تحقیقی به بررسی تأثیر تمرینات مقاومتی و تمرینات تناوبی با شدت بالا بر روی بیماری پارکینسون در افراد سالمند پرداخته شد که درنهایت گزارش شد انجام هر دو نوع تمرینات HIIT و تمرینات مقاومتی، باعث بهبود عملکرد حرکتی و شناختی افراد سالمند دارای علائم بیماری پارکینسون شد؛ درنهایت پس از ارزیابی جامع مطالعات در این زمینه مشخص شد انجام تمرینات تناوبی با شدت بالا همراه با تمرینات مقاومتی دارای تأثیرات همافزایی (سینرژیک) بودند و باعث تغییرات بیشتر نسبت به هر کدام از این نوع تمرینات بهصورت مجزا شدند [49].
در مقابل، مطالعه دیگری که به بررسی تأثیر انواع شدتهای تمرینات ورزشی بر بهبود اختلالات ناشی از بیماری پارکینسون در سالمندان پرداخت، نشان داد تفاوت معنیداری بین شدت تمرینات ورزشی در بهبود اختلالات عصبی ناشی از بیماری پارکینسون مرتبط با سالمندی وجود نداشت [59]. ازطرفی، دررابطهبا اختلالات ناشی از سکته مغزی نیز انواع تمرینات ورزشی با شدتهای مختلف نیز تاکنون مورد بررسیهای زیادی قرار گرفته است؛ بهعنوانمثال، تحقیقی گریلی و همکاران به بررسی تأثیر تمرینات تناوبی با شدت بالا همراه با تمرینات شناختی در افراد سالمند دچار سکته مغزی پرداختند که پس از 5 جلسه گزارش کردند انجام تمرینات HIIT همراه با تمرینات شناختی باعث افزایش معنیدار بهبود عملکرد حرکتی و شناختی بیماران سالمند پس از سکته مغزی شد [70]. برخلاف این نتایج در پژوهشی مینجا و همکاران گزارش کردند انجام 12 هفته تمرینات هوازی با شدت متوسط نسبت گروه تمرینات دوگانه شناختی راه رفتن دارای تأثیرات معنیداری در عملکرد حرکتی و شناختی در بیماران سکته مغزی بود [71].
بااینحال، دررابطهبا تمرینات پیشآمادهسازی در مقابله با سکته مغزی مطالعهای در این زمینه نشان داده است که تمرینات با شدت بالا دارای اثربخشی بیشتری نسبت به تمرینات با شدت متوسط هستند [72]. به نظر میرسد با در نظر گرفتن مسیرهای متعدد و متفاوت فیزیولوژیکی و پاتولوژیکی در سیستم عصبی مرکزی در افراد سالمند، هر کدام از انواع تمرینات ورزشی میتوانند باعث بهبود مسیر سیگنالینگ خاص در سلولهای عصبی شوند که بهطورکلی طبق بررسی انجامشده در این مطالعه مروری، به نظر میرسد انجام تمرینات جسمانی همراه با تمرینات شناختی، میتوانند بهترین راهکار جهت محافظت نرونی، مهار عوامل مخرب سلولهای عصبی شود. بااینحال، بهعنوان محدودیتهای اصلی در این زمینه میتوان به عدم مطالعات و تحقیقات کافی با در نظر گرفتن بررسی بین تمرینات جسمانی، شناختی و ترکیبی (جسمانی+شناختی) در جامعه آماری سالمند با انواع بیماریهای عصبی، اشاره کرد که پیشنهاد میشود در مطالعات آینده این موارد بیشتر مورد توجه محققان در زمینه اختلالات عصبی ناشی از سالمندی و انجام مداخلات ورزشی جهت شناخت بهترین روش تمرینات ورزشی و تجویز آن به بیماران و مراکز درمانی مرتبط با افراد سالمند، قرار گیرد.
نتیجهگیری نهایی
ازآنجاییکه فرآیند سالمندی با کاهش قابلیتهای عملکردی و شناختی همراه است، انجام تمرینات ورزشی نیز با محدودیتها و چالشهای زیادی مواجه است. بهطورکلی نتایج تحقیقات نشان میدهد فعالیت بدنی منظم به هر شکلی که باشد: انجام فعالیت بدنی در خانه، یوگا، تمرین در آب، تایچی، تمرین مقاومتی و ورزشهای هوازی همگی با افزایش جریان خون مغزی و رگزایی، موجب تغییرات مناسبی در ساختار و عملکرد مغز شده و بدین ترتیب موجب بهبود شناخت میشوند. میزان این تغییرات بستگی بهشدت یا مدت فعالیت بدنی دارد، چون در شدتهای بالاتر میزان لاکتات در مایع مغزی -نخاعی بالا رفته، میزان رگزایی و BDNF تولیدی را افزایش میدهد که این فرایندها موجب تغییرات سیناپسزایی و نورونزایی در نواحی مختلف مغزی میشود که احتمال وقوع ایسکمی و سکته مغزی را کاهش و از زوال مغز محافظت میکنند و احتمال بروز پارکینسون و سایر بیماریهای شناختی کاهش مییابد، اما نکته حائز اهمیت در مورد تجویز تمرینات شدت بالا برای سالمندان، امکانپذیری و بیخطر بودن آنها میباشد که نیاز حضور مداوم سالمندان در مکانهای مناسب ورزشی با نظارت مستقیم فیزیولوژیستهای ورزش را میطلبد که با اجرای آزمونهای سلامت درجه و شدت ورزش را برای سالمندان تعیین کنند.
ایجاد مکانهای ورزشی مناسب، امکانات حملونقل مناسب سالمندان از محل زندگی به مکانهای ورزشی ،امکان برگزاری آزمونهای مناسب و تعیین شدت و کنترل شدت تمرینات ورزشی توسط متخصصین فیزیولوژیست ورزش در اولویتهای برنامهریزی برای سالمندان قرار دارد و بهطورکلی انجام تمرینات شناختی همراه با تمرینات با فشارهای مکانیکی و متابولیکی مختلف به نظر میرسد یک راهکار مناسب جهت حداکثر بهرهوری از تمرینات ورزشی برای افراد سالمند در نظر گرفته شود و درنهایت به نظر میرسد انجام تمرینات بهصورت متنوع با در نظر گرفتن شدت، مدت و نوع فعالیت بدنی مختلف میتواند مسیرهای مهم فیزیولوژیکی را فعال نموده و بهترین تأثیرات را از لحاظ فیزیولوژیکی بر سیستم عصبی افراد سالمند، اعمال کند که به این دلیل پیشنهاد میشود جهت مشاهده بیشترین تأثیر تمرینات ورزشی، باتوجهبه اصل ویژگی تمرینات ورزشی از تمامی طیف تمرینات مانند تمرینات تداومی با شدت متوسط، تمرینات تناوبی با شدت بالا، تمرینات مقاومتی، بهصورت همزمان با تمرینات شناختی، در برنامهریزی تمرینات جهت مهار و پیشگیری اختلالات عصبی در افراد سالمند استفاده شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این یک مطالعه مروری است و هیچ آزمایشی بر روی نمونههای انسانی یا حیوانی انجام نشده است. بنابراین، به تأیید اخلاقی نیاز نبود.
حامی مالی
این مقاله برگرفته از رساله دکترای معین فصیحیان است و هیچگونه کمک مالی خاصی از سازمانهای تأمین مالی در بخشهای دولتی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور یکسان در مفهوم و طراحی مطالعه، جمعآوری و تجزیهوتحلیل دادهها، تفسیر نتایج و تهیه پیشنویس مقاله مشارکت داشتند.
تعارض منافع
در این مطالعه هیچ گونه تضاد منافعی وجود ندارد.
References
متن کامل: (603 مشاهده)
مقدمه
فرآیند افزایش سن با تخریب پیشرونده عملکرد فیزیولوژیکی بدن و افزایش وابستگی فرد سالمند به اطرافیان همراه است، اما بااینحال دامنه تخریب و وابستگی در همه افراد یکسان نیست، نقش ژنتیک و سبک زندگی در ایجاد تنوع در طول و کیفیت عمر دخیل میباشد که مشخص شده است در دوران سالمندی، احتمال ابتلا به بیماریهایی مثل اختلالات عصبی، قلبی_عروقی، متابولیکی، چاقی و دیابت افزایش مییابد [1].
سازمان بهداشت جهانی اخیراًً سن 65 سال را آغاز دوران سالمندی اعلام کرده است که آمار و ارقام نیز نشان میدهند جمعیت بالای 65 سال روزبهروز در حال افزایش میباشند که در این زمینه سازمان ملل متحد، رشد جمعیت سالمند را تا سال 2050 در حدود 2 میلیارد نفر تخمین زده است [2]. بااینحال، سالمندی یک عامل بسیار تأثیرگذار بر احتمال بروز بیماریهای مزمن ازجمله بیماریهای قلبی-تنفسی، عصبی-عضلانی، متابولیکی و سرطان در نظر گرفته میشود [3]. یکی از مهمترین ارگانهایی که در اثر سالمندی تغییرات فیزیولوژیکی و پاتولوژیکی زیادی را تجربه میکند، سیستم عصبی مرکزی میباشد که اختلالات ایجادشده در عملکرد مغز در اثر سالمندی، گاهاً برگشتناپذیر گزارش شده است [4].
این موضوع، مبحث سالمندی و تأثیر آن بر سیستم عصبی مرکزی را در کشورهای توسعهیافته و درحالتوسعه به یک چالش جدی در زمینههای اجتماعی، اقتصادی و بهداشتی تبدیل کرده است و در سالهای اخیر مورد توجه محققان زیادی قرار گرفته است که در جهت مهار و کاهش علائم سالمندی از مداخلات زیادی استفاده کردهاند که در این رابطه تمرینات ورزشی بهعنوان یکی از عوامل غیرتهاجمی مؤثر در زمینه مهار و کاهش فرایندهای مرتبط با اختلالات عصبی در اثر سالمندی مورد بررسی و تحقیقات زیادی قرار گرفته است و گزارش شده است تمرینات ورزشی در فرایند سالمندی و عوامل پاتولوژیکی بیماریهای مرتبط با مغز نقش مهمی را ایفا میکنند [5].
تمرینات ورزشی باتوجهبه فشارهای متابولیکی و مکانیکی مختلف، دارای تأثیرات متفاوتی بر سیستم عصبی مرکزی و بیماریهایی از قبیل پارکینسون، آلزایمر و سکته مغزی هستند که گزارش شده است هرکدام از انواع تمرینات ورزشی میتوانند بهصورت اختصاصی جهت بهبود شرایط هریک از بیماریهای مرتبط با مغز در دوران سالمندی، مورد استفاده قرار گیرند [6]. بااینحال، باتوجهبه تأثیرات انواع مختلف تمرینات ورزشی تا کنون تحقیقات محدودی درزمینه شناسایی بهترین روش تمرینات ورزشی جهت پیشگیری و بهبود اختلالات مغزی، بهصورت اختصاصی مورد بررسی قرار گرفته است. بنابراین هدف از این مطالعه مروری، بررسی تأثیر انواع تمرینات ورزشی بر بیماریهای پارکینسون، آلزایمر و سکته مغزی در دوران سالمندی بود.
روش مطالعه
برای انجام این تحقیق در پایگاههای اطلاعاتی وبآوساینس، پابمد، گوگلاسکالر و اسکوپوس و در مورد سالمندی، رابطه بین سالمندی و عملکرد مغز، بیماری آلزایمر، پارکینسون، سکته مغزی و تأثیر انواع تمرینات ورزشی بر عملکرد سیستم عصبی بررسی شد که بهطورکلی، عبارتهای سالمندی، بیماری آلزایمر، بیماری پارکینسون، سکته مغزی، تمرینات ورزشی تداومی، تمرینات مقاومتی و تمرینات دوگانه شناختی-حرکتی با استفاده از کلیدواژههای: ‘Aging, Alzheimer, Parkinson, Stroke, Exercise’ در این پایگاهها جستوجو شد که ارزیابی مقالات شامل بررسی عنوان و چکیده مقالات بود.
معیارهای مقالات منتخب شامل فرآیند بررسی، غربالگری، حذف اطلاعات تکراری و نامربوط و همچنین از لحاظ زمانی کلیه مقالات مرتبط، بین سالهای 2005 تا 2024 بود که ضرورت داشت در نشریات بینالمللی انگلیسیزبان، بهطور کلی به بررسی تأثیر افزایش سن بر عملکرد مغز و همچنین نقش انواع تمرینات ورزشی در کنترل و بهبود عوامل پاتولوژیک مغزی در دوران سالمندی پرداخته شود. درنهایت، انتخاب مقالات با استفاده از چارچوب مرورهای حیطهای (Scoping Review) که توسط آرکسی و اُمالی [7] پیشنهاد شده است، انجام گرفت.چهارچوب آرکسی و اُمالی برای انجام این مطالعه مروری، شامل پنج مرحله است:
شناسایی سؤال تحقیق
سؤال اصلی این مطالعه بررسی تأثیرات ورزش بر روند پیری مغز و ارائه بینشهای پیشگیری و درمان بود که این سؤال به نحوی طراحی شده بود که هم جنبههای پیشگیرانه و هم درمانی را پوشش میداد.
شناسایی مطالعات مرتبط
که بهمنظور جمعآوری مطالعات مناسب، جستوجوی جامع در پایگاههای داده علمی نام برده شده، انجام شد.
انتخاب مطالعات
در این مرحله، مطالعاتی که معیارهای ورود ازپیش تعیینشده را برآورده میکردند، برای بررسی بیشتر انتخاب شدند. این معیارها شامل تمرکز بر مطالعاتی بود که به اثرات ورزش بر پیری مغز پرداخته و از روشهای علمی استاندارد استفاده کرده بودند که در این بین، مطالعات مروری و نامه به سردبیر حذف شدند.
-ترکیب و خلاصهسازی دادهها
پس از انتخاب نهایی مطالعات، دادهها بهصورت سیستماتیک استخراج و ترکیب شدند. اطلاعات جمعآوریشده شامل نوع ورزش، طول دوره تمرین، جمعیت هدف و نتایج مربوط به اثرات ورزش بر پیری مغز بود.
-ارائه و تفسیر نتایج
نتایج این مطالعه مروری بهمنظور ایجاد یک چشمانداز جامع در مورد اثرات ورزش بر پیری مغز و نقش آن در پیشگیری و درمان تحلیل و تفسیر شدهاند که در این بخش به شناسایی شکافهای موجود در تحقیقات و پیشنهادهایی برای تحقیقات آتی نیز پرداخته شد [7].
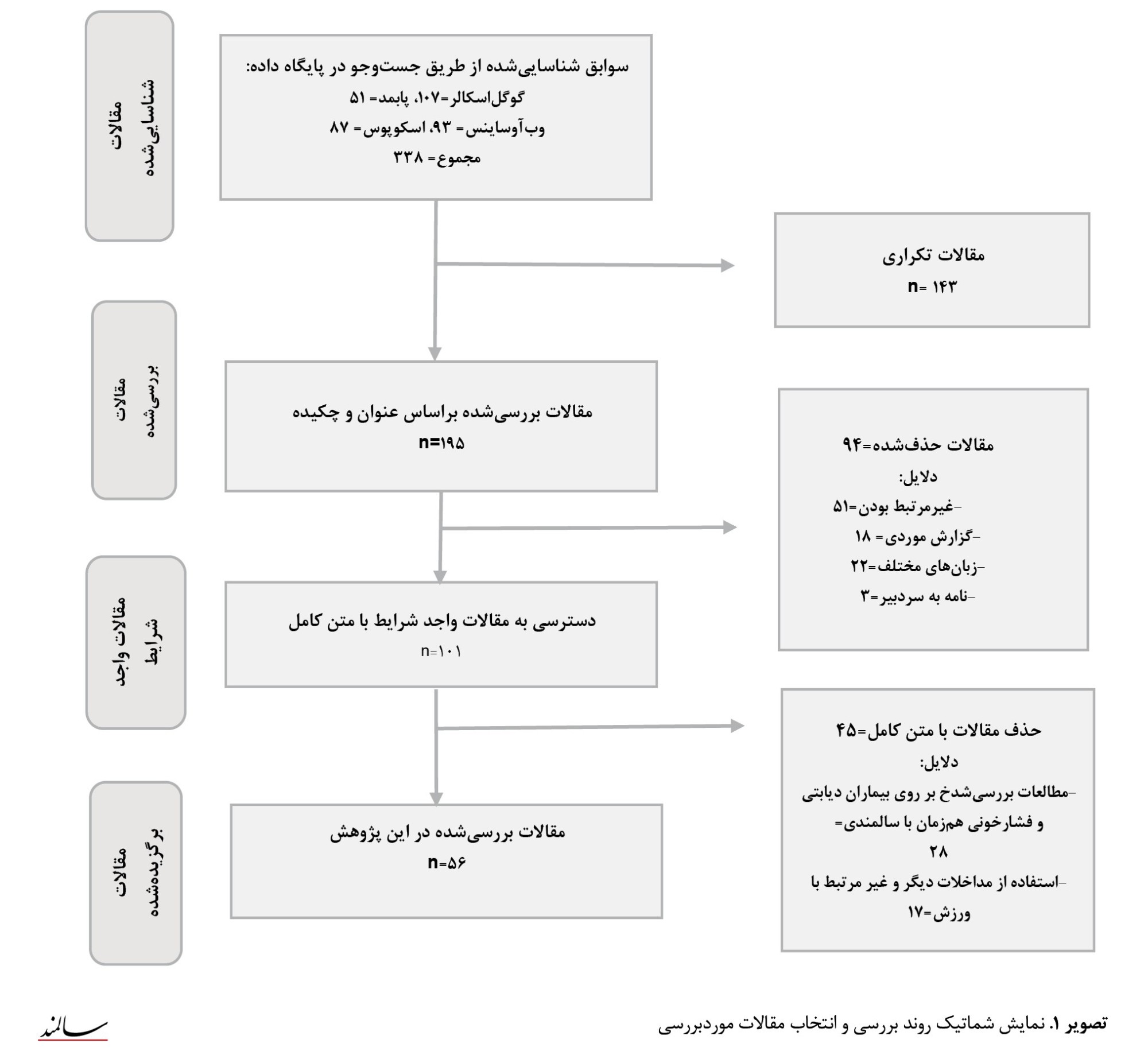
با رعایت اصول و موضوعات استاندارد مقالات بررسیشده، پژوهش حاضر با بررسی 56 مقاله واجد شرایط انجام شد (تصویر شماره 1).
فرآیند افزایش سن با تخریب پیشرونده عملکرد فیزیولوژیکی بدن و افزایش وابستگی فرد سالمند به اطرافیان همراه است، اما بااینحال دامنه تخریب و وابستگی در همه افراد یکسان نیست، نقش ژنتیک و سبک زندگی در ایجاد تنوع در طول و کیفیت عمر دخیل میباشد که مشخص شده است در دوران سالمندی، احتمال ابتلا به بیماریهایی مثل اختلالات عصبی، قلبی_عروقی، متابولیکی، چاقی و دیابت افزایش مییابد [1].
سازمان بهداشت جهانی اخیراًً سن 65 سال را آغاز دوران سالمندی اعلام کرده است که آمار و ارقام نیز نشان میدهند جمعیت بالای 65 سال روزبهروز در حال افزایش میباشند که در این زمینه سازمان ملل متحد، رشد جمعیت سالمند را تا سال 2050 در حدود 2 میلیارد نفر تخمین زده است [2]. بااینحال، سالمندی یک عامل بسیار تأثیرگذار بر احتمال بروز بیماریهای مزمن ازجمله بیماریهای قلبی-تنفسی، عصبی-عضلانی، متابولیکی و سرطان در نظر گرفته میشود [3]. یکی از مهمترین ارگانهایی که در اثر سالمندی تغییرات فیزیولوژیکی و پاتولوژیکی زیادی را تجربه میکند، سیستم عصبی مرکزی میباشد که اختلالات ایجادشده در عملکرد مغز در اثر سالمندی، گاهاً برگشتناپذیر گزارش شده است [4].
این موضوع، مبحث سالمندی و تأثیر آن بر سیستم عصبی مرکزی را در کشورهای توسعهیافته و درحالتوسعه به یک چالش جدی در زمینههای اجتماعی، اقتصادی و بهداشتی تبدیل کرده است و در سالهای اخیر مورد توجه محققان زیادی قرار گرفته است که در جهت مهار و کاهش علائم سالمندی از مداخلات زیادی استفاده کردهاند که در این رابطه تمرینات ورزشی بهعنوان یکی از عوامل غیرتهاجمی مؤثر در زمینه مهار و کاهش فرایندهای مرتبط با اختلالات عصبی در اثر سالمندی مورد بررسی و تحقیقات زیادی قرار گرفته است و گزارش شده است تمرینات ورزشی در فرایند سالمندی و عوامل پاتولوژیکی بیماریهای مرتبط با مغز نقش مهمی را ایفا میکنند [5].
تمرینات ورزشی باتوجهبه فشارهای متابولیکی و مکانیکی مختلف، دارای تأثیرات متفاوتی بر سیستم عصبی مرکزی و بیماریهایی از قبیل پارکینسون، آلزایمر و سکته مغزی هستند که گزارش شده است هرکدام از انواع تمرینات ورزشی میتوانند بهصورت اختصاصی جهت بهبود شرایط هریک از بیماریهای مرتبط با مغز در دوران سالمندی، مورد استفاده قرار گیرند [6]. بااینحال، باتوجهبه تأثیرات انواع مختلف تمرینات ورزشی تا کنون تحقیقات محدودی درزمینه شناسایی بهترین روش تمرینات ورزشی جهت پیشگیری و بهبود اختلالات مغزی، بهصورت اختصاصی مورد بررسی قرار گرفته است. بنابراین هدف از این مطالعه مروری، بررسی تأثیر انواع تمرینات ورزشی بر بیماریهای پارکینسون، آلزایمر و سکته مغزی در دوران سالمندی بود.
روش مطالعه
برای انجام این تحقیق در پایگاههای اطلاعاتی وبآوساینس، پابمد، گوگلاسکالر و اسکوپوس و در مورد سالمندی، رابطه بین سالمندی و عملکرد مغز، بیماری آلزایمر، پارکینسون، سکته مغزی و تأثیر انواع تمرینات ورزشی بر عملکرد سیستم عصبی بررسی شد که بهطورکلی، عبارتهای سالمندی، بیماری آلزایمر، بیماری پارکینسون، سکته مغزی، تمرینات ورزشی تداومی، تمرینات مقاومتی و تمرینات دوگانه شناختی-حرکتی با استفاده از کلیدواژههای: ‘Aging, Alzheimer, Parkinson, Stroke, Exercise’ در این پایگاهها جستوجو شد که ارزیابی مقالات شامل بررسی عنوان و چکیده مقالات بود.
معیارهای مقالات منتخب شامل فرآیند بررسی، غربالگری، حذف اطلاعات تکراری و نامربوط و همچنین از لحاظ زمانی کلیه مقالات مرتبط، بین سالهای 2005 تا 2024 بود که ضرورت داشت در نشریات بینالمللی انگلیسیزبان، بهطور کلی به بررسی تأثیر افزایش سن بر عملکرد مغز و همچنین نقش انواع تمرینات ورزشی در کنترل و بهبود عوامل پاتولوژیک مغزی در دوران سالمندی پرداخته شود. درنهایت، انتخاب مقالات با استفاده از چارچوب مرورهای حیطهای (Scoping Review) که توسط آرکسی و اُمالی [7] پیشنهاد شده است، انجام گرفت.چهارچوب آرکسی و اُمالی برای انجام این مطالعه مروری، شامل پنج مرحله است:
شناسایی سؤال تحقیق
سؤال اصلی این مطالعه بررسی تأثیرات ورزش بر روند پیری مغز و ارائه بینشهای پیشگیری و درمان بود که این سؤال به نحوی طراحی شده بود که هم جنبههای پیشگیرانه و هم درمانی را پوشش میداد.
شناسایی مطالعات مرتبط
که بهمنظور جمعآوری مطالعات مناسب، جستوجوی جامع در پایگاههای داده علمی نام برده شده، انجام شد.
انتخاب مطالعات
در این مرحله، مطالعاتی که معیارهای ورود ازپیش تعیینشده را برآورده میکردند، برای بررسی بیشتر انتخاب شدند. این معیارها شامل تمرکز بر مطالعاتی بود که به اثرات ورزش بر پیری مغز پرداخته و از روشهای علمی استاندارد استفاده کرده بودند که در این بین، مطالعات مروری و نامه به سردبیر حذف شدند.
-ترکیب و خلاصهسازی دادهها
پس از انتخاب نهایی مطالعات، دادهها بهصورت سیستماتیک استخراج و ترکیب شدند. اطلاعات جمعآوریشده شامل نوع ورزش، طول دوره تمرین، جمعیت هدف و نتایج مربوط به اثرات ورزش بر پیری مغز بود.
-ارائه و تفسیر نتایج
نتایج این مطالعه مروری بهمنظور ایجاد یک چشمانداز جامع در مورد اثرات ورزش بر پیری مغز و نقش آن در پیشگیری و درمان تحلیل و تفسیر شدهاند که در این بخش به شناسایی شکافهای موجود در تحقیقات و پیشنهادهایی برای تحقیقات آتی نیز پرداخته شد [7].
با رعایت اصول و موضوعات استاندارد مقالات بررسیشده، پژوهش حاضر با بررسی 56 مقاله واجد شرایط انجام شد (تصویر شماره 1).
تغییرات ساختاری و عملکردی مغز در دوران سالمندی
همانند سایر ارگانهای بدن، قابلیت عملکردی مغز نیز با افزایش سن بهطور پیشروندهای کاهش مییابد. این تغییرات عملکردی در واقع بهدلیل تغییر در ساختار مغز میباشند. تغییرات ساختاری مغز بر اثر افزایش سن بهطورکلی میتواند ناشی از کاهش حجم کلی مغز، کاهش ضخامت قشر خاکستری و کاهش یکپارچگی ماده سفید مغز باشد [8]. این تغییرات ساختاری به مراتب بر عملکرد مغز و اعمال شناختی افراد ازجمله عملکرد اجرایی، حافظه و سرعت پردازش اطلاعات توسط مغز تأثیر میگذارد [9، 10]. افراد از دهه ششم زندگی به بعد، بهطور فزایندهای در معرض تخریب عصبی (اختلالهای نوروژنیک)، مانند بیماری آلزایمر [11] و بیماری پارکینسون [12] قرار میگیرند. سالمندی همچنین یکی از عوامل اصلی در بروز سکته مغزی میباشد. بسیاری از پژوهشگران بازه سنی بالای 65 سال را بهعنوان «حاشیه خطر» بیماریهای آلزایمر، پارکینسون و سکته میشناسند (تصویر شماره 2) [13].
آلزایمر
آلزایمر بیماری پیشروندهای است که علاوهبر جنبههای شناختی مغز (مانند حافظه، زبان، توجه و سرعت پردازش اطلاعات)، بر اعمال حرکتی افراد نیز تأثیر میگذارد و درنهایت به زوال عقل و حافظه منجر میشود. مطالعات گسترده در این زمینه نشان داده است تجمع آمیلوییدبتا، پروتئین تاو و اختلال در فعالیت سلولهای گلیا، نقش اصلی در بیماری آلزایمر ایفا میکنند [15]. اولین نشانههای این بیماری چندین سال قبل از ظهور علائم بالینی آن اتفاق میافتد که شامل تغییر در متابولیسم سلول عصبی میشود. این تغییرات دو بخش دارند که یک بخش آن شامل تجمع پلاکهایی به نام آمیلویید بتا در فضای خارج سلولی و یک بخش دیگر آن تجمع تودههاینوروفیبریلار در فضای درون سلولی میباشد [16]. طبق نتایج تحقیقات در زمینه تأثیرات سالمندی بر سیستم عصبی مرکزی مشخص شده است که سالمندی مهمترین عامل بروز بیماری آلزایمر میباشد [14].
طبق آمارهای موجود، احتمال ابتلای افراد به بیماری آلزایمر در سنین بالای 65 سال 10 درصد، بالای 85 سال 32 درصد و بالای 95 سال 50 درصد میباشد [17]. پژوهشهای بسیاری در راستای نحوه درمان و پیشگیری این بیماری انجام شده است، اما هنوز درمان قطعی یافت نشده است. در این راستا پژوهشی که بر روی افراد در فاز اولیه بیماری صورت گرفته، گزارش شده است که با استفاده از تزریق درونوریدی نوعی آنتیبادی، توانستهاند مارکرهای مرتبط با اختلالات ناشی از آلزایمر را کاهش دهند، اما توصیه شده است برای تأیید همهجانبه این دارو نیاز به تحقیقات بیشتر میباشد [18].
پژوهشگران حوزه فعالیت بدنی و ورزش نیز تحقیقات بسیاری در زمینه بیماری آلزایمر انجام دادهاند و بهطرز شگفتانگیزی نشان داده شده است فعالیت بدنی میتواند بهعنوان یک عامل کاهنده و مؤثر بر سرعت پیشرفت این بیماری عمل کند و همچنین فعالیت ورزشی میتواند اختلالات شناختی موجود در فاز گسترش یافته بیماری را کاهش دهد [19]. بااینحال، در چند دهه اخیر، فعالیت بدنی بهعنوان یکی از مؤثرترین راهها برای جلوگیری از پیشرفت پاتولوژی بیماری آلزایمر شناخته شده است و دراینرابطه مشخص شده است که تمرینات ورزشی با نوع، مدت و شدتهای مختلف دارای اثرات متنوعی در جهت کاهش علائم بیماری آلزایمر میباشند و بین محققان در این زمینه جهت مشخص شدن بهترین روش تمرینی، اختلافنظرهایی صورت گرفته است که نیاز به بررسی جامعی در این باره میباشد (جدول شماره 1) [19].

بااینحال مشخص شده است انجام فعالیتهای ورزشی در دوران سالمندی، از طریق نورونزایی باعث کاهش علائم بیماریهای وابسته به نورون از جمله آلزایمر و پارکینسون میشود [20]. در این خصوص گزارش شده است عامل نروتروپیک مشتق از مغز(BDNF) مسئول فرآیندهایی ازجمله نورونزایی، انعطافپذیری سیناپسی و سیناپسزایی در مغز میباشد [21، 22]. BDNF نقش مهمی در اعمال شناختی، حافظه و یادگیری ایفا میکند [23-25]. مطالعات نشان دادهاند در طی فرآیند سالمندی، میزان BDNF در بخشهای مختلفی از مغز ازجمله هیپوکمپ کاهش میباید که این امر بهنوبهخود احتمال بروز بیماری آلزایمر را افزایش میدهد [26]. یکی از راههای افزایش میزان BDNF در مغز، افزایش فعالیت بدنی و فعالیت ورزشی میباشد [27]. دیده شده که یک رابطه شدت-پاسخ بین فعالیت ورزشی و میزان BDNF در گردش خون وجود دارد [28]. مشخص شده است، حجم و شدت فعالیت ورزشی هر دو بر میزان BDNF در گردش تأثیرگذار هستند اما شدت فعالیت رابطه بیشتر و بزرگتری نسبت به مدت فعالیت ورزشی با میزان BDNF دارد [29]. همچنین نشان داده شده است فعالیت ورزشی فوق بیشینه سرعتی، افزایش و ماندگاری بیشتری در میزان BDNF در گردش پس از یک وهله تمرین نسبت به فعالیتهای با شدت متوسط (65 درصد حداکثر اکسیژن مصرفی) و شدت بالا (85 درصد حداکثر اکسیژن مصرفی) داشتهاند [28]. بااینحال، شدت و حجم تمرینات دو فاکتور بسیار مهم در طراحی تمرین میباشند. فعالیت ورزشی با شدت بالا افزایش و تجمع لاکتات در عضلات و جریان خون را به همراه دارد. بسیاری از مطالعات لاکتات را بهعنوان عامل اصلی میانجیگر تأثیرات مفید فعالیت ورزشی شدت بالا میدانند [30].
لاکتات بهنوبهخود باعث افزایش BDNF در مغز میشود. این افزایش BDNF، با بهبود خلقوخو در بیماریهای وابسته به روان و بهبود علائم بیماریهای نورونی ازجمله آلزایمر، پارکینسون و سکته مغزی در ارتباط میباشد [31]. در این راستا شیلو و همکاران در یک مطالعه فراتحلیل به بررسی تأثیر انواع تمرینات ورزشی بر عملکرد مغزی و حافظه پرداختند که در این مطالعه جامع گزارش شد تمرینات با فشار مکانیکی بالا مانند تمرینات مقاومتی بیشترین تأثیر را بر عملکرد حافظه در بیماران آلزایمری داشتند، درحالیکه تمرینات ترکیبی که شامل تمرینات مقاومتی، تداومی، تعادلی و شناختی بود، بیشترین تأثیر را بر عملکرد اجرایی و حرکتی در این بیماران داشتند [32].
سیلوا و همکاران در مطالعهای به بررسی تغییرات مهمترین مارکرهای مؤثر در بیماری آلزایمر و سالمندی پرداختند که در این مطالعه به بررسی تأثیر تمرینات هوازی با شدت بالا با وزن بدن بر مقادیر مارکرهای BDNF و Phosphorylated-TAU پرداخته شد و درنهایت مشخص شد انجام تمرینات با شدت بالا باعث افزایش معنیداری در مقادیر این عوامل و بهبود عملکرد حرکتی بیماران سالمند دچار آلزایمر شد [33]، درحالیکه اخیراً مطالعات نشان دادهاند تمرینات هوازی همراه با مهارتهای شناختی، تأثیرات مهاری بیشتری بر اختلالات ناشی از آلزایمر در افراد بالای 65 سال داشتهاند [34].
بااینحال به نظر میرسد باتوجهبه مسیرها و تأثیرات مختلف تمرینات ورزشی در این زمینه طبق مطالعات انجامشده، تمرینات با شدت بالا و فشارهای مکانیکی-متابولیکی بالاتر همراه با درگیری مهارتهای شناختی در زمینه اثرگذاری جهت کاهش و بهبود علائم بیماری آلزایمر، میتوانند دارای برتری نسبت به سایر تمرینات با شدتهای متوسط و کم باشند که علیرغم مطالعات در این زمینه همچنان به بررسی تأثیرات تمرینات ورزشی در بازههای زمانی مختلف و انواع متنوع، نیاز میباشد.
پارکینسون
پارکینسون نوعی اختلال عصبی محسوب میشود که بر اثر از دست دادن نورونهای تولیدکننده دوپامین واقع در عقدههایقاعدهای و گسترش و انباشت پروتئینی به نام آلفاسینوکلیئین در بخشهای مختلف مغز ایجاد میشود. بیماری پارکینسون شایعترین اختلال حرکتی و دومین بیماری شایع مرتبط با از دست دادن نورون در مغز بعد از آلزایمر میباشد [42].
شیوع بیماری پارکینسون در جمعیت عمومی 0/3 درصد، در افراد بالای 60 سال 1 درصد و در افراد بالای 80 سال 3 درصد گزارش شده است. ابتلا به بیماری پارکینسون قبل از 50 سالگی نادر است، اما بروز آن از دهه ششم تا نهم زندگی 5 تا 10 برابر افزایش مییابد و امکان وقوع آن در مردان 2 برابر زنان میباشد [43]. عوامل مختلفی از جمله نژاد، قومیت، ژنتیک، محیط و سبک زندگی بر احتمال وقوع بیماری پارکینسون تأثیر دارند. برایمثال تقابل ژن-محیط یکی از عوامل تأثیرگذار بر بروز این بیماری میباشد. احتمال بروز این بیماری در مردان ژاپنی و اوکیناوا تباری که در هاوایی زندگی میکنند بیشتر از مردان ساکن ژاپن بوده و این امر میتواند نشاندهنده تعامل و تأثیر ژن و محیط بر یکدیگر و ظهور بیماری پارکینسون باشد [44]. احتمال ابتلا و بروز بیماری پارکینسون در افرادی که در معرض عوامل محیطی خاصی مانند آفتکشها و آسیبهای مغزی قرار دارند بهطور قابلتوجهی بیشتر و در افراد سیگاری یا مصرفکنندگان کافئین کمتر میباشد [45].
دارودرمانی مداخله اصلی درمان بیماری پارکینسون است. لوودوپا داروی اصلی درمان پارکینسون و مؤثرترین دارو برای درمان همه علائم اصلی بیماری است. با وجود فواید زیاد و مؤثر این دارو، عوارض جانبی بسیاری با خود به همراه دارد. از طرفی پژوهشهایی با همکاری متخصصان این بیماری و فیزیولوژیستهای ورزشی انجام شده، نشان داده که انواع فعالیت و تمرینات ورزشی یکی از بهترین روشها برای کنترل و کاهش علائم بیماری میباشد [46-48].
ازآنجاییکه بیشتر مبتلایان بیماری پارکینسون در بازه سنی سالمندی هستند، تجویز پروتکل ورزشی خاص با در نظر گرفتن شرایط و ویژگیهای روانی و جسمانی افراد سالمند، از چالشهای پیشرو در این زمینه میباشد که در این زمینه به تازگی راموس و همکاران در تحقیقی به بررسی تأثیر تمرینات مقاومتی و تمرینات تناوبی با شدت بالا بر روی بیماری پارکینسون در افراد سالمند پرداختهاند که در نهایت گزارش شد انجام هر دو نوع تمرینات باعث بهبود عملکرد حرکتی و شناختی افراد سالمند دارای علائم بیماری پارکینسون شد؛ درنهایت پس از ارزیابی جامع مطالعات در این زمینه گزارش شد انجام تمرینات تناوبی با شدت بالا همراه با تمرینات مقاومتی دارای تأثیرات همافزایی (سینرژیک) بودند و باعث تغییرات بیشتر نسبت به هر کدام از این نوع تمرینات بهصورت مجزا شدند [49].
دررابطهبا تأثیر شدت تمرینات جهت افزایش قابلیتهای جسمانی و عوامل مرتبط با بیماری پارکینسون در مطالعه دیگری کاتینا و همکاران به بررسی تأثیر 10 هفته تمرینات تناوبی با شدت بالا و تمرینات تداومی با شدت متوسط پرداختند که در نهایت گزارش کردند در بیماران پارکینسون بین گروه تمرینات تناوبی با شدت بالا و تمرینات تداومی تفاوت معنیداری بین مقادیر عوامل فیزیولوژیکی مانند استقامت قلبی تنفسی و استقامت عضلانی و همچنین بین مقادیر عوامل مرتبط با بیماری پارکینسون مانند شاخص بیماری پارکینسون (UPDRS) و شاخص خستگی بیماری پارکینسون (PFS-16) ، مشاهده نشد، درحالیکه نویسندگان اشاره کردند که تمرینات با شدت بالا دارای مزایای بیشتری نسبت به تمرینات با شدت متوسط بودند [50].
بااینحال مطالعات دیگری به بررسی تأثیرات حاد تمرینات ورزشی پرداختهاند که در مطالعهای تسایی و لین به بررسی تغییرات نروترنسیمترها و عوامل عصبی-شناختی پرداختهاند که گزارش شده است تمرینات با شدت متوسط باعث افزایش معنیدار مقادیر دوپامین در بیماران پارکینسون نسبت به گروه تمرینات با شدت بالا شد، درحالیکه گزارش شد تغییرات نسبی عوامل عصبی-شناختی و نروترنسیمترها بهصورت وابسته به شدت بود و در تمرینات با شدت بالاتر این تغییرات در جهت بهبود علائم بیماری مؤثرتر به نظر میرسند (جدول شماره 2) [51].

بااینحال، طبق نتایج مطالعات در این زمینه به نظر میرسد انجام تمرینات با شدت بالاتر بهصورت نسبی، راهکار مؤثری نسبت به سایر شدت تمرینات ورزشی باشد و باتوجهبه روشهای نوین تمرینات شناختی، به نظر میرسد انجام تمرینات شناختی همراه با تمرینات با شدت بالا میتوانند دارای تأثیرات مؤثری بر بهبود علائم بیماری پارکینسون در افراد سالمند باشند.
سکته مغزی
سکته مغزی، یکی از دلایل عمده مرگ و ناتوانی طولانیمدت و اختلال شناختی قلمداد شده [57] و به اختلالات عملکردی منجر میشود [58]. میزان بروز سکته مغزی باتوجهبه ساختار سنی جمعیت موردمطالعه بسیار متفاوت است [59]. سکته مغزی دومین علت شایع مرگومیر در جهان پس از بیماری ایسکمیک قلبی است و اغلب با پیامدهای طولانیمدت ناتوانی حرکتی و اختلالات شناختی همراه است [59] و همچنین بر تمام گروههای سنی ، از قبیل نوزادان تا افراد مسن تأثیر میگذارد [60].
در بین سکتههای مغزی 80 درصد از آن را سکته مغزی ایسکمیک شامل میشود که بهعلت کاهش جریان خون مغزی با نقایص عملکردی و متابولیک همراه است [61]. سکته مغزی ایسکمیک باعث ایجاد تغییرات پاتوفیزیولوژیکی در مناطق دچار ایسکمی میشود که در مرکز ناحیهای که جریان خون آن مسدود گردیده جریان خون بهشدت کاهش مییابد و اکثر سلولها تحت آسیب شدید قرار میگیرند که قابلیت برگشتپذیری نخواهند داشت، درحالیکه نواحی دور از مرکز (پنومبرا)، بهدلیل پرفیوژن خون بهوسیله عروق جانبی حمایت میگردد و در این نواحی تغییرات مرتبط با بازتوانی سلولهای عصبی، میتواند باعث بهبود سلولهای عصبی آسیبدیده شود [62].
کاهش جریان خون در سکته مغزی ایسکمیک عمدتاً به دو فرآیند آسیب شناختی متقابل نسبت داده میشود: کاهش اکسیژنرسانی و اختلال در تأمین گلوکز به مناطق مغز آسیبدیده که این عوامل باعث فعالسازی مسیرهای پروتئولیتیکی و آپوپتوزی میشود که دلایل آن افزایش لاکتات تولیدی ناشی از مسیر گلیکولیز بیهوازی و افزایش اسیدوز، تشکیل رادیکالهای آزاد، سمیت سلولی و فعال شدن عوامل التهابی میباشد که پیامد آن اثرگذاری بر سنتز پروتئین و افزایش تخریب سلولهای عصبی خواهد بود و همچنین فقدان انرژی باعث تخریب عملکرد پمپ سدیم پتاسیم و پمپ کلسیم وابسته به انرژی و افزایش Ca++،Na+ و Cl- درون سلولی و K+ برون سلولی میگردد که تمام این عوامل به فعالسازی مسیرهای آپوپتوتیک در سلولهای مختلف موجود در سیستم عصبی، ختم خواهند شد [63].
تحقیقات جدید نشان میدهد وقوع سکته مغزی در حال افزایش بوده و از هر 4 نفر در سراسر جهان 1 نفر در طول زندگی خود سکته مغزی را تجربه میکند [64]؛ عوامل خطر مختلفی مانند وراثت، بیماریهای زمینهای مانند فشار خون و بیماریهای قلبیعروقی به افزایش بروز سکته مغزی منجر میشود که گزارش شده است افزایش سن یکی از عوامل اثرگذار بر بروز سکته مغزی میباشد. بروز سکته در بازههای سنی مختلف، متفاوت است و طبق نتایج تحقیقات در این زمینه، بروز سکته مغزی پس از سن 55 سال، با گذشت هر دهه از زندگی 2 برابر میشود [57]. دررابطهبا مهار و کاهش عوامل مرتبط با سکته مغزی، تحقیقات متعددی تابهحال صورت گرفته است که در این مطالعات از مداخلات مختلفی استفاده شده است که یکی از کمخطرترین، کمهزینهترین و مؤثرترین روش، تمرینات ورزشی شناخته شده است.
در این زمینه، مطالعات نشان دادهاند فعالیت ورزشی یک راهکار امیدوارکننده در جهت کاهش احتمال وقوع سکته و بازتوانی سریعتر پس از سکته میباشد [65] فعالیت و تمرینات ورزشی از طریق عوامل مختلف فیزیولوژیکی مانند نروژنز، آنژیوژنز، سیناپتوژنز و غیره، باعث مهار و بهبود تغییرات فیزیولوژیکی مرتبط با سالمندی و سکته مغزی میشوند [65، 66]، درحالیکه مشخص شده انواع تمرینات ورزشی با فشارهای متابولیکی، مکانیکی و روانی مختلف، دارای تأثیرات متنوعی بر عملکرد مغز در سالمندی هستند که هرکدام میتوانند باعث تحریک و مهار یک مسیر سیگنالینگ اختصاصی در جهت بهبود عملکرد عصبی مغز در سالمندی شوند (جدول شماره 3) [67].

بهطورکلی تحقیقات در زمینه تأثیر تمرینات ورزشی بر روی عوامل مرتبط با سکته مغزی بهصورت پیششرطیسازی که تأثیر تمرینات ورزشی قبل از وقوع سکته سنجیده میشود و تمرینات در دوران توانبخشی که تأثیر تمرینات پس از سکته مورد بررسی قرار میگیرد که در این خصوص مطالعات حیوانی نیز نتایج قابلتأملی را ارائه کردهاند؛ در این خصوص در مطالعهای فصیحیان و نورشاهی گزارش کردهاند تمرینات تداومی با شدت متوسط و مدت فزاینده در مقایسه با تمرینات با شدت فزاینده، دارای تأثیرات معنیداری بر مهار مسیر آپوپتوز و بهبود عملکرد حسی حرکتی پس از سکته مغزی بودند [68]. همچنین در مطالعهای بهصورت کیفی به بررسی تأثیر تمرینات در منزل توسط افراد دچار سکته مغزی و سالمند پرداخته شد که درنهایت محققان گزارش کردند انجام تمرینات پس از سکته مغزی نیازمند بررسی دقیق شرایط بیماران از جنبههای مختلفی میباشد [69].
در این راستا در تحقیق دیگری گریلی و همکاران به بررسی تأثیر تمرینات تناوبی با شدت بالا همراه با تمرینات شناختی در افراد سالمند دچار سکته مغزی پرداختند که پس از 5 جلسه گزارش کردند انجام تمرینات تناوبی با شدت بالا(HIIT) همراه با تمرینات شناختی باعث افزایش معنیدار بهبود عملکرد حرکتی و شناختی بیماران سالمند پس از سکته مغزی شد [70]. برخلاف این نتایج در پژوهشی مینجا و همکاران گزارش کردند انجام 12 هفته تمرینات هوازی با شدت متوسط نسبت گروه تمرینات دوگانه شناختی راه رفتن دارای تأثیرات معنیداری در عملکرد حرکتی و شناختی در بیماران سکته مغزی بود [71]. علاوهبر آن دررابطهبا تمرینات پیشآمادهسازی در مقاله با سکته مغزی مطالعهای در این زمینه نشان داده است تمرینات با شدت بالا دارای اثربخشی بیشتری نسبت به تمرینات با شدت متوسط هستند [72].
بااینحال باتوجهبه نتایج گزارششده توسط محققان در این زمینه، به نظر میرسد انجام تمرینات با شدت بالا همراه با تمرینات شناختی بهصورت پیششرطیسازی جهت پیشگیری از سکته مغزی، میتوانند دارای تأثیرات زیادی در جهت پیشگیری و بهبود اختلالات ناشی از سکته مغزی باشند و به نظر میرسد انجام تمرینات ورزشی در شرایط پیشآمادهسازی و توانبخشی دارای تفاوتهای وابسته بهشدت میباشند که در این خصوص نیاز به مطالعات بیشتر میباشد.
سالمندی و فعالیت ورزشی
فعالیت بدنی یک عامل بسیار مهم و تأثیرگذار بر فرآیند سالمندی میباشد. بااینحال باتوجهبه شیوههای نوین تمرینات ورزشی، تاکنون تأثیرات مختلف تمرینات ورزشی بهخوبی شناسایی نشده است [77]، درحالیکه فعالیت ورزشی بهنوبهخود با سازوکارهای مختلفی که دارد باعث بهبود قابلیتهای فیزیولوژیکی میشود که در طول فرآیند سالمندی تحت تأثیر قرار میگیرند و بهصورت پیشرونده عملکرد ارگانهای مختلف را کنترل میکنند [78]. کاهش قابلیت و عملکرد فیزیولوژیکی با افزایش احتمال بروز بیماریهای مزمن در ارتباط بوده و ازاینرو فعالیت ورزشی به یکی از بهترین روشها برای معکوس کردن تأثیرات مخرب سالمندی تبدیل شده است. در طی فرآیند سالمندی افزایش سن با اختلالات شناختی و همچنین اضطراب همراه میباشد. فعالیت ورزشی با سازوکارهای مختلف میتواند باعث کاهش استرس و افزایش تابآوری نسبت به عوامل استرسزا نیز شود [79].
طبق نتایج مطالعات انجامشده، انواع مختلف فعالیتهای ورزشی میتواند بر اختلالات پاتولوژیکی مرتبط با سالمندی و سیستم عصبی مانند بیماریهای آلزایمر، پارکینسون و سکته مغزی تأثیر چشمگیری داشته باشد. با وجود اینکه هنوز علت اصلی بروز این بیماریها بهطور کامل مشخص نشده است، اما تحقیقات توانستهاند ارتباط مثبتی بین فعالیت ورزشی و کاهش علائم این بیماریها کشف کنند. کمتحرکی یکی از مهمترین دلایل بروز بیماریهای مختلف میباشد، ازطرفی افزایش سن هم بهنوبهخود باعث کاهش تواناییهای حرکتی و جسمی میشود که این امر کمتحرکی فرد سالمند را به همراه خواهد داشت.
مطالعات در این زمینه نشان دادهاند کمتحرکی یکی از دلایل مؤثر در بروز زود هنگام بیماری آلزایمر میباشد و از طرفی فعالیت ورزشی به کاهش شاخصهای زیستی مرتبط با این بیماری، ازجمله پروتئین تاو و آمیلویید بتا در مایع مغزی-نخاعی افراد سالمند سالم منجر شده است [80]. در مطالعات بالینی مرتبط با بیماری پارکینسون نیز فعالیت ورزشی باعث بهبود علائم این بیماری شده است [81]. در این مطالعات مشاهده شده است فعالیت ورزشی با شدت بالا علاوهبر ایمن بودن، تأثیرات مثبت چشمگیری بر شاخصههای بیماری پارکینسون داشته است [82]. همچنین مطالعات حیوانی در این زمینه نشان دادهاند فعالیت ورزشی از طریق حفاظت از نورونهای تولیدکننده دوپامین، میتوکندریها و جلوگیری از تجمع پروتئین آلفاسینوکلئین باعث بهبود عملکرد حرکتی و علائم مرتبطه با بیماری پارکینسون میشوند [83، 84].
درخصوص تأثیر فعالیت ورزشی بر سکته مغزی نیز مطالعات بسیاری انجام شده است. مطالعات بالینی اخیر نشان دادهاند فعالیت ورزشی تأثیر مثبتی بر پیشگیری از وقوع سکته و همچنین پیامدهای ناشی از آن در صورت وقوع سکته دارد که همچنین گزارش شده است شدت سکته در افراد فعال کمتر بوده و بهبود پس از سکته نیز در افراد فعال بهتر از افراد غیرفعال میباشد [85، 86]. فعالیت ورزشی از طریق افزایش خونرسانی و بهبود انتشار خون به مغز نقش پیشگیریکننده در وقوع سکته دارد و همچنین در بهبود آسیبهای وارده پس از وقوع سکته مؤثر میباشد [31، 72]. فعالیت ورزشی میتواند باعث بهبود متابولیسم گلوکز مغز، افزایش ظرفیت آنتیاکسیدانی، سطح هموگلوبین، پاسخهای التهابی و مرتبط با سیستم ایمنی، تعدیل غلظت نوروتروفینها و پپتیدهای در گردش خون و همچنین کاهش غلظت پروتئین تاو و سطح کورتیزول شود [87].
درخصوصی طراحی و تجویز فعالیت ورزشی، دو مؤلفه بسیار مهم شامل حجم و شدت فعالیت میباشند که باتوجهبه هدف تمرین متغیر خواهد بود. شدت فعالیت ورزشی نقش مهمی در میانجیگری اثرات مثبت ورزش بر اعمال شناختی دارد. مطالعات نشان دادهاند تنها تمرینات ورزشی با شدت متوسط و بالا میتوانند تأثیرات چشمگیری بر اعمال شناختی داشته باشند [88]. مقایسه تمرینات تناوبی با شدت بالا و شدت متوسط تداومی نشان داد هرچه شدت فعالیت بیشتر باشد بهبود بیشتری در عملکرد قلبی تنفسی ایجاد خواهد شد و این امر میتواند کارکرد بهتر اعمال شناختی را با خود به همراه داشته باشد [89]. درخصوص حجم تمرین نیز نتایج تقریباً مشابهای یافت شد که نشان میدهد افزایش حجم تمرین با بهبود بیشتر عملکرد قلبی-تنفسی و اعمال شناختی همراه بوده است [90].
نکته حائز اهمیت درخصوص حجم و شدت تمرین، تأثیرگذاری آن بر عملکرد سیستم عصبی میباشد. شدت و حجم بالاتر تمرینات با رعایت اصول تمرین (اضافه بار) میتواند بهبود بیشتری در عملکرد سیستم عصبی ایجاد کند که این اصل خود یک عامل تأثیرگذار بر اعمال شناختی میباشد که در تمرینات دوره توانبخشی و هم تمرینات پیشآماداهسازی مرتبط با سکته مغزی از اهمیت بالایی برخوردارند [91، 92]. در بیماری پارکینسون نیز نتایج مشابهی یافت شده است که نشان میدهد حجم و شدت فعالیت ورزشی نقش مهمی در مدیریت بیماری پارکینسون ایفا میکنند، بهطوریکه ورزش هوازی با شدت بالا در مقایسه با شدت متوسط در کاهش سرعت پیشرفت بیماری مؤثرتر بوده است و همچنین حجم بیشتر فعالیت بدنی با کاهش خطر ابتلا به بیماری پارکینسون مرتبط میباشد [93].
دررابطهبا سکته مغزی نیز براساس نتایج بهدستآمده در مطالعات، تمرینات ورزشی با شدت کم در فاز حاد تا 1 هفته پس از سکته مغزی و تمرینات با شدت بالا در فاز مزمن، بیش از 1 هفته پس از سکته مغزی میتواند برای رشد سلولهای عصبی آسیبدیده مفید باشد. فعالیتهای ورزشی با حجم و شدت فزاینده را میتوان یک استراتژی مناسب برای بهرهمندی از این اثرات مفید در نظر گرفت [65، 94].
سالمندی و تمرینات دوگانه
تمرینات دوگانه شامل تمریناتی میباشند که اعمال شناختی و حرکتی فرد را بهصورت همزمان درگیر میکنند. مطالعات نشان دادهاند این نوع تمرینات میتوانند تأثیرات مفید بسیاری بر سالمندی بگذارند [95]. ترکیب تمرینات هوازی همراه با تمرینات مهارتی و شناختی میتواند یکی از بهترین روشها برای بهبود اعمال شناختی و حرکتی افراد در طول دوره سالمندی باشد [96]. سازوکار مؤثر این تمرینات از طریق اصول یادگیری حرکتی و انجام وظیفه میباشد. افراد با انجام این تمرینات قابلیتهای شناختی و حرکتی خود را برای انجام کارهای روزانه افزایش میدهند. مطالعات نشان دادهاند این تمرینات میتواند باعث افزایش نوروپلاستیسیتی و رگزایی در بخشهای مختلفی از مغز شود، ازاینرو روش تمرینی مناسب و بهینهای برای به حداقل رساندن تأثیرات مخرب سالمندی میباشد [97، 98]. در این راستا هانگ و همکاران در یک مطالعه فراتحلیلی گزارش کردند که انجام تمرینات دوگانه در افراد سالمند باعث تغییرات معنیداری در قابلیت شناختی و عملکرد حرکتی شد [99].
ازلحاظ اصول فیزیولوژیکی انجام تمرینات با فشارهای متابولیکی همراه با تمرینات شناختی و مهارتی باعث درگیری سیستم عصبی مرکزی و همچنین سایر ارگانهای اسکلتی-عضلانی و قلبی-تنفسی میشود که به نظر میرسد انجام همزمان این نوع تمرینات نسبت به تمرینات بهصورت مجزا، دارای اثربخشی بسیار زیادتری بر سیستم عصبی و اختلالات ایجادشده در اثر سالمندی مانند بیماریهای آلزایمر، پارکینسون و سکته مغزی خواهند بود که در تحقیقی در این زمینه لانگهارتس و همکاران در یک مطالعه به بررسی تأثیر تمرینات دوگانه بر روی بیماران پارکینسون و آلزایمر پرداختند که درنهایت گزارش کردند انجام تمرینات دوگانه باعث تغییرات متفاوتی بین بیماریهای آلزایمر و پارکینسون شد، درحالیکه باعث بهبود قابلیتهای حرکتی و شناختی در هر دو گروه شد [100].
بااینحال علیرغم مشخص شدن تأثیرات تمرینات دوگانه و در نظر گرفتن فرضیه مرتبط با فعالسازی عصبی و شناختی از لحاظ فیزیولوژیکی، به نظر میرسد انجام این نوع تمرینات دارای برتری چشمگیری نسبت به تمرینات استقامتی و قدرتی بهصورت مجزا باشند، درحالیکه تاکنون مطالعات محدودی در این زمینه صورت گرفته است و از لحاظ کاربردی در بسیاری از مراکز درمانی سالمندان، همچنان از روشهای سنتی تمرینات ورزشی استفاده میشود که در این صورت به نظر میرسد انجام تحقیقات گسترده و دقیقتر در این زمینه جهت تجویز بهترین نوع تمرینات برای افراد سالمند و دارای اختلالات عصبی، موردنیاز میباشد.
یافتهها
نتایج بررسی مروری مطالعه حاضر نشان داد بهطورکلی انجام تمرینات ورزشی باعث بهبود و پیشگیری اختلالات مغزی در بین افراد سالمند میشود که در این بین تمرینات ورزشی باتوجهبه فشارهای متابولیکی، مکانیکی و درگیری قسمتهای مختلف سیستم عصبی مرکزی، میتوانند تأثیرات متفاوتی را بر سلولهای عصبی و عملکرد شناختی داشته باشند. طبق نتایج مطالعات گسترده در این زمینه، تمرینات ورزشی ترکیبی که مسیرهای مختلف فیزیولوژیکی مانند درگیری عملکرد شناختی، تعادلی، قدرتی و حرکتی را دربر میگیرند، میتوانند تأثیرات جامعتری نسبت به سایر تمرینات ورزشی که تنها یک عامل فیزیولوژیکی را دربر میگیرند، داشته باشند.
بحث
باتوجهبه افزایش جمعیت سالمندان در جوامع مختلف، اخیراً مداخلات زیادی در جهت مهار سیر رو به رشد عوامل پاتولوژیک در سالمندان مورد بررسی قرار گرفته است که طبق بررسی مطالعات انجامشده در این زمینه، مشخص شده است در بین عوامل فیزیولوژیکی مرتبط با سالمندی، تغییرات ساختاری و عملکردی سیستم عصبی مرکزی، نقش کلیدی در فرایند سالمندی را بازی میکند که در این بین گزارشهای متعددی نشان دادهاند که تمرینات ورزشی در مهار اختلالات سیستم عصبی در سالمندی نقش مهمی دارند.
از عمده اختلالات عصبی ناشی از سالمندی میتوان آلزایمر، پارکینسون و سکته مغزی را نام برد که بهطور شگفت انگیزی هر کدام از انواع تمرینات ورزشی میتوانند اختصاصاً بر روی یک مسیر خاص، تأثیرات خود را جهت مهار فیزیولوژیکی این نوع اختلالات عصبی، لحاظ کنند؛ بهطورمثال مشخص شده است در سالمندی مقادیر عامل نروتروفیک مشتق از مغز که در بازسازی و محافظت از سلولهای عصبی نقش دارد کاهش مییابد [35] و در اثر انجام تمرینات ورزشی این عامل در مغز افزایش مییابد که در بین تمرینات ورزشی، مشخص شده است تمرینات ورزشی با شدت بالاتر باعث ترشح بیشتر این عامل مهم جهت مهار پیشرونده زوال سلولهای عصبی از طریق فرایند نروژنز، محافظت نرونی، مهار آپوپتوز در سالمندی شود [37].
در این راستا در مطالعهای به بررسی تغییرات مهمترین مارکرهای مؤثر در بیماری آلزایمر و سالمندی، پرداخته شده است که در این مطالعه به بررسی تأثیر تمرینات هوازی با شدت بالا با وزن بدن بر مقادیر مارکرهای BDNF و phosphorylated-TAU پرداخته شد و درنهایت مشخص شد انجام تمرینات با شدت بالا باعث افزایش معنیداری در مقادیر این عوامل و بهبود عملکرد حرکتی بیماران سالمند دچار آلزایمر شد [33]، درحالیکه مشخص شده است انجام تمرینات شناختی همراه با هرگونه از تمرینات جسمانی با شدتهای مختلف، میتواند اثربخشی تمرینات ورزشی را چندین برابر کند [43]. در مطالعهای بوردهاوس و همکاران گزارش کردهاند که انجام تمرینات مقاومتی با شدت فزاینده+تمرینات شناختی کامپیوتری باعث تغییرات حرکتی و شناختی معنیداری نسبت به گروههای تمرینات مجزا در افراد سالمند شد [48].
همچنین، دررابطهبا تأثیر انواع مختلف تمرینات ورزشی بر روی بیماری پارکینسون در دوران سالمندی در تحقیقی به بررسی تأثیر تمرینات مقاومتی و تمرینات تناوبی با شدت بالا بر روی بیماری پارکینسون در افراد سالمند پرداخته شد که درنهایت گزارش شد انجام هر دو نوع تمرینات HIIT و تمرینات مقاومتی، باعث بهبود عملکرد حرکتی و شناختی افراد سالمند دارای علائم بیماری پارکینسون شد؛ درنهایت پس از ارزیابی جامع مطالعات در این زمینه مشخص شد انجام تمرینات تناوبی با شدت بالا همراه با تمرینات مقاومتی دارای تأثیرات همافزایی (سینرژیک) بودند و باعث تغییرات بیشتر نسبت به هر کدام از این نوع تمرینات بهصورت مجزا شدند [49].
در مقابل، مطالعه دیگری که به بررسی تأثیر انواع شدتهای تمرینات ورزشی بر بهبود اختلالات ناشی از بیماری پارکینسون در سالمندان پرداخت، نشان داد تفاوت معنیداری بین شدت تمرینات ورزشی در بهبود اختلالات عصبی ناشی از بیماری پارکینسون مرتبط با سالمندی وجود نداشت [59]. ازطرفی، دررابطهبا اختلالات ناشی از سکته مغزی نیز انواع تمرینات ورزشی با شدتهای مختلف نیز تاکنون مورد بررسیهای زیادی قرار گرفته است؛ بهعنوانمثال، تحقیقی گریلی و همکاران به بررسی تأثیر تمرینات تناوبی با شدت بالا همراه با تمرینات شناختی در افراد سالمند دچار سکته مغزی پرداختند که پس از 5 جلسه گزارش کردند انجام تمرینات HIIT همراه با تمرینات شناختی باعث افزایش معنیدار بهبود عملکرد حرکتی و شناختی بیماران سالمند پس از سکته مغزی شد [70]. برخلاف این نتایج در پژوهشی مینجا و همکاران گزارش کردند انجام 12 هفته تمرینات هوازی با شدت متوسط نسبت گروه تمرینات دوگانه شناختی راه رفتن دارای تأثیرات معنیداری در عملکرد حرکتی و شناختی در بیماران سکته مغزی بود [71].
بااینحال، دررابطهبا تمرینات پیشآمادهسازی در مقابله با سکته مغزی مطالعهای در این زمینه نشان داده است که تمرینات با شدت بالا دارای اثربخشی بیشتری نسبت به تمرینات با شدت متوسط هستند [72]. به نظر میرسد با در نظر گرفتن مسیرهای متعدد و متفاوت فیزیولوژیکی و پاتولوژیکی در سیستم عصبی مرکزی در افراد سالمند، هر کدام از انواع تمرینات ورزشی میتوانند باعث بهبود مسیر سیگنالینگ خاص در سلولهای عصبی شوند که بهطورکلی طبق بررسی انجامشده در این مطالعه مروری، به نظر میرسد انجام تمرینات جسمانی همراه با تمرینات شناختی، میتوانند بهترین راهکار جهت محافظت نرونی، مهار عوامل مخرب سلولهای عصبی شود. بااینحال، بهعنوان محدودیتهای اصلی در این زمینه میتوان به عدم مطالعات و تحقیقات کافی با در نظر گرفتن بررسی بین تمرینات جسمانی، شناختی و ترکیبی (جسمانی+شناختی) در جامعه آماری سالمند با انواع بیماریهای عصبی، اشاره کرد که پیشنهاد میشود در مطالعات آینده این موارد بیشتر مورد توجه محققان در زمینه اختلالات عصبی ناشی از سالمندی و انجام مداخلات ورزشی جهت شناخت بهترین روش تمرینات ورزشی و تجویز آن به بیماران و مراکز درمانی مرتبط با افراد سالمند، قرار گیرد.
نتیجهگیری نهایی
ازآنجاییکه فرآیند سالمندی با کاهش قابلیتهای عملکردی و شناختی همراه است، انجام تمرینات ورزشی نیز با محدودیتها و چالشهای زیادی مواجه است. بهطورکلی نتایج تحقیقات نشان میدهد فعالیت بدنی منظم به هر شکلی که باشد: انجام فعالیت بدنی در خانه، یوگا، تمرین در آب، تایچی، تمرین مقاومتی و ورزشهای هوازی همگی با افزایش جریان خون مغزی و رگزایی، موجب تغییرات مناسبی در ساختار و عملکرد مغز شده و بدین ترتیب موجب بهبود شناخت میشوند. میزان این تغییرات بستگی بهشدت یا مدت فعالیت بدنی دارد، چون در شدتهای بالاتر میزان لاکتات در مایع مغزی -نخاعی بالا رفته، میزان رگزایی و BDNF تولیدی را افزایش میدهد که این فرایندها موجب تغییرات سیناپسزایی و نورونزایی در نواحی مختلف مغزی میشود که احتمال وقوع ایسکمی و سکته مغزی را کاهش و از زوال مغز محافظت میکنند و احتمال بروز پارکینسون و سایر بیماریهای شناختی کاهش مییابد، اما نکته حائز اهمیت در مورد تجویز تمرینات شدت بالا برای سالمندان، امکانپذیری و بیخطر بودن آنها میباشد که نیاز حضور مداوم سالمندان در مکانهای مناسب ورزشی با نظارت مستقیم فیزیولوژیستهای ورزش را میطلبد که با اجرای آزمونهای سلامت درجه و شدت ورزش را برای سالمندان تعیین کنند.
ایجاد مکانهای ورزشی مناسب، امکانات حملونقل مناسب سالمندان از محل زندگی به مکانهای ورزشی ،امکان برگزاری آزمونهای مناسب و تعیین شدت و کنترل شدت تمرینات ورزشی توسط متخصصین فیزیولوژیست ورزش در اولویتهای برنامهریزی برای سالمندان قرار دارد و بهطورکلی انجام تمرینات شناختی همراه با تمرینات با فشارهای مکانیکی و متابولیکی مختلف به نظر میرسد یک راهکار مناسب جهت حداکثر بهرهوری از تمرینات ورزشی برای افراد سالمند در نظر گرفته شود و درنهایت به نظر میرسد انجام تمرینات بهصورت متنوع با در نظر گرفتن شدت، مدت و نوع فعالیت بدنی مختلف میتواند مسیرهای مهم فیزیولوژیکی را فعال نموده و بهترین تأثیرات را از لحاظ فیزیولوژیکی بر سیستم عصبی افراد سالمند، اعمال کند که به این دلیل پیشنهاد میشود جهت مشاهده بیشترین تأثیر تمرینات ورزشی، باتوجهبه اصل ویژگی تمرینات ورزشی از تمامی طیف تمرینات مانند تمرینات تداومی با شدت متوسط، تمرینات تناوبی با شدت بالا، تمرینات مقاومتی، بهصورت همزمان با تمرینات شناختی، در برنامهریزی تمرینات جهت مهار و پیشگیری اختلالات عصبی در افراد سالمند استفاده شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این یک مطالعه مروری است و هیچ آزمایشی بر روی نمونههای انسانی یا حیوانی انجام نشده است. بنابراین، به تأیید اخلاقی نیاز نبود.
حامی مالی
این مقاله برگرفته از رساله دکترای معین فصیحیان است و هیچگونه کمک مالی خاصی از سازمانهای تأمین مالی در بخشهای دولتی، تجاری یا غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور یکسان در مفهوم و طراحی مطالعه، جمعآوری و تجزیهوتحلیل دادهها، تفسیر نتایج و تهیه پیشنویس مقاله مشارکت داشتند.
تعارض منافع
در این مطالعه هیچ گونه تضاد منافعی وجود ندارد.
References
- Guo J, Huang X, Dou L, Yan M, Shen T, Tang W, Li J. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Signal Transduction and Targeted Therapy. 2022; 7(1):391. [DOI:10.1038/s41392-022-01251-0] [PMID]
- United Nations. World population ageing 2019. New York: United Nations; 2020. [Link]
- Kennedy BK, Berger SL, Brunet A, Campisi J, Cuervo AM, Epel ES, et al. Geroscience: linking aging to chronic disease. Cell. 2014; 159(4):709-13. [DOI:10.1016/j.cell.2014.10.039] [PMID]
- Zia A, Pourbagher-Shahri AM, Farkhondeh T, Samarghandian S. Molecular and cellular pathways contributing to brain aging. Behavioral and Brain Functions. 2021; 17(1):6. [DOI:10.1186/s12993-021-00179-9] [PMID]
- Sutkowy P, Woźniak A, Mila-Kierzenkowska C, Szewczyk-Golec K, Wesołowski R, Pawłowska M, et al. Physical activity vs. redox balance in the brain: Brain health, aging and diseases. Antioxidants. 2021; 11(1):95. [DOI:10.3390/antiox11010095] [PMID]
- Stillman CM, Esteban-Cornejo I, Brown B, Bender CM, Erickson KI. Effects of exercise on brain and cognition across age groups and health states. Trends in Neurosciences. 2020; 43(7):533-43. [DOI:10.1016/j.tins.2020.04.010] [PMID]
- Arksey H, O’Malley L. Scoping studies: Towards a methodological framework. International Journal of Social Research Methodology. 2005; 8(1):19-32. [DOI:10.1080/1364557032000119616]
- Fjell AM, McEvoy L, Holland D, Dale AM, Walhovd KB; Alzheimer's Disease Neuroimaging Initiative. What is normal in normal aging? Effects of aging, amyloid and Alzheimer’s disease on the cerebral cortex and the hippocampus. Progress in Neurobiology. 2014; 117:20-40. [DOI:10.1016/j.pneurobio.2014.02.004] [PMID]
- Grady C. The cognitive neuroscience of ageing. Nature Reviews Neuroscience. 2012; 13(7):491-505. [DOI:10.1038/nrn3256] [PMID]
- Cabeza R, Albert M, Belleville S, Craik FI, Duarte A, Grady CL, et al. Maintenance, reserve and compensation: The cognitive neuroscience of healthy ageing. Nature Reviews Neuroscience. 2018; 19(11):701-10. [DOI:10.1038/s41583-018-0068-2] [PMID]
- Villemagne VL, Burnham S, Bourgeat P, Brown B, Ellis KA, Salvado O, et al. Amyloid β deposition, neurodegeneration, and cognitive decline in sporadic Alzheimer’s disease: A prospective cohort study. The Lancet Neurology. 2013; 12(4):357-67. [DOI:10.1016/S1474-4422(13)70044-9] [PMID]
- Levy G. The relationship of Parkinson disease with aging. Archives of Neurology. 2007; 64(9):1242-6. [DOI:10.1001/archneur.64.9.1242] [PMID]
- López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013; 153(6):1194-217. [DOI:10.1016/j.cell.2013.05.039] [PMID]
- Shan ZY, Liu JZ, Sahgal V, Wang B, Yue GH. Selective atrophy of left hemisphere and frontal lobe of the brain in old men. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2005; 60(2):165-74. [DOI:10.1093/gerona/60.2.165] [PMID]
- Guo T, Zhang D, Zeng Y, Huang TY, Xu H, Zhao Y. Molecular and cellular mechanisms underlying the pathogenesis of Alzheimer’s disease. Molecular Neurodegeneration. 2020; 15(1):40. [DOI:10.1186/s13024-020-00391-7] [PMID]
- Long JM, Holtzman DM. Alzheimer disease: An update on pathobiology and treatment strategies. Cell. 2019; 179(2):312-39. [DOI:10.1016/j.cell.2019.09.001] [PMID]
- Alzheimer's Association. 2018 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia. 2018; 14(3):367-429. [DOI:10.1016/j.jalz.2018.02.001]
- van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, et al. Lecanemab in Early Alzheimer's Disease. The New England Journal of Medicine. 2023; 388(1):9-21. [DOI:10.1056/NEJMoa2212948] [PMID]
- López-Ortiz S, Valenzuela PL, Seisdedos MM, Morales JS, Vega T, Castillo-García A, et al. Exercise interventions in Alzheimer's disease: A systematic review and meta-analysis of randomized controlled trials. Ageing Research Reviews. 2021; 72:101479. [DOI:10.1016/j.arr.2021.101479] [PMID]
- van Praag H, Christie BR, Sejnowski TJ, Gage FH. Running enhances neurogenesis, learning, and long-term potentiation in mice. Proceedings of the National Academy of Sciences of The United States of America. 1999; 96(23):13427-31. [DOI:10.1073/pnas.96.23.13427] [PMID]
- Greenberg ME, Xu B, Lu B, Hempstead BL. New insights in the biology of BDNF synthesis and release: Implications in CNS function. Journal of Neuroscience. 2009; 29(41):12764-7. [DOI:10.1523/JNEUROSCI.3566-09.2009] [PMID]
- Park H, Poo MM. Neurotrophin regulation of neural circuit development and function. Nature Reviews Neuroscience. 2013; 14(1):7-23. [DOI:10.1038/nrn3379] [PMID]
- Loprinzi PD, Frith E. A brief primer on the mediational role of BDNF in the exercise-memory link. Clinical Physiology and Functional Imaging. 2019; 39(1):9-14. [DOI:10.1111/cpf.12522] [PMID]
- Kuipers SD, Bramham CR. Brain-derived neurotrophic factor mechanisms and function in adult synaptic plasticity: New insights and implications for therapy. Current Opinion in Drug Discovery and Development. 2006; 9(5):580-6. [PMID]
- Salehpour M, Khodagholi F, Zeinaddini Meymand A, Nourshahi M, Ashabi G. Exercise training with concomitant nitric oxide synthase inhibition improved anxiogenic behavior, spatial cognition, and BDNF/P70S6 kinase activation in 20-month-old rats. Applied Physiology, Nutrition, and Metabolism. 2018; 43(1):45-53. [DOI:10.1139/apnm-2017-0313] [PMID]
- MacPherson RE. Filling the void: A role for exercise-induced BDNF and brain amyloid precursor protein processing. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2017; 313(5):R585-93. [DOI:10.1152/ajpregu.00255.2017] [PMID]
- Neeper SA, Góauctemez-Pinilla F, Choi J, Cotman C. Exercise and brain neurotrophins. Nature. 1995; 373(6510):109.[DOI:10.1038/373109a0] [PMID]
- Reycraft JT, Islam H, Townsend LK, Hayward GC, Hazell TJ, MacPherson REK. Exercise intensity and recovery on circulating brain-derived neurotrophic factor. Medicine and Science in Sports and Exercise. 2020; 52(5):1210-7. [DOI:10.1249/MSS.0000000000002242] [PMID]
- Dinoff A, Herrmann N, Swardfager W, Lanctot KL. The effect of acute exercise on blood concentrations of brain-derived neurotrophic factor in healthy adults: A meta-analysis. European Journal of Neuroscience. 2017; 46(1):1635-46. [DOI:10.1111/ejn.13603] [PMID]
- Hashimoto T, Tsukamoto H, Ando S, Ogoh S. Effect of exercise on brain health: The potential role of lactate as a myokine. Metabolites. 2021; 11(12):813. [DOI:10.3390/metabo11120813] [PMID]
- Nay K, Smiles WJ, Kaiser J, McAloon LM, Loh K, Galic S, et al. Molecular mechanisms underlying the beneficial effects of exercise on brain function and neurological disorders. International Journal of Molecular Sciences. 2021; 22(8):4052. [DOI:10.3390/ijms22084052] [PMID]
- Lv S, Wang Q, Liu W, Zhang X, Cui M, Li X, et al. Comparison of various exercise interventions on cognitive function in Alzheimer’s patients: A network meta-analysis. Archives of Gerontology and Geriatrics. 2023; 115:105113. [DOI:10.1016/j.archger.2023.105113] [PMID]
- da Silva VF, Ribeiro DEC, Borges CJ, de Aquino Freire I, Militão AG, Delani D, et al. High-intensity body weight interval training modifies neurochemistry in ad disease: Preliminary data from a randomized control trial. Brain Disorders. 2024; 15:100159. [DOI:10.1016/j.dscb.2024.100159]
- Yamasaki T. Preventive strategies for cognitive decline and dementia: Benefits of aerobic physical activity, especially open-skill exercise. Brain Sciences. 2023; 13(3):521. [DOI:10.3390/brainsci13030521] [PMID]
- Delgado-Peraza F, Nogueras-Ortiz C, Simonsen AH, Knight DLD, Yao PJ, Goetzl EJ, et al. Neuron-derived extracellular vesicles in blood reveal effects of exercise in Alzheimer’s disease. Alzheimer’s Research & Therapy. 2023; 15(1):156. [DOI:10.1186/s13195-023-01303-9] [PMID]
- Frederiksen KS, Jensen CS, Høgh P, Gergelyffy R, Waldemar G, Andersen BB, et al. Aerobic exercise does not affect serum neurofilament light in patients with mild Alzheimer’s disease. Frontiers in Neuroscience. 2023; 17:1108191. [DOI:10.3389/fnins.2023.1108191] [PMID]
- Vidoni ED, Perales J, Alshehri M, Giles AM, Siengsukon CF, Burns JM. Aerobic exercise sustains performance of instrumental activities of daily living in early-stage Alzheimer’s disease. Journal of Geriatric Physical Therapy (2001). 2019; 42(3):E129-34. [DOI:10.1519/JPT.0000000000000172] [PMID]
- Cezar NOC, Ansai JH, Oliveira MPB, da Silva DCP, Gomes WL, Barreiros BA, et al. Feasibility of improving strength and functioning and decreasing the risk of falls in older adults with Alzheimer's dementia: A randomized controlled home-based exercise trial. Archives of Gerontology and Geriatrics. 2021; 96:104476. [DOI:10.1016/j.archger.2021.104476] [PMID]
- Broadhouse KM, Singh MF, Suo C, Gates N, Wen W, Brodaty H, et al. Hippocampal plasticity underpins long-term cognitive gains from resistance exercise in MCI. NeuroImage: Clinical. 2020; 25:102182. [DOI:10.1016/j.nicl.2020.102182] [PMID]
- Yu F, Vock DM, Zhang L, Salisbury D, Nelson NW, Chow LS, et al. Cognitive effects of aerobic exercise in Alzheimer’s disease: A pilot randomized controlled trial. Journal of Alzheimer’s Disease. 2021; 80(1):233-44. [DOI:10.3233/JAD-201100] [PMID]
- Krause-Sorio B, Siddarth P, Kilpatrick L, Milillo MM, Aguilar-Faustino Y, Ercoli L, et al. Yoga prevents gray matter atrophy in women at risk for Alzheimer’s disease: A randomized controlled Trial. Journal of Alzheimer’s Disease. 2022; 87(2):569-81. [DOI:10.3233/JAD-215563] [PMID]
- Zaman V, Shields DC, Shams R, Drasites KP, Matzelle D, Haque A, et al. Cellular and molecular pathophysiology in the progression of Parkinson’s disease. Metabolic Brain Disease. 2021; 36(5):815-27. [DOI:10.1007/s11011-021-00689-5] [PMID]
- Lee A, Gilbert RM. Epidemiology of Parkinson disease. Neurologic Clinics. 2016; 34(4):955-65. [DOI:10.1016/j.ncl.2016.06.012] [PMID]
- Morens DM, Davis JW, Grandinetti A, Ross GW, Popper JS, White LR. Epidemiologic observations on Parkinson’s disease: Incidence and mortality in a prospective study of middle-aged men. Neurology. 1996; 46(4):1044-50. [DOI:10.1212/WNL.46.4.1044] [PMID]
- Ascherio A, Schwarzschild MA. The epidemiology of Parkinson’s disease: Risk factors and prevention. The Lancet Neurology. 2016; 15(12):1257-72. [DOI:10.1016/S1474-4422(16)30230-7] [PMID]
- Mak MK, Wong-Yu IS, Shen X, Chung CL. Long-term effects of exercise and physical therapy in people with Parkinson disease. Nature Reviews Neurology. 2017; 13(11):689-703. [DOI:10.1038/nrneurol.2017.128] [PMID]
- Tsukita K, Sakamaki-Tsukita H, Takahashi R. Long-term effect of regular physical activity and exercise habits in patients with early Parkinson disease. Neurology. 2022; 98(8):e859-e71. [DOI:10.1212/WNL.0000000000013218] [PMID]
- Feng YS, Yang SD, Tan ZX, Wang MM, Xing Y, Dong F, et al. The benefits and mechanisms of exercise training for Parkinson’s disease. Life Sciences. 2020; 245:117345. [DOI:10.1016/j.lfs.2020.117345] [PMID]
- Ramos TL, de Sousa Fernandes MS, da Silva Fidelis DE, de Carvalho Martins JC, Filho EMAA, do Nascimento HR, et al. Impacts of High-Intensity Aerobic and Resistance Training on Functional Capacity of Patients with Parkinson’s Disease: A Systematic Review. Revista de Educação Física / Journal of Physical Education. 2020; 93(1):5-20. [Link]
- Kathia MM, Duplea SG, Bommarito JC, Hinks A, Leake E, Shannon J, et al. High-intensity interval versus moderate-intensity continuous cycling training in Parkinson's disease: A randomized trial. Journal of Applied Physiology. 2024; 137(3):603-15. [DOI:10.1152/japplphysiol.00219.2024] [PMID]
- Tsai CL, Lin TK. High-intensity interval vs. continuous moderate-intensity aerobic exercise for improving neurotransmitter level and neurocognitive performance in individuals with Parkinson’s disease. Mental Health and Physical Activity. 2023; 24:100516. [DOI:10.1016/j.mhpa.2023.100516]
- Sacheli MA, Neva JL, Lakhani B, Murray DK, Vafai N, Shahinfard E, et al. Exercise increases caudate dopamine release and ventral striatal activation in Parkinson’s disease. Movement Disorders. 2019; 34(12):1891-900. [DOI:10.1002/mds.27865] [PMID]
- Chen Y, Chen Y. The impact of combined aerobic and resistance exercise on the prognosis of early Parkinson’s disease patients. Technology and Health Care. 2025; 33(1):205-14. [DOI:10.3233/THC-240]
- van der Kolk NM, de Vries NM, Kessels RPC, Joosten H, Zwinderman AH, Post B, et al. Effectiveness of home-based and remotely supervised aerobic exercise in Parkinson's disease: A double-blind, randomised controlled trial. The Lancet. Neurology. 2019; 18(11):998-1008. [DOI:10.1016/S1474-4422(19)30285-6] [PMID]
- Johansson ME, Cameron IGM, Van der Kolk NM, de Vries NM, Klimars E, Toni I, et al. Aerobic exercise alters brain function and structure in parkinson's disease: A randomized controlled trial. Annals of Neurology. 2022; 91(2):203-16. [DOI:10.1002/ana.26291] [PMID]
- Kwok JYY, Kwan JCY, Auyeung M, Mok VCT, Lau CKY, Choi KC, et al. Effects of mindfulness yoga vs stretching and resistance training exercises on anxiety and depression for people with parkinson disease: A randomized clinical trial. JAMA Neurology. 2019; 76(7):755-63. [DOI:10.1001/jamaneurol.2019.0534] [PMID]
- Kalaria RN, Akinyemi R, Ihara M. Stroke injury, cognitive impairment and vascular dementia. Biochimica et Biophysica Acta. 2016; 1862(5):915-25. [DOI:10.1016/j.bbadis.2016.01.015] [PMID]
- Pan J, Konstas AA, Bateman B, Ortolano GA, Pile-Spellman J. Reperfusion injury following cerebral ischemia: Pathophysiology, MR imaging, and potential therapies. Neuroradiology. 2007; 49(2):93-102. [DOI:10.1007/s00234-006-0183-z] [PMID]
- Lan C, Chen X, Zhang Y, Wang W, Wang WE, Liu Y, et al. Curcumin prevents strokes in stroke-prone spontaneously hypertensive rats by improving vascular endothelial function. BMC Cardiovascular Disorders. 2018; 18(1):43. [DOI:10.1186/s12872-018-0768-6] [PMID]
- Musuka TD, Wilton SB, Traboulsi M, Hill MD. Diagnosis and management of acute ischemic stroke: Speed is critical. CMAJ. 2015; 187(12):887-93. [DOI:10.1503/cmaj.140355] [PMID]
- Sridharan SE, Unnikrishnan JP, Sukumaran S, Sylaja PN, Nayak SD, Sarma PS, et al. Incidence, types, risk factors, and outcome of stroke in a developing country: The Trivandrum Stroke Registry. Stroke. 2009; 40(4):1212-8. [DOI:10.1161/STROKEAHA.108.531293] [PMID]
- Khoshnam SE, Winlow W, Farzaneh M, Farbood Y, Moghaddam HF. Pathogenic mechanisms following ischemic stroke. Neurological Sciences. 2017; 38(7):1167-86. [DOI:10.1007/s10072-017-2938-1] [PMID]
- Schurr A. Energy metabolism, stress hormones and neural recovery from cerebral ischemia/hypoxia. Neurochemistry International. 2002; 41(1):1-8. [DOI:10.1016/S0197-0186(01)00142-5] [PMID]
- Paul S, Candelario-Jalil E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Experimental Neurology. 2021; 335:113518. [DOI:10.1016/j.expneurol.2020.113518] [PMID]
- Fasihiyan M, Taheri M, Ebrahim K, Nourshahi M. [Review of the effect of different types of exercise on cellular-molecular changes of neurons in the rehabilitation period after ischemic stroke (Persian)]. Razi Journal of Medical Sciences. 2022; 29(6):89-104. [Link]
- Morland C, Andersson KA, Haugen ØP, Hadzic A, Kleppa L, Gille A, et al. Exercise induces cerebral VEGF and angiogenesis via the lactate receptor HCAR1. Nature Communications. 2017; 8:15557. [DOI:10.1038/ncomms15557] [PMID]
- Chen FT, Hopman RJ, Huang CJ, Chu CH, Hillman CH, Hung TM, et al. The effect of exercise training on brain structure and function in older adults: A systematic review based on evidence from randomized control trials. Journal of Clinical Medicine. 2020; 9(4):914. [DOI:10.3390/jcm9040914] [PMID]
- Fasihiyan M, Nourshahi M. Continuous exercises with different intensities and effectiveness on the anti-apoptotic BAX/BCL-2/Caspase-3 pathway in the rehabilitation period after stroke in male Sprague-Dawley rats. Sport Physiology. 2023; 15(60):87-106. [DOI:10.22089/spj.2024.15390.2274]
- Zhang Y, Qiu X, Jin Q, Ji C, Yuan P, Cui M, et al. Influencing factors of home exercise adherence in elderly patients with stroke: A multiperspective qualitative study. Frontiers in Psychiatry. 2023; 14:1157106. [DOI:10.3389/fpsyt.2023.1157106] [PMID]
- Greeley B, Larssen BC, Ferris J, Yeganeh NM, Andrushko JW, Chau B, et al. High-intensity exercise paired with motor practice benefits cognitive performance in stroke and older adults. MedRxiv. 2023. [Link]
- Maeneja R, Silva CR, Ferreira IS, Abreu AM. Aerobic physical exercise versus dual-task cognitive walking in cognitive rehabilitation of people with stroke: A randomized clinical trial. Frontiers in Psychology. 2023; 14:1258262. [DOI:10.3389/fpsyg.2023.1258262] [PMID]
- Rezaei R, Nasoohi S, Haghparast A, Khodagholi F, Bigdeli MR, Nourshahi M. High intensity exercise preconditioning provides differential protection against brain injury following experimental stroke. Life Sciences. 2018; 207:30-5. [DOI:10.1016/j.lfs.2018.03.007] [PMID]
- Yeh TT, Chang KC, Wu CY, Chen CJ, Chuang IC. Clinical efficacy of aerobic exercise combined with computer-based cognitive training in stroke: A multicenter randomized controlled trial. Topics in Stroke Rehabilitation. 2022; 29(4):255-64. [DOI:10.1080/10749357.2021.1922045] [PMID]
- Wu WX, Zhou CY, Wang ZW, Chen GQ, Chen XL, Jin HM, et al. Effect of early and intensive rehabilitation after ischemic stroke on functional recovery of the lower limbs: A pilot, randomized trial. Journal of Stroke and Cerebrovascular Diseases : The Official Journal of National Stroke Association. 2020; 29(5):104649. [DOI:10.1016/j.jstrokecerebrovasdis.2020.104649] [PMID]
- Liu-Ambrose T, Falck RS, Dao E, Best JR, Davis JC, Bennett K, et al. Effect of exercise training or complex mental and social activities on cognitive function in adults with chronic stroke: A randomized clinical trial. JAMA Network Open. 2022; 5(10):e2236510. [DOI:10.1001/jamanetworkopen.2022.36510] [PMID]
- Zheng G, Zheng X, Li J, Duan T, Ling K, Tao J, Chen L. Effects of tai chi on cerebral hemodynamics and health-related outcomes in older community adults at risk of ischemic stroke: a randomized controlled trial. Journal of Aging and Physical Activity. 2019; 27(5):678-87. [DOI:10.1123/japa.2018-0232] [PMID]
- Pedersen BK, Saltin B. Exercise as medicine-evidence for prescribing exercise as therapy in 26 different chronic diseases. Scandinavian Journal of Medicine & Science in Sports. 2015; 25(Suppl 3):1-72. [DOI:10.1111/sms.12581] [PMID]
- Fleg JL, Morrell CH, Bos AG, Brant LJ, Talbot LA, Wright JG, et al. Accelerated longitudinal decline of aerobic capacity in healthy older adults. Circulation. 2005; 112(5):674-82. [DOI:10.1161/CIRCULATIONAHA.105.545459] [PMID]
- Babaei A, Nourshahi M, Fani M, Entezari Z, Jameie SB, Haghparast A. The effectiveness of continuous and interval exercise preconditioning against chronic unpredictable stress: Involvement of hippocampal PGC-1α/FNDC5/BDNF pathway. Journal of Psychiatric Research. 2021; 136:173-83. [DOI:10.1016/j.jpsychires.2021.02.006] [PMID]
- Liang KY, Mintun MA, Fagan AM, Goate AM, Bugg JM, Holtzman DM, et al. Exercise and Alzheimer’s disease biomarkers in cognitively normal older adults. Annals of Neurology. 2010; 68(3):311-8. [DOI:10.1002/ana.22096] [PMID]
- Frazzitta G, Balbi P, Maestri R, Bertotti G, Boveri N, Pezzoli G. The beneficial role of intensive exercise on Parkinson disease progression. American Journal of Physical Medicine & Rehabilitation. 2013; 92(6):523-32. [DOI:10.1097/PHM.0b013e31828cd254] [PMID]
- Schenkman M, Moore CG, Kohrt WM, Hall DA, Delitto A, Comella CL, et al. Effect of high-intensity treadmill exercise on motor symptoms in patients with de novo Parkinson disease: A phase 2 randomized clinical trial. JAMA Neurology. 2018; 75(2):219-26. [DOI:10.1001/jamaneurol.2017.3517] [PMID]
- Lau YS, Patki G, Das-Panja K, Le WD, Ahmad SO. Neuroprotective effects and mechanisms of exercise in a chronic mouse model of Parkinson’s disease with moderate neurodegeneration. European Journal of Neuroscience. 2011; 33(7):1264-74. [DOI:10.1111/j.1460-9568.2011.07626.x] [PMID]
- Shin MS, Kim TW, Lee JM, Ji ES, Lim BV. Treadmill exercise alleviates nigrostriatal dopaminergic loss of neurons and fibers in rotenone-induced Parkinson rats. Journal of Exercise Rehabilitation. 2017; 13(1):30-5. [DOI:10.12965/jer.1734906.453] [PMID]
- Schmidt W, Endres M, Dimeo F, Jungehulsing GJ. Train the vessel, gain the brain: Physical activity and vessel function and the impact on stroke prevention and outcome in cerebrovascular disease. Cerebrovascular Diseases. 2013; 35(4):303-12. [DOI:10.1159/000347061] [PMID]
- Kramer SF, Hung SH, Brodtmann A. The impact of physical activity before and after stroke on stroke risk and recovery: A narrative review. Current Neurology and Neuroscience Reports. 2019; 19(6):28. [DOI:10.1007/s11910-019-0949-4] [PMID]
- Abdullahi A, Wong TW, Ng SS. Understanding the mechanisms of disease modifying effects of aerobic exercise in people with Alzheimer’s disease. Ageing Research Reviews. 2024; 94:102202. [DOI:10.1016/j.arr.2024.102202] [PMID]
- Müller P, Duderstadt Y, Lessmann V, Müller NG. Lactate and BDNF: Key mediators of exercise induced neuroplasticity? Journal of Clinical Medicine. 2020; 9(4):1136. [DOI:10.3390/jcm9041136] [PMID]
- Kovacevic A, Fenesi B, Paolucci E, Heisz JJ. The effects of aerobic exercise intensity on memory in older adults. Applied Physiology, Nutrition, and Metabolism. 2020; 45(6):591-600. [DOI:10.1139/apnm-2019-0495] [PMID]
- Vidoni ED, Johnson DK, Morris JK, Van Sciver A, Greer CS, Billinger SA, et al. Dose-response of aerobic exercise on cognition: A community-based, pilot randomized controlled trial. Plos One. 2015; 10(7):e0131647. [DOI:10.1371/journal.pone.0131647] [PMID]
- Heisz JJ, Waddington EE. The principles of exercise prescription for brain health in aging. Exercise, Sport, and Movement. 2023; 2(1):1-5. [DOI:10.1249/ESM.0000000000000019]
- Taheri M, Ebrahim K, Nemati J. The effect of precondition with continuous and high-intensity interval training on angiogenic factors in the td-MCAO stroke model. Sport Physiology. 2023; 15(59):97-114. [DOI:10.22089/spj.2024.15898.2290]
- Langeskov-Christensen M, Franzén E, Grøndahl Hvid L, Dalgas U. Exercise as medicine in Parkinson's disease. Journal of Neurology, Neurosurgery, and Psychiatry. 2024; 95(11):1077-88. [DOI:10.1136/jnnp-2023-332974] [PMID]
- Alehossein P, Taheri M, Tayefeh Ghahremani P, Dakhlallah D, Brown CM, Ishrat T, et al. Transplantation of exercise-induced extracellular vesicles as a promising therapeutic approach in ischemic stroke. Translational Stroke Research. 2023; 14(2):211-37. [DOI:10.1007/s12975-022-01025-4] [PMID]
- Brustio PR, Rabaglietti E, Formica S, Liubicich ME. Dual-task training in older adults: The effect of additional motor tasks on mobility performance. Archives of Gerontology and Geriatrics. 2018; 75:119-24. [DOI:10.1016/j.archger.2017.12.003] [PMID]
- Uysal İ, Başar S, Aysel S, Kalafat D, Büyüksünnetçi AÖ. Aerobic exercise and dual-task training combination is the best combination for improving cognitive status, mobility and physical performance in older adults with mild cognitive impairment. Aging Clinical and Experimental Research. 2023; 35(2):271-81. [DOI:10.1007/s40520-022-02321-7] [PMID]
- Jardim NYV, Bento-Torres NVO, Costa VO, Carvalho JPR, Pontes HTS, Tomás AM, et al. Dual-task exercise to improve cognition and functional capacity of healthy older adults. Frontiers in Aging Neuroscience. 2021; 13:589299. [DOI:10.3389/fnagi.2021.589299] [PMID]
- Wollesen B, Voelcker-Rehage C. Training effects on motor-cognitive dual-task performance in older adults. European Review of Aging and Physical Activity. 2014; 11(1):5-24. [DOI:10.1007/s11556-013-0122-z]
- Hong XL, Cheng LJ, Feng RC, Goh J, Gyanwali B, Itoh S, et al. Effect of physio-cognitive dual-task training on cognition in pre-ageing and older adults with neurocognitive disorders: A meta-analysis and meta-regression of randomized controlled trial. Archives of Gerontology and Geriatrics. 2024; 116:105161. [DOI:10.1016/j.archger.2023.105161] [PMID]
- Longhurst JK, Rider JV, Cummings JL, John SE, Poston B, Landers MR. Cognitive-motor dual-task interference in Alzheimer’s disease, Parkinson’s disease, and prodromal neurodegeneration: A scoping review. Gait & Posture. 2023; 105:58-74. [DOI:10.1016/j.gaitpost.2023.07.277] [PMID]
نوع مطالعه: مقاله مروری |
موضوع مقاله:
سالمند شناسی
دریافت: 1403/6/28 | پذیرش: 1403/9/5 | انتشار: 1404/12/10
دریافت: 1403/6/28 | پذیرش: 1403/9/5 | انتشار: 1404/12/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |