دوره 13، شماره 1 - ( بهار 1397 )
جلد 13 شماره 1 صفحات 85-74 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammadi R, Fathei M, Hejazi K. Effect of Eight-Weeks Aerobic Training on Serum Levels of Nitric Oxide and Endothelin-1 in Overweight Elderly Men . Salmand: Iranian Journal of Ageing 2018; 13 (1) :74-85
URL: http://salmandj.uswr.ac.ir/article-1-1323-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-1323-fa.html
محمدی رضا، فتحی مهرداد، حجازی کیوان. تأثیر هشت هفته تمرین تناوبی هوازی بر سطح سرمی نیتریک اکساید و اندوتلین-1 مردان سالمند با اضافه وزن. سالمند: مجله سالمندی ایران. 1397; 13 (1) :74-85
رضا محمدی1 
 ، مهرداد فتحی*2
، مهرداد فتحی*2 

 ، کیوان حجازی3
، کیوان حجازی3 


 ، مهرداد فتحی*2
، مهرداد فتحی*2 

 ، کیوان حجازی3
، کیوان حجازی3 

1- گروه تربیت بدنی، دانشکده علوم انسانی، واحد بجنورد، دانشگاه آزاد اسلامی، بجنورد، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی مشهد، مشهد، ایران. ،mfathei@um.ac.ir
3- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، موسسه آموزش عالی توس، مشهد، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی مشهد، مشهد، ایران. ،
3- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، موسسه آموزش عالی توس، مشهد، ایران.
متن کامل [PDF 2735 kb]
(4078 دریافت)
| چکیده (HTML) (13784 مشاهده)
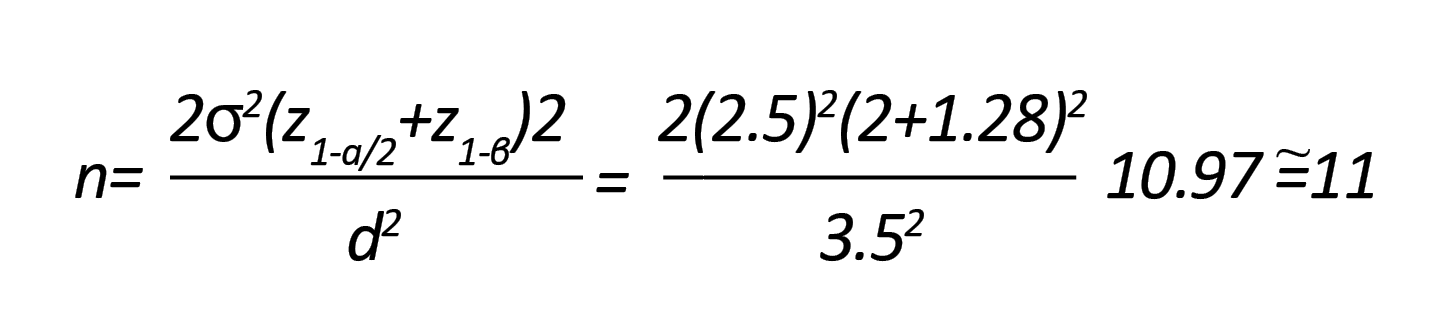
References
متن کامل: (8060 مشاهده)
مقدمه
بیماریهای قلبیعروقی مهمترین عامل مرگومیر در جهان است. بروز این بیماری بر اثر رسوب تدریجی کلسترول (یکی از انواع چربیهای خون) و دیگر چربیها و مواد در دیواره داخلی سرخرگهای (شریان) بدن است و باعث ایجاد پلاک هایی در جدار این عروق میشود که به تنگ، سفت و سختشدن دیواره رگها منجر خواهد شد [1]. اگرچه بسیاری از عوامل خطرساز بیماریهای قلبیعروقی شناخته شده است، تخمین زده میشود که 17 میلیون انسان در سال 1995 به دلیل این بیماری فوت کردهاند که بیشتر آنها را افراد مسن تشکیل میدادند [2].
سالمندی موجب تغییر در عملکرد متابولیکی، قلبیعروقی و عصبی عضلانی میشود. از آنجا که با افزایش سن، تحرک بدنی کاهش مییابد، این روند به طور عمده با تغییرات اساسی در ترکیب بدن همراه است [3]. با افزایش سن، قلب با سفتشدن عضله قلب به علت افزایش اندازه سلولهای عضلانی بطنها همراه با کاهش تعداد این سلولها مواجه میشود. همچنین، ماتریکس بین سلولی و کلاژن زیاد میشود و ماهیچه قلب دچار فیبروز میشود [4].
منشأ اغلب بیماریهای قلبیعروقی التهاب است؛ از این رو، تحریکات عروقی و آسیبهای آن در نتیجه مصرف برخی مواد به طور مستقیم و در پارهای موارد نظیر افزایش فشار برشی به طور غیرمستقیم سبب افزایش حساسیت مولکولهای آندوتلیال عروق نظیر اندوتلین-1 و نیتریک اکسید میشود [5]. اندوتلین-1 نوعی پپتید منقبضکننده قوی عروق است که سلولهای اندوتلیال آن را تولید میکنند و تأثیر انقباضی قوی در سلولهای اندوتلیال عروق انسان دارد [6]. تاکنون دو نوع گیرنده اندوتلین انسانی، نوع A و نوع B، شناخته شدهاند.گیرندههای اندوتلین A بیشتر در قلب و عضلات صاف عروق وجود دارند. همچنین این نوع گیرنده واسطه اصلی انقباض عروق با اندوتلین است، درصورتیکه اندوتلین نوع B که توزیع بیشتری دارد، عمدتاً در کلیه، سیستم عصبی مرکزی و سلولهای اندوتلیال عروق یافت میشود و موجب تولید نیتریک اکسید میشود[7]. همچنین از جمله مواد مترشحه از اندوتلیوم عروق اکسید نیتریک است که در حفظ سلامت دیواره عروق و تنظیم عملکرد تنگکنندگی و گشادکنندگی عروق تأثیر زیادی دارد. اکسید نیتریک وزنی معادل 30 کیلودالتون دارد و آنزیم نیتریک اکسید سنتاز از ال- آرژنین، آن را تولید میکند [8].
این بیماری در اثر عوامل خطر قابل تعدیل در سنین کمتر ایجاد میشود، به طوری که فقدان فعالیت بدنی خطر رویداد بیماریهای قلبیعروقی را حداقل تا دوبرابر افزایش میدهد. این در حالی است که بیتحرکی مشکلی جهانی برای سلامت جامعه است. زندگی بیتحرک علت عمده مرگومیر، بیماری و ناتوانی است؛ هر ساله حدود دو میلیون مرگ به علت فقدان فعالیت جسمانی اتفاق میافتد [9]. در این زمینه، جارت و همکاران که تأثیر 24 جلسه تمرین هوازی، هر جلسه 30 تا 40 دقیقه برای مدت هشت هفته با شدت معادل صددرصد MLSS به صورت فزاینده پارامترهای استرس اکسیداتیو زنان یائسه را بررسی کردند، به این نتیجه رسیدند که وزن بدن، فشار خون سیتولی و دیاستولی کاهش معنیدار یافت. همچنین افزایش 7/37 درصدی در نیتریک اکساید و 8/30 درصدی در غلظت cGMP دیده شد. تغییر معنیداری در سطوح کورتیزول، لپتین، ADMA اینترلوکین 1 بتا دیده نشد. تغییری در سطوح مالون دی آلدوئید (MDA) و کاتالاز نیز در پایان دوره دیده نشد اما افزایش معنی داری را در سوپراکسیداتیو دیس موتاز مشاهده کردند [10].
کراسو و همکاران با بررسی 16 هفته تمرینات هوازی با شدتهای متفاوت کم، 30-40 درصد حداکثر اکسیژن مصرفی و متوسط 55 تا 65 درصد حداکثر اکسیژن مصرفی برای مدت 30 دقیقه در هر جلسه و 3 جلسه در هفته، روی 25 مرد با دامنه سنی 52 سال و چاق، به این نتیجه رسیدند که تمرین به عدمتغییر معنیداری در ترکیب بدن و آمادگی جسمانی شرکتکنندگان منجر شد، اما اجرای تمرینات با شدت متوسط به افزایش نیتریک اکسید در مردان منجر شد [11].
مداخله فعالیتهای بدنی منظم، رژیمهای غذایی، مشاورههای بهداشتی و دارو درمانی از جمله راههایی است که تا به حال برای پیشگیری و درمان بیماری قلبیعروقی مطرح شدهاند [12]. با این حال، سالمندی فرایندی زیستشناختی است که با تغییرات و مشکلاتی در بدن انسان از جمله بیماریهای قلبیعروقی و در رأس آنها پرفشاری خون و مشکلات عروق کرونری همراه است که ممکن است زندگی فرد را محدود کند. در این میان بیشتر متخصصان بهداشتی و علوم تندرستی درباره روش فعالیت بدنی و رژیم غذایی به عنوان اصولیترین و علمیترین روش کاهش علائم بیماریهای قلبیعروقی اتفاق نظر دارند [13]. آنها شرکتکردن در فعالیتهای بدنی منظم برای پیشگیری و درمان بسیاری از بیماریها، از جمله بیماریهای قلبیعروقی قبل از شروع دارودرمانی، مشاوره تمرینی و تغذیهای را پیشنهاد میکنند.
با توجه به بررسیهای انجامشده، مطالعات اندکی اثر تمرینات تناوبی هوازی بر سطح این شاخصها را بررسی کردهاند. بنابراین هدف محقق از این تحقیق، بررسی تأثیر هشت هفته تمرین تناوبی هوازی بر سطوح برخی عوامل خطرزای قلبیعروقی مردان سالمند با اضافه وزن بود.
روش مطالعه
آزمودنیها
مطالعه حاضر از نوع نیمهتجربی باکنترل و از لحاظ هدف کاربردی است که با طرح پیشآزمون و پسآزمون انجام شد. نمونه آماری این تحقیق شامل 24 مرد سالمند ساکن شهرستان بجنورد در سال 1395 با دامنه سنی 68 تا 79 سال و با معیار اضافه وزن بود. شرکتکنندگان باید نمایه توده بدنی بین 25 تا 30 کیلوگرم بر مترمربع میداشتند. همچنین به روش نمونهگیری انتخابی در دسترس و هدفدار انتخاب شدند. نخست افراد با ماهیت و نحوه همکاری با اجرای پژوهش آشنا شدند. از بین مراجعهکنندگان 100 نفر داوطلب پرسشنامه تندرستی و بدنی را کامل کردند و پس از تجزیهوتحلیل پرسش نامه، 24 نفر حائز شرایط برای شرکت در پژوهش انتخاب شدند. برای رعایت ملاحظات اخلاقی، ضمن آشنایی آزمودنیها با تمام مراحل اجرای پژوهش از قبیل برنامههای تمرینی و ارزیابیهای آزمایشگاهی، قبل از تکمیل فرم رضایتنامه به آنها توضیح داده شد که اطلاعات دریافتی به صورت محرمانه خواهد بود. همچنین آنها می توانستند در صورت تمایل در هر مرحلهای از مطالعه خارج شوند.
سالمبودن بر اساس پرسشنامه تندرستی، مصرفنکردن دارو، عدماستعمال دخانیات و شرکتنکردن در هیچ برنامه تمرینی حداقل به مدت دو ماه پیش از شرکت در برنامه تمرینات از معیارهای ورود به این تحقیق بود. همچنین ازجمله معیارهای خروج آزمودنیها از پژوهش حاضر شامل ابتلا به بیماریهای قلبیعروقی، دیابت، اختلالات نورولوژیک، فشار خون و حضورنداشتن در برنامه تمرینی مدنظر در دو جلسه متوالی یا سه جلسه غیرمتوالی بود. آزمودنیها بر اساس شرایط تحقیق به صورت داوطلبانه در تحقیق شرکت و فرم رضایتنامه را امضا کردند. در این پژوهش سطح فعالیت جسمانی افراد با استفاده از پرسشنامه ارزیابی فعالیت جسمانی کیزر مشخص شد [14]. این پرسشنامه عادات و الگوهای فعالیت جسمانی را ارزیابی کرد و شامل چهار بخش فعالیتهای مربوط به امور خانه و مراقبت از خانواده، فعالیتهای شغلی، عادات زندگی فعال و مشارکت در ورزش است. آینس ورث و همکاران در سال 1999 این ابزار اندازهگیری را برای زنان گروه سنی 65-20 سال تأیید کردند و اعتبار درونی آن، 83/∙=α کرونباخ به دست آمد. بر اساس این پرسشنامه، زنانیکه در کارهای عادی و روزمره زندگی خود فعالیت جسمانی کمی داشتند و ورزشکار نبودند؛ یعنی 5-3 سال سابقه ورزشی منظم نداشتند و در دو ماه اخیر بیش از یک جلسه در هفته ورزش نکرده بودند، وارد پژوهش شدند [14]. سپس آزمودنیها به طور تصادفی به دو گروه تمرین تناوبی هوازی (12 نفر) و گروه کنترل (12 نفر) تقسیم شدند. در این مطالعه برای تعیین حجم نمونه از معادله برآورد حجم نمونه فلیس [15] استفاده شد:
بیماریهای قلبیعروقی مهمترین عامل مرگومیر در جهان است. بروز این بیماری بر اثر رسوب تدریجی کلسترول (یکی از انواع چربیهای خون) و دیگر چربیها و مواد در دیواره داخلی سرخرگهای (شریان) بدن است و باعث ایجاد پلاک هایی در جدار این عروق میشود که به تنگ، سفت و سختشدن دیواره رگها منجر خواهد شد [1]. اگرچه بسیاری از عوامل خطرساز بیماریهای قلبیعروقی شناخته شده است، تخمین زده میشود که 17 میلیون انسان در سال 1995 به دلیل این بیماری فوت کردهاند که بیشتر آنها را افراد مسن تشکیل میدادند [2].
سالمندی موجب تغییر در عملکرد متابولیکی، قلبیعروقی و عصبی عضلانی میشود. از آنجا که با افزایش سن، تحرک بدنی کاهش مییابد، این روند به طور عمده با تغییرات اساسی در ترکیب بدن همراه است [3]. با افزایش سن، قلب با سفتشدن عضله قلب به علت افزایش اندازه سلولهای عضلانی بطنها همراه با کاهش تعداد این سلولها مواجه میشود. همچنین، ماتریکس بین سلولی و کلاژن زیاد میشود و ماهیچه قلب دچار فیبروز میشود [4].
منشأ اغلب بیماریهای قلبیعروقی التهاب است؛ از این رو، تحریکات عروقی و آسیبهای آن در نتیجه مصرف برخی مواد به طور مستقیم و در پارهای موارد نظیر افزایش فشار برشی به طور غیرمستقیم سبب افزایش حساسیت مولکولهای آندوتلیال عروق نظیر اندوتلین-1 و نیتریک اکسید میشود [5]. اندوتلین-1 نوعی پپتید منقبضکننده قوی عروق است که سلولهای اندوتلیال آن را تولید میکنند و تأثیر انقباضی قوی در سلولهای اندوتلیال عروق انسان دارد [6]. تاکنون دو نوع گیرنده اندوتلین انسانی، نوع A و نوع B، شناخته شدهاند.گیرندههای اندوتلین A بیشتر در قلب و عضلات صاف عروق وجود دارند. همچنین این نوع گیرنده واسطه اصلی انقباض عروق با اندوتلین است، درصورتیکه اندوتلین نوع B که توزیع بیشتری دارد، عمدتاً در کلیه، سیستم عصبی مرکزی و سلولهای اندوتلیال عروق یافت میشود و موجب تولید نیتریک اکسید میشود[7]. همچنین از جمله مواد مترشحه از اندوتلیوم عروق اکسید نیتریک است که در حفظ سلامت دیواره عروق و تنظیم عملکرد تنگکنندگی و گشادکنندگی عروق تأثیر زیادی دارد. اکسید نیتریک وزنی معادل 30 کیلودالتون دارد و آنزیم نیتریک اکسید سنتاز از ال- آرژنین، آن را تولید میکند [8].
این بیماری در اثر عوامل خطر قابل تعدیل در سنین کمتر ایجاد میشود، به طوری که فقدان فعالیت بدنی خطر رویداد بیماریهای قلبیعروقی را حداقل تا دوبرابر افزایش میدهد. این در حالی است که بیتحرکی مشکلی جهانی برای سلامت جامعه است. زندگی بیتحرک علت عمده مرگومیر، بیماری و ناتوانی است؛ هر ساله حدود دو میلیون مرگ به علت فقدان فعالیت جسمانی اتفاق میافتد [9]. در این زمینه، جارت و همکاران که تأثیر 24 جلسه تمرین هوازی، هر جلسه 30 تا 40 دقیقه برای مدت هشت هفته با شدت معادل صددرصد MLSS به صورت فزاینده پارامترهای استرس اکسیداتیو زنان یائسه را بررسی کردند، به این نتیجه رسیدند که وزن بدن، فشار خون سیتولی و دیاستولی کاهش معنیدار یافت. همچنین افزایش 7/37 درصدی در نیتریک اکساید و 8/30 درصدی در غلظت cGMP دیده شد. تغییر معنیداری در سطوح کورتیزول، لپتین، ADMA اینترلوکین 1 بتا دیده نشد. تغییری در سطوح مالون دی آلدوئید (MDA) و کاتالاز نیز در پایان دوره دیده نشد اما افزایش معنی داری را در سوپراکسیداتیو دیس موتاز مشاهده کردند [10].
کراسو و همکاران با بررسی 16 هفته تمرینات هوازی با شدتهای متفاوت کم، 30-40 درصد حداکثر اکسیژن مصرفی و متوسط 55 تا 65 درصد حداکثر اکسیژن مصرفی برای مدت 30 دقیقه در هر جلسه و 3 جلسه در هفته، روی 25 مرد با دامنه سنی 52 سال و چاق، به این نتیجه رسیدند که تمرین به عدمتغییر معنیداری در ترکیب بدن و آمادگی جسمانی شرکتکنندگان منجر شد، اما اجرای تمرینات با شدت متوسط به افزایش نیتریک اکسید در مردان منجر شد [11].
مداخله فعالیتهای بدنی منظم، رژیمهای غذایی، مشاورههای بهداشتی و دارو درمانی از جمله راههایی است که تا به حال برای پیشگیری و درمان بیماری قلبیعروقی مطرح شدهاند [12]. با این حال، سالمندی فرایندی زیستشناختی است که با تغییرات و مشکلاتی در بدن انسان از جمله بیماریهای قلبیعروقی و در رأس آنها پرفشاری خون و مشکلات عروق کرونری همراه است که ممکن است زندگی فرد را محدود کند. در این میان بیشتر متخصصان بهداشتی و علوم تندرستی درباره روش فعالیت بدنی و رژیم غذایی به عنوان اصولیترین و علمیترین روش کاهش علائم بیماریهای قلبیعروقی اتفاق نظر دارند [13]. آنها شرکتکردن در فعالیتهای بدنی منظم برای پیشگیری و درمان بسیاری از بیماریها، از جمله بیماریهای قلبیعروقی قبل از شروع دارودرمانی، مشاوره تمرینی و تغذیهای را پیشنهاد میکنند.
با توجه به بررسیهای انجامشده، مطالعات اندکی اثر تمرینات تناوبی هوازی بر سطح این شاخصها را بررسی کردهاند. بنابراین هدف محقق از این تحقیق، بررسی تأثیر هشت هفته تمرین تناوبی هوازی بر سطوح برخی عوامل خطرزای قلبیعروقی مردان سالمند با اضافه وزن بود.
روش مطالعه
آزمودنیها
مطالعه حاضر از نوع نیمهتجربی باکنترل و از لحاظ هدف کاربردی است که با طرح پیشآزمون و پسآزمون انجام شد. نمونه آماری این تحقیق شامل 24 مرد سالمند ساکن شهرستان بجنورد در سال 1395 با دامنه سنی 68 تا 79 سال و با معیار اضافه وزن بود. شرکتکنندگان باید نمایه توده بدنی بین 25 تا 30 کیلوگرم بر مترمربع میداشتند. همچنین به روش نمونهگیری انتخابی در دسترس و هدفدار انتخاب شدند. نخست افراد با ماهیت و نحوه همکاری با اجرای پژوهش آشنا شدند. از بین مراجعهکنندگان 100 نفر داوطلب پرسشنامه تندرستی و بدنی را کامل کردند و پس از تجزیهوتحلیل پرسش نامه، 24 نفر حائز شرایط برای شرکت در پژوهش انتخاب شدند. برای رعایت ملاحظات اخلاقی، ضمن آشنایی آزمودنیها با تمام مراحل اجرای پژوهش از قبیل برنامههای تمرینی و ارزیابیهای آزمایشگاهی، قبل از تکمیل فرم رضایتنامه به آنها توضیح داده شد که اطلاعات دریافتی به صورت محرمانه خواهد بود. همچنین آنها می توانستند در صورت تمایل در هر مرحلهای از مطالعه خارج شوند.
سالمبودن بر اساس پرسشنامه تندرستی، مصرفنکردن دارو، عدماستعمال دخانیات و شرکتنکردن در هیچ برنامه تمرینی حداقل به مدت دو ماه پیش از شرکت در برنامه تمرینات از معیارهای ورود به این تحقیق بود. همچنین ازجمله معیارهای خروج آزمودنیها از پژوهش حاضر شامل ابتلا به بیماریهای قلبیعروقی، دیابت، اختلالات نورولوژیک، فشار خون و حضورنداشتن در برنامه تمرینی مدنظر در دو جلسه متوالی یا سه جلسه غیرمتوالی بود. آزمودنیها بر اساس شرایط تحقیق به صورت داوطلبانه در تحقیق شرکت و فرم رضایتنامه را امضا کردند. در این پژوهش سطح فعالیت جسمانی افراد با استفاده از پرسشنامه ارزیابی فعالیت جسمانی کیزر مشخص شد [14]. این پرسشنامه عادات و الگوهای فعالیت جسمانی را ارزیابی کرد و شامل چهار بخش فعالیتهای مربوط به امور خانه و مراقبت از خانواده، فعالیتهای شغلی، عادات زندگی فعال و مشارکت در ورزش است. آینس ورث و همکاران در سال 1999 این ابزار اندازهگیری را برای زنان گروه سنی 65-20 سال تأیید کردند و اعتبار درونی آن، 83/∙=α کرونباخ به دست آمد. بر اساس این پرسشنامه، زنانیکه در کارهای عادی و روزمره زندگی خود فعالیت جسمانی کمی داشتند و ورزشکار نبودند؛ یعنی 5-3 سال سابقه ورزشی منظم نداشتند و در دو ماه اخیر بیش از یک جلسه در هفته ورزش نکرده بودند، وارد پژوهش شدند [14]. سپس آزمودنیها به طور تصادفی به دو گروه تمرین تناوبی هوازی (12 نفر) و گروه کنترل (12 نفر) تقسیم شدند. در این مطالعه برای تعیین حجم نمونه از معادله برآورد حجم نمونه فلیس [15] استفاده شد:
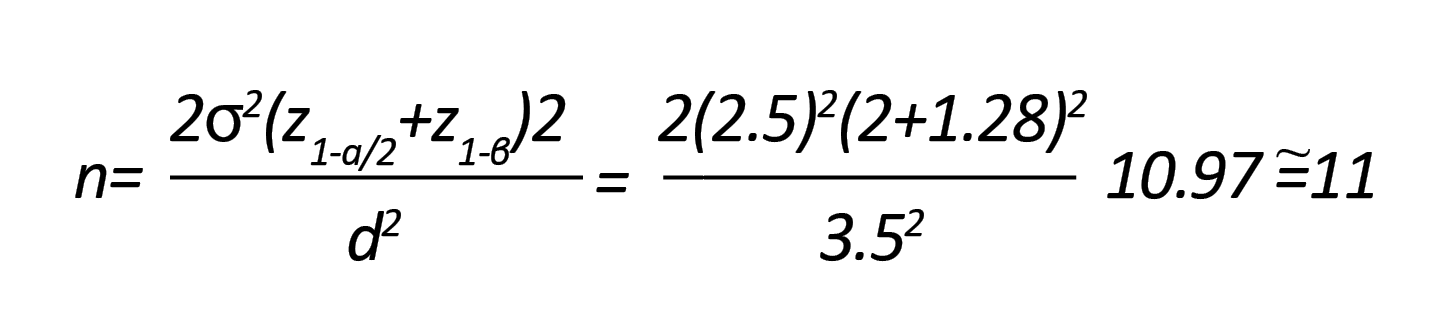
در این معادله؛ توان آزمون 0/8 و آلفای معادل 0/05 و تغییرات میانگین پنج واحد در نظر گرفته شد. براساس برآورد صورتگرفته، حجم نمونه، 10/97 نفر به دست آمد که با احتیاط بیشتر از میان مردان سالمند داوطلب، 12 مرد سالمند تحت عنوان گروه مداخله انتخاب شدند.
ترکیب بدن
در این تحقیق برای ارزیابی ترکیبات بدن به ترتیب طول قد آزمودنیها با قدسنج سکا (ساخت کشور آلمان) با حساسیت پنج میلیمتر، محیط باسن و کمر با متر نواری (مابیس- ژاپن) با دقت پنج میلیمتر، وزن با حساسیت صد گرم و درصد چربی بدن با دستگاه بیوالکتریکال ایمپدنس (مدل In body-720 کره جنوبی) اندازهگیری شد. از تقسیم وزن بدن بر مجذور قد به متر، نمایه توده بدن بر حسب کیلوگرم بر مترمربع به دست آمد. تمامی اندازهگیریها در حالی انجام شد که آزمودنیها از چهار ساعت قبل از آزمون از خوردن و آشامیدن خودداری کرده بودند و تا حد ممکن مثانه، معده و روده آنها تخلیه شده بود.
نمونه خونی
یکی از کارشناسان مجرب علوم آزمایشگاهی در دو وهله نمونههای خونی از سیاهرگ دست چپ هر یک از آزمودنی در وضعیت نشسته و در حالت استراحت در 48 ساعت پیش از شروع تمرینات و 48 ساعت بعد از آخرین جلسه تمرین را جمعآوری کرد. در هر دو نوبت پیش و پس از تمرین، پنج سیسی خون از ورید آنتیکوبیتال بازویی گرفته شد و نمونهها در دمای 18- درجه سانتیگراد فریز شدند. برای تعیین میزان اندوتلین-1 از روش الایزا و کیت کازابایو ساخت شرکت ژاپن استفاده شد. همچنین سطوح نیتریک اکساید (NO) سرم نیز با استفاده از کیت زلابیو ساخت کشور آلمان سنجیده شد.
برنامه تمرینی
در این تحقیق فعالیت ورزشی شامل تمرینات تناوبی هوازی به مدت هشت هفته و در هر هفته سه جلسه و هر جلسه به مدت 45 تا 60 دقیقه بود. برنامه تمرین تناوبی شدید شامل گرمکردن با انواع حرکات کششی و نرمشی به مدت 10 دقیقه و سپس اجرای حرکات تناوبی شدید با دو دقیقه استراحت فعال میان هر ست بود. برنامه تمرینی از ساده به مشکل و با در نظر گرفتن اصل اضافه بار و با افزایش شدت تمرین اجرا شد.
الگوی تمرین تناوبی شدید به این صورت بود: در هفته اول، سه وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته دوم، چهار وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته سوم، پنج وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته چهارم، شش وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته پنجم، هفت وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته ششم، هشت وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته هفتم، شش وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال و هفته هشتم، پنج وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال انجام شد. شدت تمرین با ضربان سنج (پُلار ساخت کشور فنلاند) کنترل شد [16]. گروه کنترل هیچ فعالیتی در طول دوره تحقیق نداشتند و غیرفعال بودند (شیوه زندگی غیرفعال داشتند).
در پایان مرحله اجرایی پژوهش، دادههای جمعآوریشده با کمک نرم افزار SPSS ویرایش 16 تجزیهوتحلیل شدند. پس از تأیید عادیبودن توزیع نظری دادهها با استفاده از آزمون آماری شاپیروویلک و همگنی واریانسها توسط آزمون لوین، برای مقایسه میانگینهای درونگروهی و بینگروهی به ترتیب از آزمون آماری تی استیودنت وابسته و تحلیل کوواریانس (MANOVA) استفاده شد. معیار تصمیمگیری، معنیداری با سطح 0/05 در نظر گرفته شد.
یافتهها
مشخصات آزمودنیهای گروه تجربی و کنترل در جدول شماره 1 نشان داده شده است. بر اساس نتایج این جدول، تفاوت معنیداری بین شاخصهای قد، وزن، نمایه توده بدن، اندوتلین-1 و نیتریک اکساید در دو گروه کنترل و تجربی وجود نداشت.
ترکیب بدن
در این تحقیق برای ارزیابی ترکیبات بدن به ترتیب طول قد آزمودنیها با قدسنج سکا (ساخت کشور آلمان) با حساسیت پنج میلیمتر، محیط باسن و کمر با متر نواری (مابیس- ژاپن) با دقت پنج میلیمتر، وزن با حساسیت صد گرم و درصد چربی بدن با دستگاه بیوالکتریکال ایمپدنس (مدل In body-720 کره جنوبی) اندازهگیری شد. از تقسیم وزن بدن بر مجذور قد به متر، نمایه توده بدن بر حسب کیلوگرم بر مترمربع به دست آمد. تمامی اندازهگیریها در حالی انجام شد که آزمودنیها از چهار ساعت قبل از آزمون از خوردن و آشامیدن خودداری کرده بودند و تا حد ممکن مثانه، معده و روده آنها تخلیه شده بود.
نمونه خونی
یکی از کارشناسان مجرب علوم آزمایشگاهی در دو وهله نمونههای خونی از سیاهرگ دست چپ هر یک از آزمودنی در وضعیت نشسته و در حالت استراحت در 48 ساعت پیش از شروع تمرینات و 48 ساعت بعد از آخرین جلسه تمرین را جمعآوری کرد. در هر دو نوبت پیش و پس از تمرین، پنج سیسی خون از ورید آنتیکوبیتال بازویی گرفته شد و نمونهها در دمای 18- درجه سانتیگراد فریز شدند. برای تعیین میزان اندوتلین-1 از روش الایزا و کیت کازابایو ساخت شرکت ژاپن استفاده شد. همچنین سطوح نیتریک اکساید (NO) سرم نیز با استفاده از کیت زلابیو ساخت کشور آلمان سنجیده شد.
برنامه تمرینی
در این تحقیق فعالیت ورزشی شامل تمرینات تناوبی هوازی به مدت هشت هفته و در هر هفته سه جلسه و هر جلسه به مدت 45 تا 60 دقیقه بود. برنامه تمرین تناوبی شدید شامل گرمکردن با انواع حرکات کششی و نرمشی به مدت 10 دقیقه و سپس اجرای حرکات تناوبی شدید با دو دقیقه استراحت فعال میان هر ست بود. برنامه تمرینی از ساده به مشکل و با در نظر گرفتن اصل اضافه بار و با افزایش شدت تمرین اجرا شد.
الگوی تمرین تناوبی شدید به این صورت بود: در هفته اول، سه وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته دوم، چهار وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته سوم، پنج وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته چهارم، شش وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته پنجم، هفت وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته ششم، هشت وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال؛ هفته هفتم، شش وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال و هفته هشتم، پنج وهله اجرای چهار دقیقه با شدت 90 درصد ضربان قلب ذخیره با دو دقیقه ریکاوری فعال انجام شد. شدت تمرین با ضربان سنج (پُلار ساخت کشور فنلاند) کنترل شد [16]. گروه کنترل هیچ فعالیتی در طول دوره تحقیق نداشتند و غیرفعال بودند (شیوه زندگی غیرفعال داشتند).
در پایان مرحله اجرایی پژوهش، دادههای جمعآوریشده با کمک نرم افزار SPSS ویرایش 16 تجزیهوتحلیل شدند. پس از تأیید عادیبودن توزیع نظری دادهها با استفاده از آزمون آماری شاپیروویلک و همگنی واریانسها توسط آزمون لوین، برای مقایسه میانگینهای درونگروهی و بینگروهی به ترتیب از آزمون آماری تی استیودنت وابسته و تحلیل کوواریانس (MANOVA) استفاده شد. معیار تصمیمگیری، معنیداری با سطح 0/05 در نظر گرفته شد.
یافتهها
مشخصات آزمودنیهای گروه تجربی و کنترل در جدول شماره 1 نشان داده شده است. بر اساس نتایج این جدول، تفاوت معنیداری بین شاخصهای قد، وزن، نمایه توده بدن، اندوتلین-1 و نیتریک اکساید در دو گروه کنترل و تجربی وجود نداشت.
بر اساس یافتههای جدول شماره 2، نتایج t وابسته نشان داد مقادیر وزن بدن از 78/16 به 77/67 (0/03=P)، نمایه توده بدن از 43/28 به 26/28 (02/0=P)، درصد چربی بدن از 44/71 به 16/43 (0/006=P)، اندوتلین-1 از 4/17 به 3/86 (0/001=P) و نیتریک اکساید از 3/34 به 3/76 (0/001=P) در گروه تمرین تناوبی هوازی به لحاظ آماری معنیدار بود. همچنین بر اساس نتایج این جدول، نتایج تحلیل کوواریانس نشان داد تغییرات میانگینهای بینگروهی در متغیر وزن بدن (0/02=P)، نمایه توده بدن (0/01=P)، درصد چربی بدن (0/01=P)، اندوتلین-1 (0/003=P) و نیتریک اکساید (0/001=P) به لحاظ آماری معنیدار بود.
بحث
هدف از مطالعه حاضر مقایسه تأثیر هشت هفته تمرین تناوبی هوازی بر سطوح برخی عوامل خطرزای قلبیعروقی مردان با اضافه وزن بود. بر اساس نتایج بهدستآماده از پژوهش حاضر، برنامه تمرینات تناوبی هوازی به کاهش معنیدار وزن بدن، نمایه توده بدن و درصد چربی بدن در گروه تجربی منجر شد. این نتایج با یافتههای ایروینگ و همکاران همخوانی دارد [17]. به عبارتی تمرینات بدنی منظم به خصوص تمرینات تناوبی هوازی میتواند ترکیبات بدنی افراد را کاهش و کارایی سیستم قلبیعروقی آنها را افزایش دهد. نتایج بهدستآمده از تحقیق حاضر دلالت بر نقش تمرینات منتخب با شدت مناسب بر کنترل وزن و ترکیب بدنی آزمودنیها دارد. البته نوع، شدت و مدت فعالیت بدنی منتخب متغیرهای مهمی هستند که میتوانند در نوع اثرگذاری فعالیت بدنی بر روی شاخصها دخالت کنند. در این خصوص برای اختلاف بین نتایج تحقیقات و این پژوهش میتوان دلایل مختلفی ذکر کرد. دلیل مهم آن میتواند نوع فعالیت بدنی باشد. از جمله سازگاریهای فیزیولوژیکی به چنین موضوعی، درک مکانیسمهایی است که با آنها انرژی لازم برای عملکرد عضلات به خدمت گرفته میشود.
از آنجا که با توجه به توصیههای محققان، حجم و زمان به نحوی در نظر گرفته شده بود که برنامه فعالیت به صورت هوازی صورت گیرد، انتظار میرود که در حین فعالیت مذکور اسیدهای چرب به عنوان سوخت اصلی با عضله استفاده شود و باعث کمشدن چربی بدن شود. بنابراین با توجه به ماهیت تحقیق که هوازی است، اصلیترین عامل در کاهش آن محسوب میشود، ولی دخالت متغیرهای گوناگون مانند تغذیه، فعالیت روزانه آزمودنیها و وضعیت ارائه آنها قبل از شروع تحقیق، میتواند از دلایل دیگر تفاوت نتایج باشد. بر اساس مطالعات صورتگرفته، کاهش وزن با استفاده از تمرینات هوازی بهبود مییابد، اما درباره اینکه شدت یا مدت تمرین محرک مهمی برای کاهش چربی بدن است، همچنان بحث وجود دارد [18].
با بررسی برنامههای تمرینی در مطالعات کاهش وزن، مشخص شد در شدتهای تمرینی یکسان، حجم تمرینی بیشتر به کاهش بیشتر وزن بدن منجر میشود [20 ،19]. گزارش شده است تمرین شدید باعث کاهش اشتها و افزایش میزان متابولیک استراحتی میشود و در نهایت افزایش تعادل منفی انرژی را به همراه دارد [20]. بنابراین، با کنترل حجم تمرین میتوان اثر شدت تمرین را که بعد دیگر تمرین است، بررسی کرد. اما تمرین با شدت کم در مقایسه با شدت زیاد، موجب کاهش چربی بدنی بیشتری میشود. نشان داده شده است فعالیت لیپولیتیکی در ذخایر چربی مختلف (زیرپوستی یا داخل شکمی) ناهمگن است. بافت چربی درون شکمی از نظر فعالیت لیپولیتیکی فعالترین ذخیره بافت چربی است [21].
با وجود سرعت زیاد فعالیت لیپولیتیکی چربی داخل شکمی، بعید است که در فراهمکردن اسیدهای چرب برای اکسایش عضله در طول تمرین سهم مهمی داشته باشد. بنابراین اغلب اسیدهای چربی که وارد گردش خون میشوند از بافت چربی زیرپوستی استخراج میشوند. مقادیر اسیدهای چرب آزادشده از بافت چربی بالاتنه بیش از پایین تنه است[22]. همچنین، فعالیت لیپولیتیکی در قسمتهای مختلف چربی زیرپوستی بدن ناهمگن است. در طول تمرین استقامتی با شدت متوسط حدود نیمی از اسیدهای چرب مورد نیاز را بافت چربی زیرپوستی تأمین میکند که سهم چربی زیرپوستی بالاتنه بیش از پایینتنه است [23].
یافتههای تحقیق نشان داد هشت هفته تمرینات تناوبی هوازی به کاهش معنیدار سطوح اندوتلین-1 سرمی آزمودنیها در پایان دوره منجر شد. نتایج پژوهش حاضر با یافتههای قهرمانی مقدم و همکاران و مائد و همکاران همخوانی دارد [25 ،24]. اما با نتایج ماراتلی و همکاران مبنی بر کاهش یافتن سطوح اندوتلین-1 سرمی همخوانی ندارد [26]. قهرمانیمقدم و همکاران با بررسی اثر هشت هفته تمرین هوازی بر سطح سرمی اندوتلین-1 و مالون دی آلدئید زنان بیش از 60 سال غیرفعال به این نتیجه رسیدند که اندوتلین-1 سرمی گروه مداخله پس از هشت هفته تمرین هوازی کاهش معنیدار یافت [24]. مائد و همکاران با بررسی اثر هشت هفته تمرین تمرین هوازی بر سطح لیپیدهای پلاسمایی و اندولین-1 در 16 مرد میان سال، به این نتیجه رسیدند که سطح اندوتلین-1 در پایان دوره تمرینی کاهش معنیدار یافت [25].
ماراتلی و همکاران در مطالعهای که برای بررسی مقایسه سطح اندوتلین-1 پلاسما در گروه بیماران با پوکی استخوان و افراد سالم انجام دادند، به این نتیجه رسیدند که تفاوتهای معنیداری در سطوح اندوتلین-1 پلاسما بین گروههای ورزش و کنترل وجود ندارد [26]. از دلایل تناقض یافتهها میتواند متفاوتبودن برنامههای تمرینی، نوع آزمودنیها و به ویژه مدتزمان تمرینها باشد. همچنین به نظر میرسد تنظیم هورمونهای تروپیک بدن بر اثر فعالیت بدنی یا تغییرات در وزن بدن و کل توده چربی و نیز افزایش قدرت و توان عضلات اسکلتی اطراف عروق خونی، همگی باعث کاهش نیاز بدن به عملکرد سلولهای اندوتلیال عروق میشود که در نتیجه مواد مترشحه از این سلولها کاهش می یابد [27]. با توجه به اینکه کاهشیافتن غلظت اندوتلین-1 در خون، احتمالا به کاهش سطوح فشار خون، بیماریهای قلبی و خطر تصلب شرایین منجر میشود و همچنین مانع از ایسکمی کلیه میشود و از آنجایی که در تولید اندوتلین-1 عوامل مختلفی همچون فاکتورهای عصبیخونی مانند آنژیوتانسیون2، آرژنین و وازوپروسین نقش دارند، بنابراین عوامل نامبرده خود ممکن است تحت تأثیر تمرین هوازی کاهش یابند[28]. از این رو، آنژیوتانسین2 با اثر مستقیم یا با تحریک تولید و آزادسازی نوراپی نفرین (از ناحیه پیش سیناپسی ازانتهای اعصاب آدرنرژیک) و با تولید اندوتلین 1 در اندوتلیوم عروق، موجب انقباض شدید رگها میشود. بر اساس مطالعات صورتگرفته با انجامدادن فعالیتهای هوازی منظم، آنژیوتانسین 2 کاهش معنیدار یافت که این عامل میتواند بر تولید اندوتلین 1 در اندوتلیوم عروق تأثیرگذار باشد [28].
نتایج تحقیق حاضر نشان داد تمرینات تناوبی هوازی به افزایش معنیداری نیتریک اکساید مردان با اضافه وزن منجر شد. این نتایج با یافته های کراسو و همکاران همخوانی دارد[11]. اما با یافتههای رادووانیک و همکاران مبنی بر افزایش یافتن نیتریک اکساید همخوانی ندارد [29]. کراسو و همکاران 16 هفته تمرینات هوازی با شدتهای متفاوت کم 30-40 درصد حداکثر اکسیژن مصرفی و متوسط 55 تا 65 درصد حداکثراکسیژن مصرفی برای مدت 30 دقیقه در هر جلسه و 3 جلسه در هر هفته، روی 25 مرد با دامنه سنی 52 سال و چاق انجام دادند. آنها به این نتیجه رسیدند که تمرین به عدم تغییر معنیداری در ترکیب بدن و آمادگی جسمانی شرکتکنندگان منجر شد، اما اجرای تمرینات با شدت متوسط باعث به بهبود نیتریک اکساید در مردان شد [11].
رادووانیک و همکاران با بررسی اثر چهار هفته تمرینات دورهای قبل از مسابقات جودو در 10 جودوکار زن با دامنه سنی 20 سال با سابقه ورزشی 11 سال به این نتیجه رسیدند که تغییر معنیداری در پارامترهای استرس اکسیداتیو همچون مالون دی آلدوئید، نیتریک اکساید کاتالاز و کربونیل در پایان دوره نشد [29]. آندوتلیوم عروق عضلانی و تارهای عضلانی طی انقباض و در پاسخ به جریان خون بالا یا به عبارتی افزایش نیروهای همودینامیکی (شیر استرس) به طور موضعی اکسید نیتریک را ترشح میکنند. شیر استرس بطور عمده سبب آرتریوژنز و آنژیوژنز تقسیم دوتایی می شود [30]. به نظر می رسد که افزایش حاد و فوری شیر استرس بیشتر موجب ترشح اتساعکنندههای عروق به ویژه NO میشود و از این طریق عروق متسع میشوند. اما افزایش مزمن شیراسترس سبب تغییر ساختاری، به ویژه افزایش قطر و هایپرتروفی عروق میشود. شیراسترس از طریق فعالسازی کانالهای یونی به ویژه کانالهای پتاسیمی موجب تولید افزایش یافته اکسید نیتریک میشود [31]. این تغییرات موجب فعالسازی گیرندههای تیروزین کینازی فاکتورهای رشدی بهویژه VEGFR-2 و فسفریله شدن گیرنده Tie-2 میشود. نیتریک اکساید از آمینواسید ال-آرژنین توسط انواع مختلف سلولی سنتز میشود. منبع اصلی تولید اکسید نیتریک در سلول های آندوتلیال عروقی Enos است که طی تمرین ورزشی و شیراسترس فعال می شود [32]. شیراسترس با تأثیر بر حسگرهای مکانیکی (پروتئین g کانالهای یونی و اینتگرین) که در غشای سلولهای اندوتلیال قرار دارند، از طریق چهار مسیر انتقال پیام مکانیکی یعنی مسیرهای ERK، Ras، Raf و MEK ، c-Src، پروتئین شوک گرمایی (HSP-90) و مسیر فاکتور قابل القای هایپوکسی یک (HIF-1) با افزایش VEGF موجب فعالسازی eNOS و نهایتاً تولید NO میشود [33]. از جمله محرک های فیزیولوژیک احتمالی برای تولید اکسیدنیتریک افزایش جریان خون در مجرای رگ شناخته شده است که در اثر حاد آن موجب افزایش اکسیدنیتریک سنتاز و تعدیل اتساع عروق برای متعادل سازی فشار است.
این یافتهها این احتمال را تقویت میکند که به دلیل اینکه تمرین منظم به طور مکرر سبب افزایش فشار نبض و پرضربانی می شود، در نتیجه میتواند در دسترسبودن زیستی اکسید نیتریک را افزایش دهد [8]. علاوه بر این، مطالعات متعددی بر تعامل بین HSP-90 و آنزیم اکسیدنیتریک سنتاز اندوتلیالی متمرکز شدهاند. HSP-90 که به عنوان محافظ داخل سلولی عمل میکند، در بیشتر سلولها از جمله سلولهای اندوتلیال وجود دارند و در پاسخ به محرکهای مختلفی از جمله استرسها و ضربههای مکانیکی و تولید رادیکالهای آزاد و آسیب اکسایشی آزاد میشوند و تمرین ورزشی نیز عامل تحریکی فیزیولوژیکی برای HSP است. [34]. در این راستا، HSP-90 موجب افزایش آنزیم اکسیدنیتریک سنتاز اندوتلیالی در سلولهای اندوتلیال در پاسخ به تحریک ایجادشده در اثر تمرین میشود و در نتیجه تمرینات ورزشی در بهبود عملکرد اندوتلیال عروقی تأثیر دارند [35].
با توجه به اینکه این مطالعه با محدودیتهایی همچون رژیم غذایی متنوع، پاسخهای سازگاری گوناگون به فعالیت بدنی، تعداد کم آزمودنیها به دلیل انصراف بعضی از آنها از شرکت در تحقیق حاضر و تفاوتهای فردی روبهرو بود، در نتیجه جانب احتیاط را بیشتر باید رعایت کرد.
نتیجهگیری نهایی
به طور کلی میتوان گفت که هشت هفته تمرین تناوبی هوازی از طریق افزایش نیتریک اکساید و کاهش اندوتلین-1 در بهبود سلامت قلب و عروق و کاهش خطر بیماری آتروسکلروز مؤثر است. از این رو میتوان پیشنهاد کرد سالمند با انجام تمرینات تناوبی هوازی متنوع با خستگی کمتر، از فواید فعالیت بدنی و ورزش برای تقویت دستگاه قلب و عروق بهرهمند شود.
تشکر و قدردانی
مقاله حاضر برگرفته از پایان نامه کارشناسی ارشد آقای رضا محمدی است که در جلسه گروه دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد واحد بجنورد تحت کد 44485214 ثبت شده است. مراتب سپاس و قدردانی خود را از تمامی کسانی که ما را در انجام این پژوهش یاری دادند، اعلام میکنیم. این مقاله با حمایت مالی دانشگاه آزاد بجنورد انجام شده است و تضاد منافعی وجود ندارد.
هدف از مطالعه حاضر مقایسه تأثیر هشت هفته تمرین تناوبی هوازی بر سطوح برخی عوامل خطرزای قلبیعروقی مردان با اضافه وزن بود. بر اساس نتایج بهدستآماده از پژوهش حاضر، برنامه تمرینات تناوبی هوازی به کاهش معنیدار وزن بدن، نمایه توده بدن و درصد چربی بدن در گروه تجربی منجر شد. این نتایج با یافتههای ایروینگ و همکاران همخوانی دارد [17]. به عبارتی تمرینات بدنی منظم به خصوص تمرینات تناوبی هوازی میتواند ترکیبات بدنی افراد را کاهش و کارایی سیستم قلبیعروقی آنها را افزایش دهد. نتایج بهدستآمده از تحقیق حاضر دلالت بر نقش تمرینات منتخب با شدت مناسب بر کنترل وزن و ترکیب بدنی آزمودنیها دارد. البته نوع، شدت و مدت فعالیت بدنی منتخب متغیرهای مهمی هستند که میتوانند در نوع اثرگذاری فعالیت بدنی بر روی شاخصها دخالت کنند. در این خصوص برای اختلاف بین نتایج تحقیقات و این پژوهش میتوان دلایل مختلفی ذکر کرد. دلیل مهم آن میتواند نوع فعالیت بدنی باشد. از جمله سازگاریهای فیزیولوژیکی به چنین موضوعی، درک مکانیسمهایی است که با آنها انرژی لازم برای عملکرد عضلات به خدمت گرفته میشود.
از آنجا که با توجه به توصیههای محققان، حجم و زمان به نحوی در نظر گرفته شده بود که برنامه فعالیت به صورت هوازی صورت گیرد، انتظار میرود که در حین فعالیت مذکور اسیدهای چرب به عنوان سوخت اصلی با عضله استفاده شود و باعث کمشدن چربی بدن شود. بنابراین با توجه به ماهیت تحقیق که هوازی است، اصلیترین عامل در کاهش آن محسوب میشود، ولی دخالت متغیرهای گوناگون مانند تغذیه، فعالیت روزانه آزمودنیها و وضعیت ارائه آنها قبل از شروع تحقیق، میتواند از دلایل دیگر تفاوت نتایج باشد. بر اساس مطالعات صورتگرفته، کاهش وزن با استفاده از تمرینات هوازی بهبود مییابد، اما درباره اینکه شدت یا مدت تمرین محرک مهمی برای کاهش چربی بدن است، همچنان بحث وجود دارد [18].
با بررسی برنامههای تمرینی در مطالعات کاهش وزن، مشخص شد در شدتهای تمرینی یکسان، حجم تمرینی بیشتر به کاهش بیشتر وزن بدن منجر میشود [20 ،19]. گزارش شده است تمرین شدید باعث کاهش اشتها و افزایش میزان متابولیک استراحتی میشود و در نهایت افزایش تعادل منفی انرژی را به همراه دارد [20]. بنابراین، با کنترل حجم تمرین میتوان اثر شدت تمرین را که بعد دیگر تمرین است، بررسی کرد. اما تمرین با شدت کم در مقایسه با شدت زیاد، موجب کاهش چربی بدنی بیشتری میشود. نشان داده شده است فعالیت لیپولیتیکی در ذخایر چربی مختلف (زیرپوستی یا داخل شکمی) ناهمگن است. بافت چربی درون شکمی از نظر فعالیت لیپولیتیکی فعالترین ذخیره بافت چربی است [21].
با وجود سرعت زیاد فعالیت لیپولیتیکی چربی داخل شکمی، بعید است که در فراهمکردن اسیدهای چرب برای اکسایش عضله در طول تمرین سهم مهمی داشته باشد. بنابراین اغلب اسیدهای چربی که وارد گردش خون میشوند از بافت چربی زیرپوستی استخراج میشوند. مقادیر اسیدهای چرب آزادشده از بافت چربی بالاتنه بیش از پایین تنه است[22]. همچنین، فعالیت لیپولیتیکی در قسمتهای مختلف چربی زیرپوستی بدن ناهمگن است. در طول تمرین استقامتی با شدت متوسط حدود نیمی از اسیدهای چرب مورد نیاز را بافت چربی زیرپوستی تأمین میکند که سهم چربی زیرپوستی بالاتنه بیش از پایینتنه است [23].
یافتههای تحقیق نشان داد هشت هفته تمرینات تناوبی هوازی به کاهش معنیدار سطوح اندوتلین-1 سرمی آزمودنیها در پایان دوره منجر شد. نتایج پژوهش حاضر با یافتههای قهرمانی مقدم و همکاران و مائد و همکاران همخوانی دارد [25 ،24]. اما با نتایج ماراتلی و همکاران مبنی بر کاهش یافتن سطوح اندوتلین-1 سرمی همخوانی ندارد [26]. قهرمانیمقدم و همکاران با بررسی اثر هشت هفته تمرین هوازی بر سطح سرمی اندوتلین-1 و مالون دی آلدئید زنان بیش از 60 سال غیرفعال به این نتیجه رسیدند که اندوتلین-1 سرمی گروه مداخله پس از هشت هفته تمرین هوازی کاهش معنیدار یافت [24]. مائد و همکاران با بررسی اثر هشت هفته تمرین تمرین هوازی بر سطح لیپیدهای پلاسمایی و اندولین-1 در 16 مرد میان سال، به این نتیجه رسیدند که سطح اندوتلین-1 در پایان دوره تمرینی کاهش معنیدار یافت [25].
ماراتلی و همکاران در مطالعهای که برای بررسی مقایسه سطح اندوتلین-1 پلاسما در گروه بیماران با پوکی استخوان و افراد سالم انجام دادند، به این نتیجه رسیدند که تفاوتهای معنیداری در سطوح اندوتلین-1 پلاسما بین گروههای ورزش و کنترل وجود ندارد [26]. از دلایل تناقض یافتهها میتواند متفاوتبودن برنامههای تمرینی، نوع آزمودنیها و به ویژه مدتزمان تمرینها باشد. همچنین به نظر میرسد تنظیم هورمونهای تروپیک بدن بر اثر فعالیت بدنی یا تغییرات در وزن بدن و کل توده چربی و نیز افزایش قدرت و توان عضلات اسکلتی اطراف عروق خونی، همگی باعث کاهش نیاز بدن به عملکرد سلولهای اندوتلیال عروق میشود که در نتیجه مواد مترشحه از این سلولها کاهش می یابد [27]. با توجه به اینکه کاهشیافتن غلظت اندوتلین-1 در خون، احتمالا به کاهش سطوح فشار خون، بیماریهای قلبی و خطر تصلب شرایین منجر میشود و همچنین مانع از ایسکمی کلیه میشود و از آنجایی که در تولید اندوتلین-1 عوامل مختلفی همچون فاکتورهای عصبیخونی مانند آنژیوتانسیون2، آرژنین و وازوپروسین نقش دارند، بنابراین عوامل نامبرده خود ممکن است تحت تأثیر تمرین هوازی کاهش یابند[28]. از این رو، آنژیوتانسین2 با اثر مستقیم یا با تحریک تولید و آزادسازی نوراپی نفرین (از ناحیه پیش سیناپسی ازانتهای اعصاب آدرنرژیک) و با تولید اندوتلین 1 در اندوتلیوم عروق، موجب انقباض شدید رگها میشود. بر اساس مطالعات صورتگرفته با انجامدادن فعالیتهای هوازی منظم، آنژیوتانسین 2 کاهش معنیدار یافت که این عامل میتواند بر تولید اندوتلین 1 در اندوتلیوم عروق تأثیرگذار باشد [28].
نتایج تحقیق حاضر نشان داد تمرینات تناوبی هوازی به افزایش معنیداری نیتریک اکساید مردان با اضافه وزن منجر شد. این نتایج با یافته های کراسو و همکاران همخوانی دارد[11]. اما با یافتههای رادووانیک و همکاران مبنی بر افزایش یافتن نیتریک اکساید همخوانی ندارد [29]. کراسو و همکاران 16 هفته تمرینات هوازی با شدتهای متفاوت کم 30-40 درصد حداکثر اکسیژن مصرفی و متوسط 55 تا 65 درصد حداکثراکسیژن مصرفی برای مدت 30 دقیقه در هر جلسه و 3 جلسه در هر هفته، روی 25 مرد با دامنه سنی 52 سال و چاق انجام دادند. آنها به این نتیجه رسیدند که تمرین به عدم تغییر معنیداری در ترکیب بدن و آمادگی جسمانی شرکتکنندگان منجر شد، اما اجرای تمرینات با شدت متوسط باعث به بهبود نیتریک اکساید در مردان شد [11].
رادووانیک و همکاران با بررسی اثر چهار هفته تمرینات دورهای قبل از مسابقات جودو در 10 جودوکار زن با دامنه سنی 20 سال با سابقه ورزشی 11 سال به این نتیجه رسیدند که تغییر معنیداری در پارامترهای استرس اکسیداتیو همچون مالون دی آلدوئید، نیتریک اکساید کاتالاز و کربونیل در پایان دوره نشد [29]. آندوتلیوم عروق عضلانی و تارهای عضلانی طی انقباض و در پاسخ به جریان خون بالا یا به عبارتی افزایش نیروهای همودینامیکی (شیر استرس) به طور موضعی اکسید نیتریک را ترشح میکنند. شیر استرس بطور عمده سبب آرتریوژنز و آنژیوژنز تقسیم دوتایی می شود [30]. به نظر می رسد که افزایش حاد و فوری شیر استرس بیشتر موجب ترشح اتساعکنندههای عروق به ویژه NO میشود و از این طریق عروق متسع میشوند. اما افزایش مزمن شیراسترس سبب تغییر ساختاری، به ویژه افزایش قطر و هایپرتروفی عروق میشود. شیراسترس از طریق فعالسازی کانالهای یونی به ویژه کانالهای پتاسیمی موجب تولید افزایش یافته اکسید نیتریک میشود [31]. این تغییرات موجب فعالسازی گیرندههای تیروزین کینازی فاکتورهای رشدی بهویژه VEGFR-2 و فسفریله شدن گیرنده Tie-2 میشود. نیتریک اکساید از آمینواسید ال-آرژنین توسط انواع مختلف سلولی سنتز میشود. منبع اصلی تولید اکسید نیتریک در سلول های آندوتلیال عروقی Enos است که طی تمرین ورزشی و شیراسترس فعال می شود [32]. شیراسترس با تأثیر بر حسگرهای مکانیکی (پروتئین g کانالهای یونی و اینتگرین) که در غشای سلولهای اندوتلیال قرار دارند، از طریق چهار مسیر انتقال پیام مکانیکی یعنی مسیرهای ERK، Ras، Raf و MEK ، c-Src، پروتئین شوک گرمایی (HSP-90) و مسیر فاکتور قابل القای هایپوکسی یک (HIF-1) با افزایش VEGF موجب فعالسازی eNOS و نهایتاً تولید NO میشود [33]. از جمله محرک های فیزیولوژیک احتمالی برای تولید اکسیدنیتریک افزایش جریان خون در مجرای رگ شناخته شده است که در اثر حاد آن موجب افزایش اکسیدنیتریک سنتاز و تعدیل اتساع عروق برای متعادل سازی فشار است.
این یافتهها این احتمال را تقویت میکند که به دلیل اینکه تمرین منظم به طور مکرر سبب افزایش فشار نبض و پرضربانی می شود، در نتیجه میتواند در دسترسبودن زیستی اکسید نیتریک را افزایش دهد [8]. علاوه بر این، مطالعات متعددی بر تعامل بین HSP-90 و آنزیم اکسیدنیتریک سنتاز اندوتلیالی متمرکز شدهاند. HSP-90 که به عنوان محافظ داخل سلولی عمل میکند، در بیشتر سلولها از جمله سلولهای اندوتلیال وجود دارند و در پاسخ به محرکهای مختلفی از جمله استرسها و ضربههای مکانیکی و تولید رادیکالهای آزاد و آسیب اکسایشی آزاد میشوند و تمرین ورزشی نیز عامل تحریکی فیزیولوژیکی برای HSP است. [34]. در این راستا، HSP-90 موجب افزایش آنزیم اکسیدنیتریک سنتاز اندوتلیالی در سلولهای اندوتلیال در پاسخ به تحریک ایجادشده در اثر تمرین میشود و در نتیجه تمرینات ورزشی در بهبود عملکرد اندوتلیال عروقی تأثیر دارند [35].
با توجه به اینکه این مطالعه با محدودیتهایی همچون رژیم غذایی متنوع، پاسخهای سازگاری گوناگون به فعالیت بدنی، تعداد کم آزمودنیها به دلیل انصراف بعضی از آنها از شرکت در تحقیق حاضر و تفاوتهای فردی روبهرو بود، در نتیجه جانب احتیاط را بیشتر باید رعایت کرد.
نتیجهگیری نهایی
به طور کلی میتوان گفت که هشت هفته تمرین تناوبی هوازی از طریق افزایش نیتریک اکساید و کاهش اندوتلین-1 در بهبود سلامت قلب و عروق و کاهش خطر بیماری آتروسکلروز مؤثر است. از این رو میتوان پیشنهاد کرد سالمند با انجام تمرینات تناوبی هوازی متنوع با خستگی کمتر، از فواید فعالیت بدنی و ورزش برای تقویت دستگاه قلب و عروق بهرهمند شود.
تشکر و قدردانی
مقاله حاضر برگرفته از پایان نامه کارشناسی ارشد آقای رضا محمدی است که در جلسه گروه دانشکده تربیت بدنی و علوم ورزشی دانشگاه آزاد واحد بجنورد تحت کد 44485214 ثبت شده است. مراتب سپاس و قدردانی خود را از تمامی کسانی که ما را در انجام این پژوهش یاری دادند، اعلام میکنیم. این مقاله با حمایت مالی دانشگاه آزاد بجنورد انجام شده است و تضاد منافعی وجود ندارد.
References
- Kim DY, Jung SY. Effect of aerobic exercise on risk factors of cardiovascular disease and the apolipoprotein B/apolipoprotein a-1 ratio in obese woman. Journal of Physical Therapy Science. 2014; 26(11):1825–9. doi: 10.1589/jpts.26.1825
- Puska P, Norrving B, Mendis S. Global atlas on cardiovascular disease prevention and control. Geneva: World Health Organization; 2011.
- Mir E, Attarzadeh Hosseini SR, Hejazi K, Mir Sayeedi M. [Effect of eight weeks of endurance and resistance training on serum adiponectin and Insulin resistance index of inactive elderly men (Persian)]. Journal of Gorgan University of Medical Sciences. 2016; 18(1):69-77.
- Olivetti G, Giordano G, Corradi D, Melissari M, Lagrasta C, Gambert SR, et al. Gender differences and aging: Effects on the human heart. Journal of the American College of Cardiology. 1995; 26(4):1068–79. doi: 10.1016/0735-1097(95)00282-8
- Miyauchi T, Masaki T. Pathophysiology of endothelin in the cardiovascular system. 1999; 61(1):391–415. doi: 10.1146/annurev.physiol.61.1.391
- Guang-da X, Yun-lin W. Regular aerobic exercise training improves endothelium-dependent arterial dilation in patients with impaired fasting glucose. Diabetes Care. 2004; 27(3):801–2. doi: 10.2337/diacare.27.3.801
- Zhang W, Li XJ, Zeng X, Shen DY, Liu CQ, Zhang H-J, et al. Activation of nuclear factor-κB pathway is responsible for tumor necrosis factor-α-induced up-regulation of endothelin B2 receptor expression in vascular smooth muscle cells in vitro. Toxicology Letters. 2012; 209(2):107–12. doi: 10.1016/j.toxlet.2011.12.005
- Green DJ, Maiorana A, O’Driscoll G, Taylor R. Effect of exercise training on endothelium-derived nitric oxide function in humans. The Journal of Physiology. 2004; 561(1):1–25. doi: 10.1113/jphysiol.2004.068197
- Franke WD, Anderson DF. Relationship between physical activity and risk factors for cardiovascular disease among law enforcement officers. Journal of Occupational and Environmental Medicine. 1994; 36(10):1127–32. doi: 10.1097/00043764-199410000-00016
- Jarrete AP, Novais IP, Nunes HA, Puga GM, Delbin MA, Zanesco A. Influence of aerobic exercise training on cardiovascular and endocrine-inflammatory biomarkers in hypertensive postmenopausal women. Journal of Clinical & Translational Endocrinology. 2014; 1(3):108–14. doi: 10.1016/j.jcte.2014.07.004
- Krause M, Rodrigues-Krause J, O’Hagan C, Medlow P, Davison G, Susta D, et al. The effects of aerobic exercise training at two different intensities in obesity and type 2 diabetes: implications for oxidative stress, low-grade inflammation and nitric oxide production. European Journal of Applied Physiology. 2013; 114(2):251–60. doi: 10.1007/s00421-013-2769-6
- Buttar HS, Li T, Ravi N. Prevention of cardiovascular diseases: Role of exercise, dietary interventions, obesity and smoking cessation. Experimental & Clinical Cardiology. 2005; 10(4):229-49. PMCID: PMC2716237
- Kromhout D. Prevention of coronary heart disease by diet and lifestyle: evidence from prospective cross-cultural, cohort, and intervention studies. Circulation. 2002; 105(7):893–8. doi: 10.1161/hc0702.103728
- Sternfeld B, Ainsworth BE, Quesenberry CP. Physical activity patterns in a diverse population of women. Preventive Medicine. 1999; 28(3):313–23. doi: 10.1006/pmed.1998.0470
- Bartlett JE, Kotrlik JW, Higgins CC. Organizational research: Determining appropriate sample size in survey research appropriate sample size in survey research. Information Technology, Learning, and Performance Journal. 2001; 19(1):43-50.
- American College of Sports Medicine. ACSM’s guidelines for exercise testing and prescription. Philadelphia, Pennsylvania: Lippincott Williams & Wilkins; 2013.
- Irving BA, Davis CK, Brock DW, Weltman JY, Swift D, Barrett EJ, et al. Effect of exercise training intensity on abdominal visceral fat and body composition. Medicine & Science in Sports & Exercise. 2008; 40(11):1863–72. doi: 10.1249/mss.0b013e3181801d40
- Donnelly J, Smith B, Jacobsen D, Kirk E, Dubose K, Hyder M, et al. The role of exercise for weight loss and maintenance. Best Practice & Research Clinical Gastroenterology. 2004; 18(6):1009–29. doi: 10.1016/s1521-6918(04)00083-6
- Slentz CA, Duscha BD, Johnson JL, Ketchum K, Aiken LB, Samsa GP, et al. Effects of the amount of exercise on body weight, body composition, and measures of central obesity. Archives of Internal Medicine. 2004; 164(1):31. doi: 10.1001/archinte.164.1.31
- Marra CC, Bottaro MM, Oliveira RJ, Novaes JS. Effect of moderate and high intensity aerobic exercise on body composition in over weight men. Medicine & Science in Sports & Exercise. 2003; 35(Supplement 1):S308. doi: 10.1097/00005768-200305001-01705
- De Glisezinski I, Moro C, Pillard F, Marion-Latard F, Harant I, Meste M, et al. Aerobic training improves exercise-induced lipolysis in SCAT and lipid utilization in overweight men. American Journal of Physiology-Endocrinology and Metabolism. 2003; 285(5):E984–E990. doi: 10.1152/ajpendo.00152.2003
- Martins C, Morgan LM, Bloom SR, Robertson MD. Effects of exercise on gut peptides, energy intake and appetite. Journal of Endocrinology. 2007; 193(2):251–8. doi: 10.1677/joe-06-0030
- Horowitz JF. Fatty acid mobilization from adipose tissue during exercise. Trends in Endocrinology & Metabolism. 2003; 14(8):386–92. doi: 10.1016/s1043-2760(03)00143-7
- Ghahremani Moghaddam M, Hejazi K. [Effect of aerobic training on Endothelin-1 and Malondialdehyde in inactive elderly women (Persian)]. Journal of Gorgan University of Medical Sciences. 2016; 18(3):52-57.
- Maeda S, Tanabe T, Miyauchi T, Otsuki T, Sugawara J, Iemitsu M, et al. Aerobic exercise training reduces plasma endothelin-1 concentration in older women. Journal of Applied Physiology. 2003; 95(1):336–41. doi: 10.1152/japplphysiol.01016.2002
- Muratli HH, Çelebi L, Hapa O, Biçimoğlu A. Comparison of plasma endothelin levels between osteoporotic, osteopenic and normal subjects. BMC Musculoskeletal Disorders. 2005; 6(1):49. doi: 10.1186/1471-2474-6-49
- Donato A, Lesniewski L, Delp M. he effects of aging and exercise training on endothelin-1 vasoconstrictor responses in rat skeletal muscle arterioles. Cardiovascular Research. 2005; 66(2):393–401. doi: 10.1016/j.cardiores.2004.10.023
- Suen RS, Rampersad SN, Stewart DJ, Courtman DW. Differential roles of endothelin-1 in angiotensin II-induced atherosclerosis and aortic aneurysms in apolipoprotein E-null mice. The American Journal of Pathology. 2011; 179(3):1549–59. doi: 10.1016/j.ajpath.2011.05.014
- Radovanovic D, Stankovic N, Ponorac N, Nurkic M, Bratic M. Oxidative stress in young judokas: effects of four week pre-competition training period. Archives of Budo. 2012; 8:147–51. doi: 10.12659/aob.883328
- Egginton S. Unorthodox angiogenesis in skeletal muscle. Cardiovascular Research. 2001; 49(3):634–46. doi: 10.1016/s0008-6363(00)00282-0
- Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Laboratory Investigation. 2004; 85(1):9–23. doi: 10.1038/labinvest.3700215
- Higashi Y, Yoshizumi M. Exercise and endothelial function: Role of endothelium-derived nitric oxide and oxidative stress in healthy subjects and hypertensive patients. Pharmacology & Therapeutics. 2004; 102(1):87–96. doi: 10.1016/j.pharmthera.2004.02.003
- Harrison Dg, Widder J, Grumbach I, Chen W, Weber M, Searles C. Endothelial mechanotransduction, nitric oxide and vascular inflammation. Journal of Internal Medicine. 2006; 259(4):351–63. doi: 10.1111/j.1365-2796.2006.01621.x
- Irani K. Oxidant signaling in vascular cell growth, death, and survival: A review of the roles of reactive oxygen species in smooth muscle and endothelial cell mitogenic and apoptotic signaling. Circulation Research. 2000; 87(3):179–83. doi: 10.1161/01.res.87.3.179
- Xu Q. Role of heat shock proteins in atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 2002; 22(10):1547–59. doi: 10.1161/01.atv.0000029720.59649.50
فهرست منابع
1. Kim DY, Jung SY. Effect of aerobic exercise on risk factors of cardiovascular disease and the apolipoprotein B/apolipoprotein a-1 ratio in obese woman. Journal of Physical Therapy Science. 2014; 26(11):1825–9. doi: 10.1589/jpts.26.1825 [DOI:10.1589/jpts.26.1825]
2. Puska P, Norrving B, Mendis S. Global atlas on cardiovascular disease prevention and control. Geneva: World Health Organization; 2011.
3. Mir E, Attarzadeh Hosseini SR, Hejazi K, Mir Sayeedi M. [Effect of eight weeks of endurance and resistance training on serum adiponectin and Insulin re-sistance index of inactive elderly men (Persian)]. Journal of Gorgan University of Medical Sciences. 2016; 18(1):69-77.
4. Olivetti G, Giordano G, Corradi D, Melissari M, Lagrasta C, Gambert SR, et al. Gender differences and aging: Effects on the human heart. Journal of the American College of Cardiology. 1995; 26(4):1068–79. doi: 10.1016/0735-1097(95)00282-8 [DOI:10.1016/0735-1097(95)00282-8]
5. Miyauchi T, Masaki T. Pathophysiology of endothelin in the cardiovascular system. 1999; 61(1):391–415. doi: 10.1146/annurev.physiol.61.1.391 [DOI:10.1146/annurev.physiol.61.1.391]
6. Guang-da X, Yun-lin W. Regular aerobic exercise training improves endothelium-dependent arterial dilation in patients with impaired fasting glucose. Di-abetes Care. 2004; 27(3):801–2. doi: 10.2337/diacare.27.3.801 [DOI:10.2337/diacare.27.3.801]
7. Zhang W, Li XJ, Zeng X, Shen DY, Liu CQ, Zhang H-J, et al. Activation of nuclear factor-κB pathway is responsible for tumor necrosis factor-α-induced up-regulation of endothelin B2 receptor expression in vascular smooth muscle cells in vitro. Toxicology Letters. 2012; 209(2):107–12. doi: 10.1016/j.toxlet.2011.12.005 [DOI:10.1016/j.toxlet.2011.12.005]
8. Green DJ, Maiorana A, O'Driscoll G, Taylor R. Effect of exercise training on endothelium-derived nitric oxide function in humans. The Journal of Physiolo-gy. 2004; 561(1):1–25. doi: 10.1113/jphysiol.2004.068197 [DOI:10.1113/jphysiol.2004.068197]
9. Franke WD, Anderson DF. Relationship between physical activity and risk factors for cardiovascular disease among law enforcement officers. Journal of Occupational and Environmental Medicine. 1994; 36(10):1127–32. doi: 10.1097/00043764-199410000-00016 [DOI:10.1097/00043764-199410000-00016]
10. Jarrete AP, Novais IP, Nunes HA, Puga GM, Delbin MA, Zanesco A. Influence of aerobic exercise training on cardiovascular and endocrine-inflammatory biomarkers in hypertensive postmenopausal women. Journal of Clinical & Translational Endocrinology. 2014; 1(3):108–14. doi: 10.1016/j.jcte.2014.07.004 [DOI:10.1016/j.jcte.2014.07.004]
11. Krause M, Rodrigues-Krause J, O'Hagan C, Medlow P, Davison G, Susta D, et al. The effects of aerobic exercise training at two different intensities in obe-sity and type 2 diabetes: implications for oxidative stress, low-grade inflammation and nitric oxide production. European Journal of Applied Physiology. 2013; 114(2):251–60. doi: 10.1007/s00421-013-2769-6 [DOI:10.1007/s00421-013-2769-6]
12. Buttar HS, Li T, Ravi N. Prevention of cardiovascular diseases: Role of exercise, dietary interventions, obesity and smoking cessation. Experimental & Clin-ical Cardiology. 2005; 10(4):229-49. PMCID: PMC2716237 [PMID] [PMCID]
13. Kromhout D. Prevention of coronary heart disease by diet and lifestyle: evidence from prospective cross-cultural, cohort, and intervention studies. Circula-tion. 2002; 105(7):893–8. doi: 10.1161/hc0702.103728 [DOI:10.1161/hc0702.103728]
14. Sternfeld B, Ainsworth BE, Quesenberry CP. Physical activity patterns in a diverse population of women. Preventive Medicine. 1999; 28(3):313–23. doi: 10.1006/pmed.1998.0470 [DOI:10.1006/pmed.1998.0470]
15. Bartlett JE, Kotrlik JW, Higgins CC. Organizational research: Determining appropriate sample size in survey research appropriate sample size in survey re-search. Information Technology, Learning, and Performance Journal. 2001; 19(1):43-50.
16. American College of Sports Medicine. ACSM's guidelines for exercise testing and prescription. Philadelphia, Pennsylvania: Lippincott Williams & Wil-kins; 2013.
17. Irving BA, Davis CK, Brock DW, Weltman JY, Swift D, Barrett EJ, et al. Effect of exercise training intensity on abdominal visceral fat and body composi-tion. Medicine & Science in Sports & Exercise. 2008; 40(11):1863–72. doi: 10.1249/mss.0b013e3181801d40 [DOI:10.1249/MSS.0b013e3181801d40]
18. Donnelly J, Smith B, Jacobsen D, Kirk E, Dubose K, Hyder M, et al. The role of exercise for weight loss and maintenance. Best Practice & Research Clinical Gastroenterology. 2004; 18(6):1009–29. doi: 10.1016/s1521-6918(04)00083-6 [DOI:10.1016/S1521-6918(04)00083-6]
19. Slentz CA, Duscha BD, Johnson JL, Ketchum K, Aiken LB, Samsa GP, et al. Effects of the amount of exercise on body weight, body composition, and measures of central obesity. Archives of Internal Medicine. 2004; 164(1):31. doi: 10.1001/archinte.164.1.31 [DOI:10.1001/archinte.164.1.31]
20. Marra CC, Bottaro MM, Oliveira RJ, Novaes JS. Effect of moderate and high intensity aerobic exercise on body composition in over weight men. Medicine & Science in Sports & Exercise. 2003; 35(Supplement 1):S308. doi: 10.1097/00005768-200305001-01705 [DOI:10.1097/00005768-200305001-01705]
21. De Glisezinski I, Moro C, Pillard F, Marion-Latard F, Harant I, Meste M, et al. Aerobic training improves exercise-induced lipolysis in SCAT and lipid utilization in overweight men. American Journal of Physiology-Endocrinology and Metabolism. 2003; 285(5):E984–E990. doi: 10.1152/ajpendo.00152.2003 [DOI:10.1152/ajpendo.00152.2003]
22. Martins C, Morgan LM, Bloom SR, Robertson MD. Effects of exercise on gut peptides, energy intake and appetite. Journal of Endocrinology. 2007; 193(2):251–8. doi: 10.1677/joe-06-0030 [DOI:10.1677/JOE-06-0030]
23. Horowitz JF. Fatty acid mobilization from adipose tissue during exercise. Trends in Endocrinology & Metabolism. 2003; 14(8):386–92. doi: 10.1016/s1043-2760(03)00143-7 [DOI:10.1016/S1043-2760(03)00143-7]
24. Ghahremani Moghaddam M, Hejazi K. [Effect of aerobic training on Endothelin-1 and Malondialdehyde in inactive elderly women (Persian)]. Journal of Gorgan University of Medical Sciences. 2016; 18(3):52-57.
25. Maeda S, Tanabe T, Miyauchi T, Otsuki T, Sugawara J, Iemitsu M, et al. Aerobic exercise training reduces plasma endothelin-1 concentration in older women. Journal of Applied Physiology. 2003; 95(1):336–41. doi: 10.1152/japplphysiol.01016.2002 [DOI:10.1152/japplphysiol.01016.2002]
26. Muratli HH, Çelebi L, Hapa O, Biçimoğlu A. Comparison of plasma endothelin levels between osteoporotic, osteopenic and normal subjects. BMC Mus-culoskeletal Disorders. 2005; 6(1):49. doi: 10.1186/1471-2474-6-49 [DOI:10.1186/1471-2474-6-49]
27. Donato A, Lesniewski L, Delp M. he effects of aging and exercise training on endothelin-1 vasoconstrictor responses in rat skeletal muscle arterioles. Cardi-ovascular Research. 2005; 66(2):393–401. doi: 10.1016/j.cardiores.2004.10.023 [DOI:10.1016/j.cardiores.2004.10.023]
28. Suen RS, Rampersad SN, Stewart DJ, Courtman DW. Differential roles of endothelin-1 in angiotensin II-induced atherosclerosis and aortic aneurysms in apolipoprotein E-null mice. The American Journal of Pathology. 2011; 179(3):1549–59. doi: 10.1016/j.ajpath.2011.05.014 [DOI:10.1016/j.ajpath.2011.05.014]
29. Radovanovic D, Stankovic N, Ponorac N, Nurkic M, Bratic M. Oxidative stress in young judokas: effects of four week pre-competition training period. Ar-chives of Budo. 2012; 8:147–51. doi: 10.12659/aob.883328 [DOI:10.12659/AOB.883328]
30. Egginton S. Unorthodox angiogenesis in skeletal muscle. Cardiovascular Research. 2001; 49(3):634–46. doi: 10.1016/s0008-6363(00)00282-0 [DOI:10.1016/S0008-6363(00)00282-0]
31. Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Laboratory Investigation. 2004; 85(1):9–23. doi: 10.1038/labinvest.3700215 [DOI:10.1038/labinvest.3700215]
32. Higashi Y, Yoshizumi M. Exercise and endothelial function: Role of endothelium-derived nitric oxide and oxidative stress in healthy subjects and hyperten-sive patients. Pharmacology & Therapeutics. 2004; 102(1):87–96. doi: 10.1016/j.pharmthera.2004.02.003 [DOI:10.1016/j.pharmthera.2004.02.003]
33. Harrison Dg, Widder J, Grumbach I, Chen W, Weber M, Searles C. Endothelial mechanotransduction, nitric oxide and vascular inflammation. Journal of In-ternal Medicine. 2006; 259(4):351–63. doi: 10.1111/j.1365-2796.2006.01621.x [DOI:10.1111/j.1365-2796.2006.01621.x]
34. Irani K. Oxidant signaling in vascular cell growth, death, and survival: A review of the roles of reactive oxygen species in smooth muscle and endothelial cell mitogenic and apoptotic signaling. Circulation Research. 2000; 87(3):179–83. doi: 10.1161/01.res.87.3.179 [DOI:10.1161/01.RES.87.3.179]
35. Xu Q. Role of heat shock proteins in atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 2002; 22(10):1547–59. doi: 10.1161/01.atv.0000029720.59649.50 [DOI:10.1161/01.ATV.0000029720.59649.50]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







