دوره 20، شماره 1 - ( بهار 1404 )
جلد 20 شماره 1 صفحات 19-2 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Assadiasl S, Safdel S, Hossein Nicknam M. A Review of Senolytic Drugs in Reducing the Biological Problems of Aging. Salmand: Iranian Journal of Ageing 2025; 20 (1) :2-19
URL: http://salmandj.uswr.ac.ir/article-1-2767-fa.html
URL: http://salmandj.uswr.ac.ir/article-1-2767-fa.html
اسدی اصل سارا، صافدل سپهر، نیک نام محمدحسین. مروری بر نقش داروهای سنولیتیک در کاهش مشکلات زیستشناختی ناشی از پیری سلولی. سالمند: مجله سالمندی ایران. 1404; 20 (1) :2-19
سارا اسدی اصل*1 

 ، سپهر صافدل2
، سپهر صافدل2 

 ، محمدحسین نیک نام3
، محمدحسین نیک نام3 




 ، سپهر صافدل2
، سپهر صافدل2 

 ، محمدحسین نیک نام3
، محمدحسین نیک نام3 


1- مرکز تحقیقات ایمونولوژی مولکولی، دانشگاه علوم پزشکی تهران، تهران، ایران. & مرکز تحقیقات و بانک فرآوردههای پیوندی، دانشگاه علوم پزشکی تهران، تهران، ایران. ، assadiasl@sina.tums.ac.ir
2- مرکز تحقیقات ایمونولوژی مولکولی، دانشگاه علوم پزشکی تهران، تهران، ایران.
3- مرکز تحقیقات ایمونولوژی مولکولی، دانشگاه علوم پزشکی تهران، تهران، ایران. و گروه ایمونولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی تهران، تهران، ایران.
2- مرکز تحقیقات ایمونولوژی مولکولی، دانشگاه علوم پزشکی تهران، تهران، ایران.
3- مرکز تحقیقات ایمونولوژی مولکولی، دانشگاه علوم پزشکی تهران، تهران، ایران. و گروه ایمونولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی تهران، تهران، ایران.
متن کامل [PDF 6897 kb]
(2125 دریافت)
| چکیده (HTML) (5250 مشاهده)
یافتهها
داروهای سنولیتیک
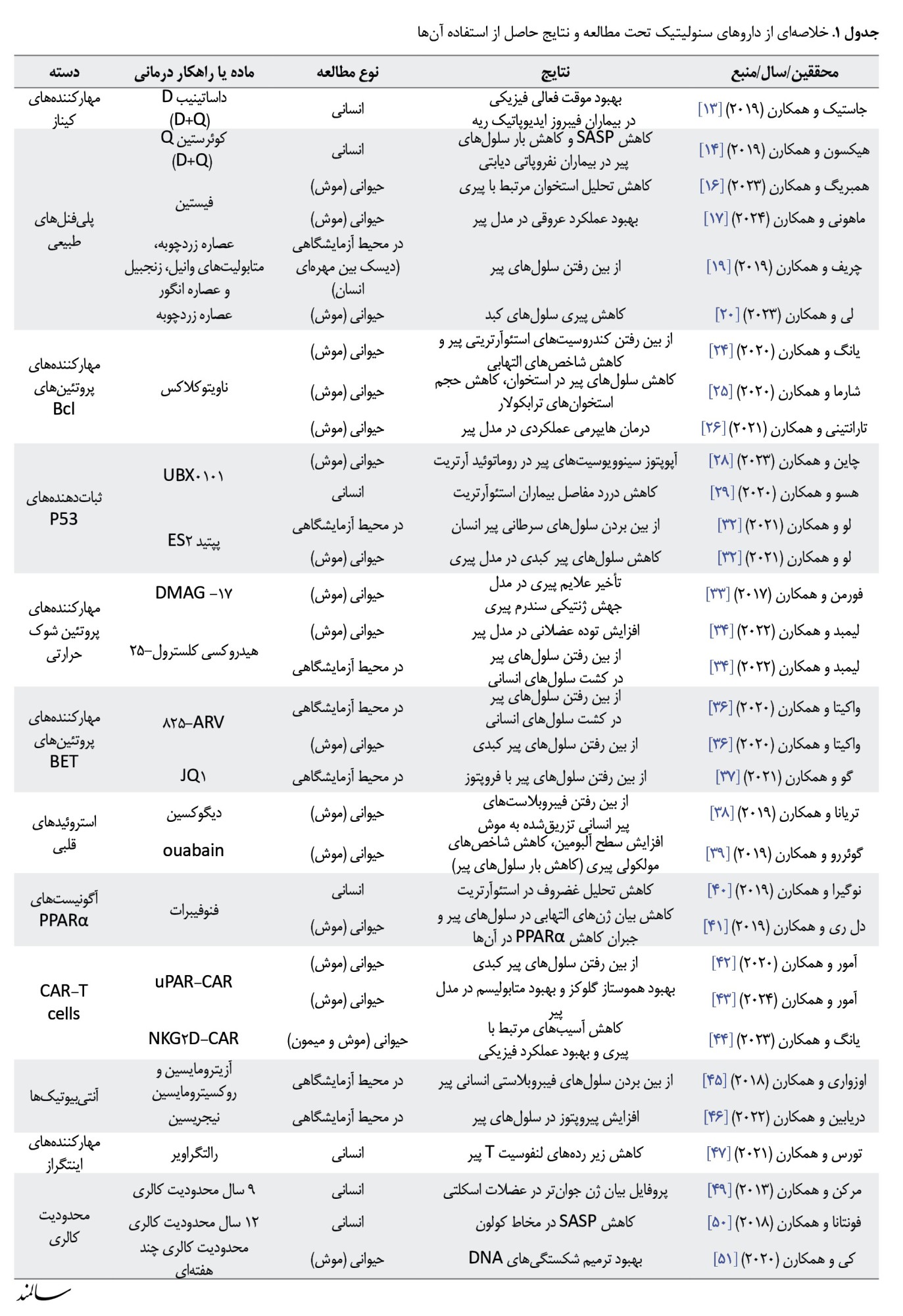
داروهای سنولیتیک اولین بار در سال 2015 معرفی شدند. مکانیسم اصلی عملکرد این داروها مهار مسیرهای ضدآپوپتوتیک در سلولهای پیر و آغاز روند آپوپتوز در این سلولها بدون آسیب زدن به سلولهای غیرفعال یا در حال تکثیر میباشد [7]. مولکولهای آپوپتوتیک هدف این داروها شامل پروتئین کینازهایی همچون ephrin B و فسفواینوزیتید-3 کیناز (PI3K) و خانواده Bcl2 هستند [8]. به همین دلیل است که عمده داروهای سنولیتیک فعلی جزء دسته داروهایی هستند که در درمان سرطانها کاربرد دارند. بهعلاوه، راهکارهای درمانی جدیدی همچون استفاده از CAR-T cells[9] هم دراینمیان مطرح شدند و مورد بررسی قرار گرفتند. در این بخش دستههای دارویی مختلف با خاصیت سنولیتیک و خلاصهای از دستاوردهای پیشبالینی یا بالینی مربوط به آنها مرور میشود (جدول شماره 1).
مهارکنندههای آنزیم کیناز
کینازها در بخشهای مختلف عملکرد سلولی مانند سیگنالینگ سایتوکاینی، توقف سیکل سلولی و پاسخ به آسیبهای محیطی نقش دارند. امروزه مهارکنندههای کیناز در درمان عوارض التهابی متعدد، بیماریهای روماتولوژیک و عفونتهای غیرقابلکنترل و همچنین در درمان برخی سرطانهای خونی تأیید شدند و کاربرد دارند [10, 11]. یکی از داروهای این دسته که آثار سنولیتیک آن مشاهده شده است داساتینیب میباشد. داساتینیب یا به اختصار D، یک مهارکننده تیروزین کیناز دوگانه ABL/SRC کوتاه اثر خوراکی است. داساتینیب یک درمان مؤثر برای لوسمی میلوئیدی مزمن (CML) و لوسمی لنفوبلاستیک حاد کروموزوم فیلادلفیا مثبت (Ph+ALL) میباشد. این دارو بهخوبی کینازهای خانواده Bcr-Abl و Src (Src ،Lck ،Yes ،Fyn) همچنین c-KIT، PDGFR-α و PDGFR-β و گیرنده کیناز ephrin را مهار میکند [12].
پلیفنلهای طبیعی
کوئرستین
کوئرستین یا Q فلاونوئید اصلی موجود در سبزیجات و میوهها است. کوئرستین در رژیم غذایی روزانه مصرف میشود، اما در دهه 1970 بهعنوان مادهای جهشزا گزارش شد.
ترکیب D+Q برای اولین بار در سال 2019 در یک مطالعه آزمایشی برای درمان فیبروز ایدیوپاتیک ریه (IPF) استفاده شد. در این مطالعه D+Q بهصورت 3 روز متوالی به 14 بیمار داده شد. طی هفتههای اول و دوم پس از تجویز این ترکیب، فعالیت فیزیکی بیماران بهبود متوسطی نشان داد. بااینحال، هیچ پیشرفتی در عملکرد ریه و کیفیت زندگی مرتبط با بیماری مشاهده نشد. نکته جالب توجه اینکه تغییری در سطح اجزای SASP در گردش خون بیماران ایجاد نشد که مکانیسم ضدپیری در کارآمدی این داروها را زیر سؤال میبرد و این فرض را مطرح میکند که شاید این ترکیب از مسیر دیگری باعث بهبود عملکرد این افراد گردید [13]. کارآزمایی دیگری که با این ترکیب دارویی صورت گرفت بر روی 9 بیمار دچار نفروپاتی دیابتی بود که D+Q بهصورت 3 روز متوالی و بهصورت خوراکی برای این افراد تجویز شد و پس از 11 روز هم باعث کاهش سطح اجزای SASP و هم کاهش بار سلولهای پیر گردید [14]. باتوجهبه این یافتهها، اثربخشی و عوارض D+Q بهعنوان یک ترکیب سنولیتیک در کارآزماییهای بالینی دیگری تحت بررسی میباشد که هنوز نتایج آنها منتشر نشده است.
فیستین
فیستین یا 3 ,3 ,4 ,7-tetrahydroxyflavone، یک مولکول فلاونول زیست فعال است که در میوهها و سبزیجاتی مانند توت فرنگی، سیب، خرمالو، انگور، پیاز و خیار در غلظتهای بین 2 تا 160 میکروگرم بر گرم یافت میشود [15]. اخیراًً تأثیر فیستین در کاهش تحلیل استخوانی مرتبط با پیری در مدلهای موشی نشان داده شده است [16]. همچنین مشاهده شد که رژیم غذایی متناوب حاوی فیستین میتواند باعث بهبود عملکرد عروقی در مدلهای موشی پیر شود [17]. باتوجهبه اثر فیستین در مهار تولید SASP از سلولهای پیر و درنتیجه مهار نسبی واکنشهای التهابی، مطالعه بالینی در بیماران کووید-19 در حال انجام است که اثر این ماده را در کاهش علائم بیماران بررسی میکند [18].
مواد دیگر
مواد دیگر در این دسته که خواص سنولیتیک خفیفی در آنها مشاهده شده است curcumin یا عصاره زرد چوبه، o-vanilinn از متابولیتهای وانیل، gingerenone A در زنجبیل و procyanidin C1 در عصاره انگور میباشند. یک مطالعه در محیط آزمایشگاهی نشان داده است که curcumin و o-vanilinn توانایی از بین بردن سلولهای پیر موجود در دیسک بین مهرهای انسان را دارند [19]. بهعلاوه، در مدلهای موشی پیر و چاق، رژیم غذایی حاوی curcumin در مقایسه با رژیم غذایی عادی بهطور معنیداری باعث کاهش پیری سلولهای بافت کبدی در این موشها شد [20].
مهارکنندههای خانواده پروتئینهای Bcl
خانواده پروتئینهای Bcl شامل Bcl-2, Bcl-w, BclXL, Mcl-1 میباشد که به خاطر تأثیری که در پایداری سلولهای با فنوتیپ پیری دارند اهداف مناسبی برای داروهای ضدپیری میباشند [21]. یکی از مهمترین داروهای سنولیتیک که برای مهار عملکرد این دسته پیشنهاد شده است ناویتوکلاکس میباشد. ناویتوکلاکس شکل تکاملیافته ABT-737 است که خود از ABT-263 مشتق شده است [22]. باتوجهبه اثرات ضدپیری قوی ناویتوکلاکس، مطالعاتی در زمینه این دارو انجام شده است. بهعنوانمثال مشاهده شد این دارو باعث مهار نارسایی قلب ناشی از آنژیوتانسین II در موش میگردد [23].
همچنین استفاده از ناویتوکلاکس در مدلهای استئوآرتریت موش صحرایی به پاکسازی کندروسیتهای استئوآرتریتی پیر منجر شده و آنها را با کندروسیتهای جوان جایگزین کرده است. در این مدلها، شاخصهای التهابی نیز بهطور معنیداری کاهش یافتند [24]. بااینحال، در مدل موشی پیر، این دارو با وجود کاهش فراوانی سلولهای پیر در بافت استخوانی، باعث کم شدن حجم استخوانهای ترابکولار شد و توانایی استئوبلاستهای مشتق از سلولهای مزانشیمی مغز استخوان در تولید ماتریکس معدنی دچار اختلال شد [25]. ناویتوکلاکس در درمان هایپرمی (پرخونی) عملکردی در موشهای پیر نیز نتایج قابلقبولی نشان داده است [26]. در این رابطه، عوارضی همچون کاهش تعداد پلاکتهای خون نیز به دنبال مصرف این دارو گزارش شده است، اما با گالاکتوکونژوگه کردن این دارو هم عوارض پلاکتی آن کاهش مییابد و هم اختصاصیت آن در هدف قرار دادن سلولهای پیر بیشتر میشود [27].
ثباتدهندههای p53
مولکول p53 نقش کلیدی در پاسخ به آسیب DNA و تنظیم چرخه سلولی دارد و میتواند آپوپتوز را از راههای مختلفی القا کند. یکی از داروهای مهم ثباتدهنده این مولکول UBX0101 است. UBX0101یک مهارکننده تعامل p53/ MDM2 است. درواقع، MDM2مولکول تنظیمکنننده p53 بوده و ترکیب p53/ MDM2باعث کاهش پایداری p53 میگردد. یک مطالعه نشان داده است UBX0101آپوپتوز سینوویوسیتهای پیر را در نمونه موشی استئوآرتریت القا میکند. همچنین این ماده میزان تغییرات اکسیداتیو پروتئینها را در آرتروز مفصل زانو در موشهای پیر کاهش داد [28]. این دارو در فاز 1 مطالعه بالینی در بیماران مبتلا به استئوآرتریت باعث کاهش درد در بیماران شد اما باتوجهبه نوع پرسشنامه و فردی بودن جوابهای دادهشده، این یافته چندان معتبر ارزیابی نشدند [29]. بنابراین مطالعه مشابهی در فاز 2 انجام شد که در آن به 177 بیمار دچار استئوآرتریت یک تک دُز این دارو داده شد و میزان درد در ایشان بررسی شد، اما یافتههای این مطالعه هیچ تغییر محسوسی در میزان درد در مفاصل بیماران یا عملکرد ایشان در مقایسه با گروه کنترل نشان نداد. همچنین مشخص نشد UBX0101 تغییری در میزان SASP یا در تعداد سلولهای پیر میدهد یا خیر [30]، اما مطالعات پیشین نشان میداد که مولکولهای مهارکننده تعامل p53/MDM2 بیشتر قادر به کاهش SASP هستند تا از بین بردن سلولهای پیر [31]. بههرحال نتایج این مطالعه هم چندان قابلاتکا نبود، چراکه ممکن است یک دُز این دارو برای اعمال اثر کافی نباشد و نیاز به مطالعات تکمیلی برای بررسی اثربخشی این دارو در انسان وجود دارد.
دیگر ماده مؤثر در افزایش فعالیت p53، مهارکنندههای FOXO4-TP53 هستند. در شرایط استرس سلولی، TP53 با فاکتور رونویسی (FOXO)4 تعامل میکند و درنتیجه با تنظیم رونویسی پروتئین P21 مرتبط با پیری، پیری سلولی را القا میکند. بنابراین با گسستن تعامل بین این دو مولکول نیز میتوان این روند را مختل کرد. اخیراًً یک پپتید به نام ES2 طراحی شده که مانع از واکنش بین این دو مولکول میشود و TP53 را برای القای آپوپتوز آزاد میکند. مطالعات نشان دادهاند که اینگونه پپتیدها میتوانند بهعنوان سنولیتیک برای از بین بردن سلولهای سرطانی انسانی پیر در کشت سلولی و هم در مدلهای موشی به کار روند. بهعنوانمثال، تزریق سیستمیک مکرر ES2 به موشهای مسن به کاهش تعداد سلولهای پیر در کبد با حداقل سمیت منجر شد [32].
مهارکنندههای پروتئینهای شوک حرارتی
پروتئینهای شوک حرارتی (Hsp) عموماً در شرایط استرس سلولی تولید میشوند و باعث القای فعالیتهای التهابی و ترمیمی در بافت میگردند. اخیراًً این دسته پروتئینی بهعنوان هدف داروهای سنولیتک مورد مطالعه قرار گرفتهاند. در یک مطالعه حیوانی در موشهای مدل سندرم پیری با جهش ژنتیکی 1ccrE-/∆ درمان با مهارکننده Hsp90 یعنی DMAG -17 باعث افزایش دوره سلامت و تأخیر در بروز علایم پیری گردید [33]. پروتئین CRYAB نیز بهعنوان یک پروتئین شوک حرارتی، مورد هدف داروهای سنولیتیک قرار گرفته است. استفاده از ماده هیدروکسی کلسترول-25 بهعنوان مهارکننده CRYAB در مدلهای موشی پیر به افزایش توده عضلانی در این حیوانات منجر شد. همچنین مطالعه in vitro نشان داد این ماده باعث سینولیز (از بین رفتن سلولهای پیر) در کشت سلولهای ریه، قلب، کبد، کلیه، و غضروف مفصل انسانی میشود [34].
مهارکنندههای خانواده پروتئین BET
خانواده پروتئینهای BET در تنظیم نسخهبرداری در هسته نقش دارند و مهار آنها در درمان برخی سرطانها و بیماریهای التهابی تأثیرات مثبتی نشان داده است [35]. همچنین مواد مهارکننده BET بهعنوان داروهای سنولیتیک بررسی شدهاند. بهعنوانمثال، یک داروی BETd به نام ARV-825 ازیکسو، با کاهش NHEJ، و ازسویدیگر با افزایش بیان ژنهای مرتبط با اتوفاژی در محیط in vitro سبب از بین رفتن ردههای سلولی پیر انسانی و سلولهای کبدی پیر در موشها گردید [36]. داروی سنولیتیک دیگر در این دسته JQ1 است که نشان داده شد میتواند سلولهای پیر را از طریق فروپتوز (نوعی مرگ سلولی وابسته به آهن) حذف کند. این تحقیق همچنین پیشنهاد میکند فروپتوز ممکن است بهعنوان یک مکانیسم جدید در طراحی داروهای سنولیتیک مورد استفاده قرار گیرد [37].
استروئیدهای قلبی
استروئیدها یا گلیکوزیدهای قلبی بهطور گستردهای در درمان نارسایی قلبی استفاده میشوند. از داروهای این دسته میتوان به دیگوکسین اشاره کرد. این داروها با مکانسیمهایی ازجمله هدف قرار دادن پمپهای Na+/K+ATPase، باعث برهم زدن گرادیان الکتروشیمیایی و اسیدی شدن محیط داخل سلول میشوند. غشاء پلاسمایی سلولهای پیر غلظت بیشتری از یون هیدروژن دارند که آنها را نسبت به عملکرد گلیکوزیدهای قلبی حساستر میکند. در یک مطالعه، به ریه موشها، سلولهای فیبروبلاست پیر انسانی تزریق شد و پس از یک دوره درمان با دیگوکسین، مشاهده شد که سطح بیان p16INK4a که یک نشانگر رایج برای سنجش فراوانی سلولهای پیر است، کاهش یافت. این نتایج نشاندهنده اثرات مثبت دیگوکسین بر کاهش سلولهای فیبروبلاستی پیر میباشد [38]. گلیکوزید قلبی دیگر، ouabain، نیز بهعنوان یک عامل سنولیتیک شناخته شده است. سلولهای پیر نسبت به آپوپتوز ایجادشده توسط ouabainحساستر هستند. در یک مطالعه بر روی موشهای ماده با سن 24 ماه پس از 5 دوره درمان با ouabain، مشاهده شد سطوح آلبومین در خون که در طول پیری کاهش مییابد، پس از دریافت این ماده بهطور قابلتوجهی افزایش یافت. همچنین، کاهش سطح بیان p16INK4aدر چندین بافت مانند کبد، قلب و کلیه در موشهای پیر تحت درمان با ouabain نسبت به گروه کنترل مشاهده شد. همچنین، در کبد، کاهش قابلملاحظهای در فعالیت SA-β-Gal نیز مشاهده شد که نشاندهنده کاهش تعداد سلولهای پیر موجود در موشها بود [39].
آگونیستهای PPARα
PPARα یک گیرنده هورمون هستهای است که اکسیداسیون و انتقال اسیدهای چرب را تنظیم میکند. فنوفیبرات، یک آگونیست PPARα است که برای درمان اختلالات تنظیم سطح چربی در انسان استفاده میشود. اخیراً نشان داده شده است که این دارو خواص درمانی در استئوآرتریت و تحلیل غضروف دارد [40]. در ادامه مشخص شد فنوفیبرات باعث افزایش آپوپتوز و اتوفاژی در سلولهای پیر میشود و سطح بیان ژنهای التهابی IL-6 ،CXCL8 ،CCL2 و CDKN2A را در سلولهای پیر کاهش میدهد. علاوهبراین مشاهده شد بیان PPARα با افزایش سن در موشها کاهش مییابد که این دادهها در کنار هم میتوانند آگونیستهای PPARα را بهعنوان یک داروی جدید سنولیتیک مطرح کنند [41].
CAR-T cells
باتوجهبه اختصاصیت بالای CAR-T cellsها در هدف قرار دادن مولکولهای سطحی سلولهای مختلف، به نظر میرسد این راهکار درمانی در از بین بردن انتخابی سلولهای پیر کارآمد باشد [9]. در یک مطالعه موشی، ابتدا بهمنظور شناسایی یک هدف پروتئینی مناسب که بهطور گسترده و اختصاصی بر روی سطح سلولهای پیر بیان شد، مجموعه دادههای RNAseq مشتقشده از سه مدل القای پیری شامل 1. پیری ناشی از درمان در آدنوکارسینوم ریه موش، 2. پیری ناشی از انکوژن در سلولهای کبدی موش و 3. پیری ناشی از کشت سلولهای ستارهای کبدی موش بررسی شد و uPAR بهعنوان یک پروتئین که بر روی سلولهای پیر به میزان زیاد بیان میشود و نقش حیاتی در سلولهای نرمال ندارد و اساسا ًدر اکثر سلولهای طبیعی بیان نمیشود، انتخاب شد. همچنین مشاهده شد uPAR در بافتهای بیماران مبتلا به اختلالات مرتبط با پیری به میزان بالایی بیان میشود. سپس برای ارزیابی اینکه آیا سلولهای uPAR- CAR میتوانند بهعنوان یک سنولیتیک واقعی در داخل بدن عمل کنند، از مدل موشی با پیری ناشی از انکوژن استفاده شد و مشاهده گردید که uPAR-CAR توانایی پاکسازی مؤثر سلولهای کبدی پیر را دارد. تجزیهوتحلیلهای بافتشناسی تأیید کرد که در کبد موشهای تحت درمان با سلولهای uPAR- CAR، تعداد سلولهای بیانکننده SA-β-Gal بهطور قابلتوجهی کاهش یافته است [42].
در ادامه، در مطالعهای دیگر این گروه با تمرکز بر اختلال متابولیک بهعنوان یکی از آسیبهای مرتبط با پیری، نشان دادند که نسبت سلولهای uPAR مثبت با افزایش سن افزایش مییابد. تزریق سلولهای uPAR- CAR T به مدلهای موشی پیر با بهبود هموستاز گلوکز و بهبود متابولیسم همراه بود. همچنین سلولهای uPAR-CAR Tپس از تجویز یک دُز سبب کاهش متابولیتهای ناشی از افزایش سن و رژیم غذایی، با اثرات طولانیمدتی شد. درواقع، نتایج این مطالعه یک اثر محافظتی بیش از 1 ساله را در برابر پیری فیزیولوژیک در گونهای از موش با میانگین طول عمر 2 سال نشان داد [43]. در مطالعهای دیگر مشاهده شد که بیان NKG2DLsدر سلولهای پیر افزایش مییابد برایناساس، یک NKG2D- CAR T cells که NKG2DL را هدف قرار میداد سنتز شد و مشاهده شد که بهطور انتخابی سلولهای پیرانسانی را در شرایط آزمایشگاهی هدف قرار میدهند. در ادامه، هدف قرار دادن سلولهای پیر موشی در شرایط in vivo مورد بررسی قرار گرفت و مشاهد شد که آسیبهای بافتی متعدد مرتبط با پیری کاهش یافته و عملکرد فیزیکی در موشهای پیری بهبود مییابد. سپس با مطالعه بر پستانداران غیرانسانی (Rhesus و (cynomolgus macaques نتایج مشابه و بدون هیچگونه عوارض جانبی مشاهده شده شد [44].
آنتیبیوتیکها
به دنبال مطرح شدن این نظریه که شاید آنتیبیوتیکها خاصیت سینولیز داشته باشند، در یک مطالعه با هدف شناسایی و استفاده بهعنوان سنولیتیک، 15 آنتیبیوتیک تأییدشده توسط FDA مورد بررسی قرار گرفتند. در این مطالعه، بهطور خلاصه از BrdU بهعنوان یک عامل آسیبرسان به DNA، برای القای پیری بر روی دو رده سلولی فیبروبلاست انسانی MRC-5 و BJ استفاده شد و سپس توانایی هدف قرار دادن جمعیت سلولی پیر توسط آنتیبیوتیکها با استفاده از یک سیستم سنجش سنولیتیک مورد ارزیابی قرار گرفت. در این غربالگری، آزیترومایسین و روکسیترومایسین بهعنوان دو داروی سنولیتیک شناسایی شدند [45]. همچنین در مطالعهای دیگر نیجریسین که یک آنتیبیوتیک محلول در چربی و واسطه تبادل الکتریکی H+ و K+ میباشد مورد بررسی قرار گرفت و مشاهده شد این آنتیبیوتیک به کاهش K+ داخل سلولی و متعاقب آن القای پیروپتوز در سلولهای پیر منجر میشود [46]. بااینحال، هنوز مطالعه حیوانی یا انسانی تأییدکننده یافتههای فوق در دست نیست.
مهارکنندههای اینتگراز
Raltegravir یک دارروی مهارکننده اینتگراز است و از دسته مواد ضدویروسی است که اینتگراز ویروس HIV را هدف قرار میدهد، در یک مطالعهای که بر روی 48 بیمار مبتلا به HIV انجام شده بود، مشاهده شد این دارو بهطور قابلتوجهی باعث کاهش زیرگروههای لنفوسیتهای T پیر میشود [47].
محدودیت کالری
اگرچه محدودیت کالری یک مداخله دارویی محسوب نمیشود اما باتوجهبه نتایج حاصل از مطالعات حیوانی و انسانی میتواند تأثیرات مشابه با داروهای سینولیتک داشته باشد. درواقع، روزهداری یا محدود کردن مصرف کالری بدون سوء تغذیه یکی از مؤثرترین راهها برای به تأخیر انداختن فنوتیپ پیری در سلولها محسوب میشود. اخیراًً مشاهده شده است محدودیت کالری میتواند از تجمع سلولهای پیر در انسان و موش جلوگیری کند [48]. در یک مطالعه که بر روی 15 فرد میان سال که بهطور میانگین بیش از 9 سال تحت رژیم محدودیت کالری بودند انجام شد، مشاهده شد این افراد پروفایل بیان ژن جوانتری در عضلات اسکلتی نسبت به افراد گروه کنترل نشان میدهند و بیان ژنهای PI3K و PKB در این افراد بهطور قابلتوجهی کاهش یافته است [49]. در مطالعهای دیگر که بر روی 12 فرد که بهطور میانگین بهمدت 10سال تحت رژیم محدودیت کالری بودند انجام شد، بیان فاکتورهای SASP (p16، MMP9، IL-1A، IL-6 و IL-1a) در مخاط کولون نسبت به افراد گروه کنترل کاهش معنیداری نشان داد [50]. مکانیسم دیگری که محدودیت کالری میتواند از طریق آن تأثیرگذار باشد جلوگیری از تولید ضایعات DNA و کمک به ترمیم آنها میباشد. در مطالعهای که بر روی موشهای صحرایی انجام شد مشاهده گردید محدودیت کالری کاهش وابسته به سن فعالیت اتصال انتهایی غیرهمولوگ (NHEJ) را در بافت موش کاهش میدهد که این ویژگی، ترمیم شکستگیهای DNA دو رشتهای را بهبود میبخشد [51].
بحث
باتوجهبه پیری روزافزون جمعیت و افزایش آمار بیماریهای مزمن ناشی از اختلال عملکرد سلولهای دچار پیری، نیاز به ابداع راه کارهای جدیدی در زمینه کاهش عوارض پیری بافتها وجود دارد. بدین منظور، روشهای گوناگونی برای حذف انتخابی سلولهای پیر پیشنهاد شده که در مراحل مختلف تحقیقاتی هستند و بعضاً نتایج قابلتوجهی در محیطهای in vitro، در مطالعات حیوانی و کارآزماییهای بالینی نشان دادهاند.
داروهای سنولیتیک نامی است که طی سالهای اخیر به این مجموعه راهکارهای درمانی اطلاق میشود و قطعاً در آینده دستههای دیگری نیز به این گروه دارویی اضافه خواهند شد. نظر به نوپا بودن این حوزه پژوهشی هنوز دارویی بهطور قطعی برای درمان عوارض کهنسالی تأیید نشده است اما افزایش دادهها بهویژه یافتههای منتج از کارآزماییهای بالینی در حال انجام است و در آینده نزدیک به پیشنهاد رژیمهای دارویی استاندارد برای پیشگیری از ایجاد عوارض پیری در جمعیت خواهد انجامید. بنابراین به افزایش اطلاعات جامعه پزشکی ازاین داروها و منافع و عوارض آنها نیاز است.
در مقاله حاضر، مروری کلی بر دستههای داروهای سنولیتیک که تاکنون پیشنهاد شدهاند شده است. برخی ازاین دستهها موردمطالعه بیشتری بوده و به این دلیل که قبلاً استفادههای درمانی دیگری داشتهاند جهت انجام کارآزمایی بالینی مناسبتر و قابلقبولتر بودهاند. از این دسته میتوان به ترکیب داساتینیب و کوئرستین یا به اختصار D+Q اشاره کرد.
داساتینیب بهعنوان دارویی که در درمان برخی سرطانهای خونی کاربرد دارد شناخته شده و کوئرستین نیز یک ماده طبیعی از عصاره گیاهان مختلف بوده و میتواند در رژیم غذایی روزمره افراد وجود داشته باشد. ترکیب این دو ماده در از بین بردن عوارض پیری سلولی نتایج جالب توجهی داشته که برخی از آنها ازجمله کاهش فیبروز ریوی و بهبود بیماریهای مزمن کلیوی منتشر شده [13، 14] و مطالعات دیگری در زمینه کنترل آلزایمر و اختلالات اسکلتی و حرکتی کهنسالی و همچنین کاهش عوارض ثانویه در درمانهای سنگینی همچون پیوند سلولهای بنیادی خونساز، شیمیدرمانی سرطان و عمل بایپس قلب در حال انجام میباشد [6].
ماده سنولیتیک دیگری که در حال حاضر تحت کارآزماییهای متعددی میباشد فیستین است که یک فلاونول زیست فعال گیاهی بوده و فازهای 1 و 2 کارآزمایی درباره اثربخشی و عوارض آن در کنترل استئوآرتریت و تحلیل غضروفی مربوطه، عوارض پس از پیوند سلولهای بنیادی و التهاب ناشی از کووید-19 در حال انجام است [6]. دستههای دیگر سنولیتیکها شامل مهارکنندههای خانواده پروتئینهای Bcl2 و ثباتدهندههای p53 نیز در حال بررسی بالینی میباشند و بهویژه اثربخشی UBX0101 در کنترل عوارض استخوانی، عضروفی و اسکلتی ناشی از افزایش سن در فازهای 1 و 2 کارآزماییهای بالینی در حال مطالعه بر روی بیماران است [6].
مهارکنندههای پروتئینهای شوک حرارتی، مهارکنندههای خانواده پروتئینی BET، آگونیستهای PPARα و استروئیدهای قلبی نیز در فاز مطالعات پیشبالینی بوده و نتایج امیدوارکنندهای در جلوگیری از عوارض پیری در مدلهای موشی نشان دادهاند [37-41]. بهعلاوه، CAR-T cells که برای از بین بردن انتخابی سلولهای سرطانی در بیماران تحت بررسی هستند، باتوجهبه قابلیت نابود کردن سلولهای پیر با مارکرهای اختصاصی بیانشونده در پیری، بهعنوان گزینهای مناسب در طراحی داروهای سنولیتیک در فاز مطالعات حیوانی قرار دارند [43, 44]. دراینمیان داروهایی مهارکنندههای اینتگراز که برای درمان عفونتهای ویروسی کاربرد دارند آثار سنولیتیک مانند از بین بردن لنفوسیتهای T با فنوتیپ پیری از خود نشان دادهاند اما هنوز مطالعه اختصاصی برای بررسی مستقیم کارایی آنها در سنولیز ردههای دیگر سلولی صورت نگرفته است [47]. همچنین آنتیبیوتیکهای مختلف ازلحاظ کیفیت سنولیتیک در حال بررسی میباشند، اما به نظر میرسد این تئوری عمدتاً براساس یافتههای تصادفی در زمینه آثار ثانویه آنتیبیوتیکها استوار است و مکانیسم مولکولی شناختهشدهای برای انتخاب نوع خاصی از آنتیبیوتیکها به این منظور ارائه نشده است [45]. نهایتاً محدودیت کالری مصرفی که از دیرباز بهعنوان یک درمان سنتی برای کاهش عوارض پیری و کنترل التهاب پیشنهاد میشد، بهعنوان راهکاری برای جلوگیری از القای فنوتیپ پیری در سلولها مورد مطالعه میباشد.
بااینحال، راه پیشرو هنوز پر از چالشها و پرسشهایی است که نیازمند پاسخهای دقیق و جامع هستند. تحقیقات دقیقتر درزمینه طول مدت اثر، عوارض جانبی، ایمنی در درازمدت و اثربخشی در شرایط مختلف فیزیولوژیک و پاتولوژیک از اهمیت فراوانی برخوردار است. در آینده، امیدواریم که کاربرد داروهای سنولیتیک در پزشکی، بهعنوان یک راهکار نوین در بهبود سلامت سالمندی و کاهش بار بیماریهای مرتبط با کهنسالی مؤثر باشد. با پیشرفت تحقیقات، انتظار داریم این داروها به یک دوره جدید از پزشکی سالمندی منجر شوند و راهکاری به سوی پیری بهتر و سالمتر باشند.
نتیجهگیری نهایی
داروهای سنولیتیک که شامل دستههای مولکولی متعددی مانند داروهای شیمیدرمانی، آنتیبیوتیکها، مهارکنندههای مولکولهای ضدآپوپتوز و ثباتدهندههای مولکولهای تقویتکننده آپوپتوز، CAR-T سلها و همچنین فراوردههای طبیعی گیاهی و محدودیت کالری غذایی میباشند، تاکنون نتایج امیدوارکنندهای درزمینه کنترل عوارض پیری در مدلهای مختلف تحقیقاتی نشان دادهاند اما هنوز رژیم دارویی استانداردی در این زمینه پیشنهاد نشده است و مطالعات همچنان ادامه دارند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله مرور نظاممند میباشد که بر روی نمونههای انسانی و حیوانی انجام نشده است. برایناساس نیاز به کد اخلاق نبود و تمام قوانین اخلاق در پژوهش رعایت شده است.
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
نگارش متن: سارا اسدی اصل؛ جستوجوی مقالات و جمعآوری دادهها: سپهر صافدل؛ بازبینی و ویرایش متن: محمدحسین نیک نام.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
متن کامل: (1064 مشاهده)
مقدمه
روند رو به رشد جمعیت سالمند مشکل تمام جوامع اعم از توسعهیافته و درحالتوسعه میباشد، بهطوریکه طبق تخمین سازمان بهداشت جهانی، از 6 نفر جمعیت انسانی 1 نفر در سال 2030 سالمند خواهند بود و تا سال2050، 2/1 میلیارد نفر انسان بیش از 60 سال خواهند داشت که این بار اقتصادی، اجتماعی و بهداشتی قابلتوجهی را بر جمعیت و دولتها تحمیل خواهد کرد [1]. علاوهبراین، پیری سلولها میتواند در هر دورهای از زندگی آغاز شود که این عارضه دلیل تعداد قابلتوجهی از بیماریهاست که در ادامه به آنها خواهیم پرداخت.
درواقع پیری سلولی میتواند حتی پیش از تولد آغاز شود. چنانکه در پاتوژنز بیماری سندرم داون شواهدی بر پیری تخمک مادر وجود دارد. بنابراین پیری سلولی عارضهای است که بدون توجه به سن افراد میتواند پایه بروز اختلالات و بیماریهای مختلفی باشد.
داروهای سنولیتیک که هنوز معادل فارسی مناسبی برای آنها ابداع نشده است، اولین بار در سال 2015 معرفی شدند و عملکرد آنها بهعنوان داروهایی که قادر به لیز کردن و کشتن سلولهای پیر هستند، عنوان شد [2] و کاربرد آنها از شکل پیشبالینی به فازهای مختلف مطالعات بالینی کشیده شد. بدین ترتیب، نتایج قابلتوجهی درباره اثربخشی سنولیتیکها در کنترل بیماریهای گوناگون به دست آمد که این مطالعات هنوز هم ادامه دارند و به مرور زمان به تعداد بیماریهای موردمطالعه افزوده میشود. درواقع این داروها با از بین بردن انتخابی سلولهای پیر مشکل عملکردی، التهاب مزمن ناشی از پیری سلولی و حضور فیزیکی سلولهای مقاوم به آپوپتوز را تا حدودی حل میکنند و این باعث بهبود عملکرد بافت مورد نظر میگردد. یکی از شاخصترین بیماریهایی که ناشی از پیری سلولهای عصبی بوده و داروهای سنولیتیک تأثیر مناسبی بر کاهش سرعت پیشرفت آن داشتهاند، آلزایمر میباشد که مطالعات مختلفی درباره اثربخشی این داروها در آن انجام شده و در حال انجام است [3, 4].
در این مقاله مروری خلاصه مکانیسمهای پیری سلولی و اثر انتخابی داروهای سنولیتیک بر این سلولها ، انواع دستههای دارویی و راهکارهای درمانی با تأثیر سنولیتیک و پیشرفتهایی که تاکنون در این زمینه صورتگرفته مورد بحث قرار میگیرد.
پیری سلولی
پیری ازنظر علوم پایه بهصورت بیثباتی ژنومی، فرسودگی یا اختلال عملکرد سلولهای پیشساز، تغییرات تلومریک و اپیژنتیک، هموستاز نامنظم، اختلال عملکرد میتوکندریها، تغییر ارتباطات بین سلولی، التهاب مزمن خفیف، فیبروز بافتی، اختلال در تنظیم میکروبیوم بدن و پیری سلولی تعریف میشود که مجموعه این عوارض به علائمی همچون ضعف، کندی حرکات، تحلیل عضلانی، اختلال شناختی خفیف و کاهش توانایی بهبودی از جراحت یا عفونت منجر میشوند [5]. عوامل فوق در پاتوژنز (بیماریزایی) انواع بیماریهای مزمن نیز مشاهده میشوند و گاه علائم فوق را نیز در این بیماریها مشاهده میکنیم. بنابراین این نظریه مطرح است که با از بین بردن سلولهای دچار پیری بتوان از ایجاد علائم سالمندی و همچنین درمان یا ممانعت از پیشرفت برخی بیماریهای مزمن مرتبط با پیری سلولی جلوگیری کرد.
پیری سلول میتواند توسط عوامل استرسزا از جمله آسیبDNA، جهشهای سرطانی یا فعال شدن انکوژن، اختلال عملکرد میتوکندری، متابولیتهای واکنشی، هیپراکسی یا هیپوکسی، استرس پروتئوتوکسیک، سیگنالهای خارج سلولی، تنشهای مکانیکی، یا عفونتها ایجاد شود. با آسیب DNA، پروتئین p53/p21CIP1/WAF1، p16INK4a/رتینوبلاستوما یا سایر مسیرها که به توقف چرخه سلولی و فنوتیپ ترشحی مرتبط با پیری(SASP) منجر میشوند فعال میشوند. بدین ترتیب با تنظیم مثبت مسیرهای بقا و ضدآپوپتوز مانند خانواده Src کیناز، مسیر سیگنالینگ PI3K-AKT، مسیرهای پروتئین شوک حرارتی (Hsp)، سرپینها، مسیرهای میتوکندری یا پروتئینهای مرتبط با Bcl-2 تنظیمکننده آپوپتوز، سلولهای پیر در برابر آپوپتوز مقاومت میکنند و زنده میمانند [6]. بااینحال، سلولهای پیر قادر به تکثیر نیز نبوده و ظاهراً در فازهای G1 و G2 سیکل سلولی متوقف شدهاند. این سلولها عملکرد طبیعی ندارند و گاه باتوجهبه فنوتیپ SASP قادر به تولید فرآوردههای التهابی در ریزمحیط اطراف خود بوده و به التهاب مزمن منجر میشوند.
روش مطالعه
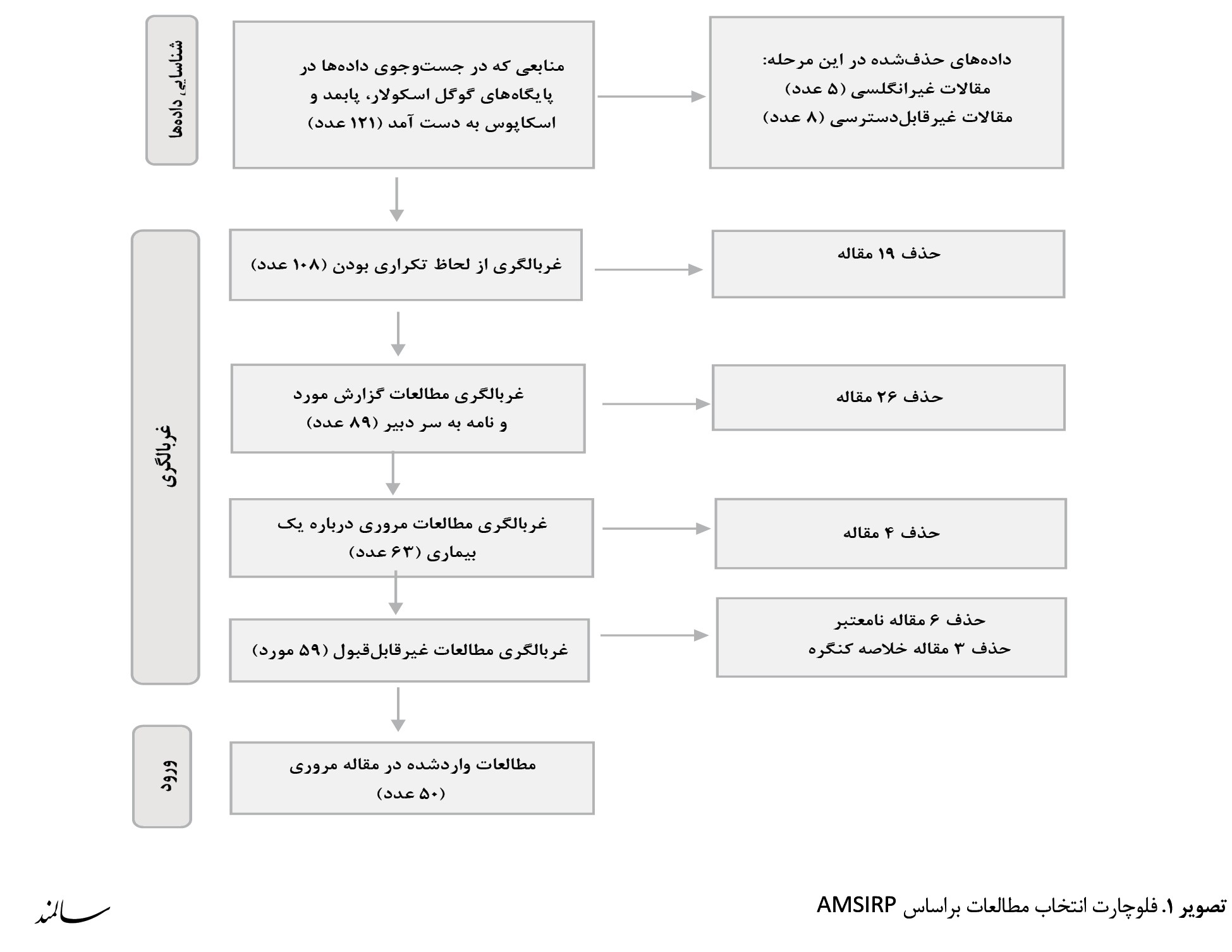
باتوجهبه انتشار اولین مقالات با این عنوان از سال 2015، تمام مقالات اصیل، مروری و مرور نظاممند در موتورهای جستوجوی اسکوپوس، پابمد و گوگلاسکالر و با کلیدواژههای senolytic و senolysis در بازه زمانی 2015 تا 2023، در عنوان بهصورت سیستماتیک مورد بررسی قرار گرفتند که از میان 121 مقاله، 108 مقاله که به زبان انگلیسی و قابلدسترسی آزاد بودند دانلود شد. پس از مطالعه مقالات و اعتبارسنجی، تعداد 50 مقاله انتخاب شدند و خلاصه یافتهها بهصورت مقاله مروری تنظیم شدند، بهطوریکه مقالات مروری تکراری یا تخصصی در یک بیماری خاص، نامه به سردبیرها، مطالعات موردی و مقالات چاپشده در مجلات نامعتبر و نتایجی که در خلاصه کنگرهها بهصورت تکراری چاپ شده بودند حذف شدند. در انجام مطالعه از چکلیست پریزما استفاده شده است. مراحل انتخاب مقالات در تصویر شماره 1 قابل مشاهده است.
روند رو به رشد جمعیت سالمند مشکل تمام جوامع اعم از توسعهیافته و درحالتوسعه میباشد، بهطوریکه طبق تخمین سازمان بهداشت جهانی، از 6 نفر جمعیت انسانی 1 نفر در سال 2030 سالمند خواهند بود و تا سال2050، 2/1 میلیارد نفر انسان بیش از 60 سال خواهند داشت که این بار اقتصادی، اجتماعی و بهداشتی قابلتوجهی را بر جمعیت و دولتها تحمیل خواهد کرد [1]. علاوهبراین، پیری سلولها میتواند در هر دورهای از زندگی آغاز شود که این عارضه دلیل تعداد قابلتوجهی از بیماریهاست که در ادامه به آنها خواهیم پرداخت.
درواقع پیری سلولی میتواند حتی پیش از تولد آغاز شود. چنانکه در پاتوژنز بیماری سندرم داون شواهدی بر پیری تخمک مادر وجود دارد. بنابراین پیری سلولی عارضهای است که بدون توجه به سن افراد میتواند پایه بروز اختلالات و بیماریهای مختلفی باشد.
داروهای سنولیتیک که هنوز معادل فارسی مناسبی برای آنها ابداع نشده است، اولین بار در سال 2015 معرفی شدند و عملکرد آنها بهعنوان داروهایی که قادر به لیز کردن و کشتن سلولهای پیر هستند، عنوان شد [2] و کاربرد آنها از شکل پیشبالینی به فازهای مختلف مطالعات بالینی کشیده شد. بدین ترتیب، نتایج قابلتوجهی درباره اثربخشی سنولیتیکها در کنترل بیماریهای گوناگون به دست آمد که این مطالعات هنوز هم ادامه دارند و به مرور زمان به تعداد بیماریهای موردمطالعه افزوده میشود. درواقع این داروها با از بین بردن انتخابی سلولهای پیر مشکل عملکردی، التهاب مزمن ناشی از پیری سلولی و حضور فیزیکی سلولهای مقاوم به آپوپتوز را تا حدودی حل میکنند و این باعث بهبود عملکرد بافت مورد نظر میگردد. یکی از شاخصترین بیماریهایی که ناشی از پیری سلولهای عصبی بوده و داروهای سنولیتیک تأثیر مناسبی بر کاهش سرعت پیشرفت آن داشتهاند، آلزایمر میباشد که مطالعات مختلفی درباره اثربخشی این داروها در آن انجام شده و در حال انجام است [3, 4].
در این مقاله مروری خلاصه مکانیسمهای پیری سلولی و اثر انتخابی داروهای سنولیتیک بر این سلولها ، انواع دستههای دارویی و راهکارهای درمانی با تأثیر سنولیتیک و پیشرفتهایی که تاکنون در این زمینه صورتگرفته مورد بحث قرار میگیرد.
پیری سلولی
پیری ازنظر علوم پایه بهصورت بیثباتی ژنومی، فرسودگی یا اختلال عملکرد سلولهای پیشساز، تغییرات تلومریک و اپیژنتیک، هموستاز نامنظم، اختلال عملکرد میتوکندریها، تغییر ارتباطات بین سلولی، التهاب مزمن خفیف، فیبروز بافتی، اختلال در تنظیم میکروبیوم بدن و پیری سلولی تعریف میشود که مجموعه این عوارض به علائمی همچون ضعف، کندی حرکات، تحلیل عضلانی، اختلال شناختی خفیف و کاهش توانایی بهبودی از جراحت یا عفونت منجر میشوند [5]. عوامل فوق در پاتوژنز (بیماریزایی) انواع بیماریهای مزمن نیز مشاهده میشوند و گاه علائم فوق را نیز در این بیماریها مشاهده میکنیم. بنابراین این نظریه مطرح است که با از بین بردن سلولهای دچار پیری بتوان از ایجاد علائم سالمندی و همچنین درمان یا ممانعت از پیشرفت برخی بیماریهای مزمن مرتبط با پیری سلولی جلوگیری کرد.
پیری سلول میتواند توسط عوامل استرسزا از جمله آسیبDNA، جهشهای سرطانی یا فعال شدن انکوژن، اختلال عملکرد میتوکندری، متابولیتهای واکنشی، هیپراکسی یا هیپوکسی، استرس پروتئوتوکسیک، سیگنالهای خارج سلولی، تنشهای مکانیکی، یا عفونتها ایجاد شود. با آسیب DNA، پروتئین p53/p21CIP1/WAF1، p16INK4a/رتینوبلاستوما یا سایر مسیرها که به توقف چرخه سلولی و فنوتیپ ترشحی مرتبط با پیری(SASP) منجر میشوند فعال میشوند. بدین ترتیب با تنظیم مثبت مسیرهای بقا و ضدآپوپتوز مانند خانواده Src کیناز، مسیر سیگنالینگ PI3K-AKT، مسیرهای پروتئین شوک حرارتی (Hsp)، سرپینها، مسیرهای میتوکندری یا پروتئینهای مرتبط با Bcl-2 تنظیمکننده آپوپتوز، سلولهای پیر در برابر آپوپتوز مقاومت میکنند و زنده میمانند [6]. بااینحال، سلولهای پیر قادر به تکثیر نیز نبوده و ظاهراً در فازهای G1 و G2 سیکل سلولی متوقف شدهاند. این سلولها عملکرد طبیعی ندارند و گاه باتوجهبه فنوتیپ SASP قادر به تولید فرآوردههای التهابی در ریزمحیط اطراف خود بوده و به التهاب مزمن منجر میشوند.
روش مطالعه
باتوجهبه انتشار اولین مقالات با این عنوان از سال 2015، تمام مقالات اصیل، مروری و مرور نظاممند در موتورهای جستوجوی اسکوپوس، پابمد و گوگلاسکالر و با کلیدواژههای senolytic و senolysis در بازه زمانی 2015 تا 2023، در عنوان بهصورت سیستماتیک مورد بررسی قرار گرفتند که از میان 121 مقاله، 108 مقاله که به زبان انگلیسی و قابلدسترسی آزاد بودند دانلود شد. پس از مطالعه مقالات و اعتبارسنجی، تعداد 50 مقاله انتخاب شدند و خلاصه یافتهها بهصورت مقاله مروری تنظیم شدند، بهطوریکه مقالات مروری تکراری یا تخصصی در یک بیماری خاص، نامه به سردبیرها، مطالعات موردی و مقالات چاپشده در مجلات نامعتبر و نتایجی که در خلاصه کنگرهها بهصورت تکراری چاپ شده بودند حذف شدند. در انجام مطالعه از چکلیست پریزما استفاده شده است. مراحل انتخاب مقالات در تصویر شماره 1 قابل مشاهده است.
یافتهها
داروهای سنولیتیک
داروهای سنولیتیک اولین بار در سال 2015 معرفی شدند. مکانیسم اصلی عملکرد این داروها مهار مسیرهای ضدآپوپتوتیک در سلولهای پیر و آغاز روند آپوپتوز در این سلولها بدون آسیب زدن به سلولهای غیرفعال یا در حال تکثیر میباشد [7]. مولکولهای آپوپتوتیک هدف این داروها شامل پروتئین کینازهایی همچون ephrin B و فسفواینوزیتید-3 کیناز (PI3K) و خانواده Bcl2 هستند [8]. به همین دلیل است که عمده داروهای سنولیتیک فعلی جزء دسته داروهایی هستند که در درمان سرطانها کاربرد دارند. بهعلاوه، راهکارهای درمانی جدیدی همچون استفاده از CAR-T cells[9] هم دراینمیان مطرح شدند و مورد بررسی قرار گرفتند. در این بخش دستههای دارویی مختلف با خاصیت سنولیتیک و خلاصهای از دستاوردهای پیشبالینی یا بالینی مربوط به آنها مرور میشود (جدول شماره 1).

مهارکنندههای آنزیم کیناز
کینازها در بخشهای مختلف عملکرد سلولی مانند سیگنالینگ سایتوکاینی، توقف سیکل سلولی و پاسخ به آسیبهای محیطی نقش دارند. امروزه مهارکنندههای کیناز در درمان عوارض التهابی متعدد، بیماریهای روماتولوژیک و عفونتهای غیرقابلکنترل و همچنین در درمان برخی سرطانهای خونی تأیید شدند و کاربرد دارند [10, 11]. یکی از داروهای این دسته که آثار سنولیتیک آن مشاهده شده است داساتینیب میباشد. داساتینیب یا به اختصار D، یک مهارکننده تیروزین کیناز دوگانه ABL/SRC کوتاه اثر خوراکی است. داساتینیب یک درمان مؤثر برای لوسمی میلوئیدی مزمن (CML) و لوسمی لنفوبلاستیک حاد کروموزوم فیلادلفیا مثبت (Ph+ALL) میباشد. این دارو بهخوبی کینازهای خانواده Bcr-Abl و Src (Src ،Lck ،Yes ،Fyn) همچنین c-KIT، PDGFR-α و PDGFR-β و گیرنده کیناز ephrin را مهار میکند [12].
پلیفنلهای طبیعی
کوئرستین
کوئرستین یا Q فلاونوئید اصلی موجود در سبزیجات و میوهها است. کوئرستین در رژیم غذایی روزانه مصرف میشود، اما در دهه 1970 بهعنوان مادهای جهشزا گزارش شد.
ترکیب D+Q برای اولین بار در سال 2019 در یک مطالعه آزمایشی برای درمان فیبروز ایدیوپاتیک ریه (IPF) استفاده شد. در این مطالعه D+Q بهصورت 3 روز متوالی به 14 بیمار داده شد. طی هفتههای اول و دوم پس از تجویز این ترکیب، فعالیت فیزیکی بیماران بهبود متوسطی نشان داد. بااینحال، هیچ پیشرفتی در عملکرد ریه و کیفیت زندگی مرتبط با بیماری مشاهده نشد. نکته جالب توجه اینکه تغییری در سطح اجزای SASP در گردش خون بیماران ایجاد نشد که مکانیسم ضدپیری در کارآمدی این داروها را زیر سؤال میبرد و این فرض را مطرح میکند که شاید این ترکیب از مسیر دیگری باعث بهبود عملکرد این افراد گردید [13]. کارآزمایی دیگری که با این ترکیب دارویی صورت گرفت بر روی 9 بیمار دچار نفروپاتی دیابتی بود که D+Q بهصورت 3 روز متوالی و بهصورت خوراکی برای این افراد تجویز شد و پس از 11 روز هم باعث کاهش سطح اجزای SASP و هم کاهش بار سلولهای پیر گردید [14]. باتوجهبه این یافتهها، اثربخشی و عوارض D+Q بهعنوان یک ترکیب سنولیتیک در کارآزماییهای بالینی دیگری تحت بررسی میباشد که هنوز نتایج آنها منتشر نشده است.
فیستین
فیستین یا 3 ,3 ,4 ,7-tetrahydroxyflavone، یک مولکول فلاونول زیست فعال است که در میوهها و سبزیجاتی مانند توت فرنگی، سیب، خرمالو، انگور، پیاز و خیار در غلظتهای بین 2 تا 160 میکروگرم بر گرم یافت میشود [15]. اخیراًً تأثیر فیستین در کاهش تحلیل استخوانی مرتبط با پیری در مدلهای موشی نشان داده شده است [16]. همچنین مشاهده شد که رژیم غذایی متناوب حاوی فیستین میتواند باعث بهبود عملکرد عروقی در مدلهای موشی پیر شود [17]. باتوجهبه اثر فیستین در مهار تولید SASP از سلولهای پیر و درنتیجه مهار نسبی واکنشهای التهابی، مطالعه بالینی در بیماران کووید-19 در حال انجام است که اثر این ماده را در کاهش علائم بیماران بررسی میکند [18].
مواد دیگر
مواد دیگر در این دسته که خواص سنولیتیک خفیفی در آنها مشاهده شده است curcumin یا عصاره زرد چوبه، o-vanilinn از متابولیتهای وانیل، gingerenone A در زنجبیل و procyanidin C1 در عصاره انگور میباشند. یک مطالعه در محیط آزمایشگاهی نشان داده است که curcumin و o-vanilinn توانایی از بین بردن سلولهای پیر موجود در دیسک بین مهرهای انسان را دارند [19]. بهعلاوه، در مدلهای موشی پیر و چاق، رژیم غذایی حاوی curcumin در مقایسه با رژیم غذایی عادی بهطور معنیداری باعث کاهش پیری سلولهای بافت کبدی در این موشها شد [20].
مهارکنندههای خانواده پروتئینهای Bcl
خانواده پروتئینهای Bcl شامل Bcl-2, Bcl-w, BclXL, Mcl-1 میباشد که به خاطر تأثیری که در پایداری سلولهای با فنوتیپ پیری دارند اهداف مناسبی برای داروهای ضدپیری میباشند [21]. یکی از مهمترین داروهای سنولیتیک که برای مهار عملکرد این دسته پیشنهاد شده است ناویتوکلاکس میباشد. ناویتوکلاکس شکل تکاملیافته ABT-737 است که خود از ABT-263 مشتق شده است [22]. باتوجهبه اثرات ضدپیری قوی ناویتوکلاکس، مطالعاتی در زمینه این دارو انجام شده است. بهعنوانمثال مشاهده شد این دارو باعث مهار نارسایی قلب ناشی از آنژیوتانسین II در موش میگردد [23].
همچنین استفاده از ناویتوکلاکس در مدلهای استئوآرتریت موش صحرایی به پاکسازی کندروسیتهای استئوآرتریتی پیر منجر شده و آنها را با کندروسیتهای جوان جایگزین کرده است. در این مدلها، شاخصهای التهابی نیز بهطور معنیداری کاهش یافتند [24]. بااینحال، در مدل موشی پیر، این دارو با وجود کاهش فراوانی سلولهای پیر در بافت استخوانی، باعث کم شدن حجم استخوانهای ترابکولار شد و توانایی استئوبلاستهای مشتق از سلولهای مزانشیمی مغز استخوان در تولید ماتریکس معدنی دچار اختلال شد [25]. ناویتوکلاکس در درمان هایپرمی (پرخونی) عملکردی در موشهای پیر نیز نتایج قابلقبولی نشان داده است [26]. در این رابطه، عوارضی همچون کاهش تعداد پلاکتهای خون نیز به دنبال مصرف این دارو گزارش شده است، اما با گالاکتوکونژوگه کردن این دارو هم عوارض پلاکتی آن کاهش مییابد و هم اختصاصیت آن در هدف قرار دادن سلولهای پیر بیشتر میشود [27].
ثباتدهندههای p53
مولکول p53 نقش کلیدی در پاسخ به آسیب DNA و تنظیم چرخه سلولی دارد و میتواند آپوپتوز را از راههای مختلفی القا کند. یکی از داروهای مهم ثباتدهنده این مولکول UBX0101 است. UBX0101یک مهارکننده تعامل p53/ MDM2 است. درواقع، MDM2مولکول تنظیمکنننده p53 بوده و ترکیب p53/ MDM2باعث کاهش پایداری p53 میگردد. یک مطالعه نشان داده است UBX0101آپوپتوز سینوویوسیتهای پیر را در نمونه موشی استئوآرتریت القا میکند. همچنین این ماده میزان تغییرات اکسیداتیو پروتئینها را در آرتروز مفصل زانو در موشهای پیر کاهش داد [28]. این دارو در فاز 1 مطالعه بالینی در بیماران مبتلا به استئوآرتریت باعث کاهش درد در بیماران شد اما باتوجهبه نوع پرسشنامه و فردی بودن جوابهای دادهشده، این یافته چندان معتبر ارزیابی نشدند [29]. بنابراین مطالعه مشابهی در فاز 2 انجام شد که در آن به 177 بیمار دچار استئوآرتریت یک تک دُز این دارو داده شد و میزان درد در ایشان بررسی شد، اما یافتههای این مطالعه هیچ تغییر محسوسی در میزان درد در مفاصل بیماران یا عملکرد ایشان در مقایسه با گروه کنترل نشان نداد. همچنین مشخص نشد UBX0101 تغییری در میزان SASP یا در تعداد سلولهای پیر میدهد یا خیر [30]، اما مطالعات پیشین نشان میداد که مولکولهای مهارکننده تعامل p53/MDM2 بیشتر قادر به کاهش SASP هستند تا از بین بردن سلولهای پیر [31]. بههرحال نتایج این مطالعه هم چندان قابلاتکا نبود، چراکه ممکن است یک دُز این دارو برای اعمال اثر کافی نباشد و نیاز به مطالعات تکمیلی برای بررسی اثربخشی این دارو در انسان وجود دارد.
دیگر ماده مؤثر در افزایش فعالیت p53، مهارکنندههای FOXO4-TP53 هستند. در شرایط استرس سلولی، TP53 با فاکتور رونویسی (FOXO)4 تعامل میکند و درنتیجه با تنظیم رونویسی پروتئین P21 مرتبط با پیری، پیری سلولی را القا میکند. بنابراین با گسستن تعامل بین این دو مولکول نیز میتوان این روند را مختل کرد. اخیراًً یک پپتید به نام ES2 طراحی شده که مانع از واکنش بین این دو مولکول میشود و TP53 را برای القای آپوپتوز آزاد میکند. مطالعات نشان دادهاند که اینگونه پپتیدها میتوانند بهعنوان سنولیتیک برای از بین بردن سلولهای سرطانی انسانی پیر در کشت سلولی و هم در مدلهای موشی به کار روند. بهعنوانمثال، تزریق سیستمیک مکرر ES2 به موشهای مسن به کاهش تعداد سلولهای پیر در کبد با حداقل سمیت منجر شد [32].
مهارکنندههای پروتئینهای شوک حرارتی
پروتئینهای شوک حرارتی (Hsp) عموماً در شرایط استرس سلولی تولید میشوند و باعث القای فعالیتهای التهابی و ترمیمی در بافت میگردند. اخیراًً این دسته پروتئینی بهعنوان هدف داروهای سنولیتک مورد مطالعه قرار گرفتهاند. در یک مطالعه حیوانی در موشهای مدل سندرم پیری با جهش ژنتیکی 1ccrE-/∆ درمان با مهارکننده Hsp90 یعنی DMAG -17 باعث افزایش دوره سلامت و تأخیر در بروز علایم پیری گردید [33]. پروتئین CRYAB نیز بهعنوان یک پروتئین شوک حرارتی، مورد هدف داروهای سنولیتیک قرار گرفته است. استفاده از ماده هیدروکسی کلسترول-25 بهعنوان مهارکننده CRYAB در مدلهای موشی پیر به افزایش توده عضلانی در این حیوانات منجر شد. همچنین مطالعه in vitro نشان داد این ماده باعث سینولیز (از بین رفتن سلولهای پیر) در کشت سلولهای ریه، قلب، کبد، کلیه، و غضروف مفصل انسانی میشود [34].
مهارکنندههای خانواده پروتئین BET
خانواده پروتئینهای BET در تنظیم نسخهبرداری در هسته نقش دارند و مهار آنها در درمان برخی سرطانها و بیماریهای التهابی تأثیرات مثبتی نشان داده است [35]. همچنین مواد مهارکننده BET بهعنوان داروهای سنولیتیک بررسی شدهاند. بهعنوانمثال، یک داروی BETd به نام ARV-825 ازیکسو، با کاهش NHEJ، و ازسویدیگر با افزایش بیان ژنهای مرتبط با اتوفاژی در محیط in vitro سبب از بین رفتن ردههای سلولی پیر انسانی و سلولهای کبدی پیر در موشها گردید [36]. داروی سنولیتیک دیگر در این دسته JQ1 است که نشان داده شد میتواند سلولهای پیر را از طریق فروپتوز (نوعی مرگ سلولی وابسته به آهن) حذف کند. این تحقیق همچنین پیشنهاد میکند فروپتوز ممکن است بهعنوان یک مکانیسم جدید در طراحی داروهای سنولیتیک مورد استفاده قرار گیرد [37].
استروئیدهای قلبی
استروئیدها یا گلیکوزیدهای قلبی بهطور گستردهای در درمان نارسایی قلبی استفاده میشوند. از داروهای این دسته میتوان به دیگوکسین اشاره کرد. این داروها با مکانسیمهایی ازجمله هدف قرار دادن پمپهای Na+/K+ATPase، باعث برهم زدن گرادیان الکتروشیمیایی و اسیدی شدن محیط داخل سلول میشوند. غشاء پلاسمایی سلولهای پیر غلظت بیشتری از یون هیدروژن دارند که آنها را نسبت به عملکرد گلیکوزیدهای قلبی حساستر میکند. در یک مطالعه، به ریه موشها، سلولهای فیبروبلاست پیر انسانی تزریق شد و پس از یک دوره درمان با دیگوکسین، مشاهده شد که سطح بیان p16INK4a که یک نشانگر رایج برای سنجش فراوانی سلولهای پیر است، کاهش یافت. این نتایج نشاندهنده اثرات مثبت دیگوکسین بر کاهش سلولهای فیبروبلاستی پیر میباشد [38]. گلیکوزید قلبی دیگر، ouabain، نیز بهعنوان یک عامل سنولیتیک شناخته شده است. سلولهای پیر نسبت به آپوپتوز ایجادشده توسط ouabainحساستر هستند. در یک مطالعه بر روی موشهای ماده با سن 24 ماه پس از 5 دوره درمان با ouabain، مشاهده شد سطوح آلبومین در خون که در طول پیری کاهش مییابد، پس از دریافت این ماده بهطور قابلتوجهی افزایش یافت. همچنین، کاهش سطح بیان p16INK4aدر چندین بافت مانند کبد، قلب و کلیه در موشهای پیر تحت درمان با ouabain نسبت به گروه کنترل مشاهده شد. همچنین، در کبد، کاهش قابلملاحظهای در فعالیت SA-β-Gal نیز مشاهده شد که نشاندهنده کاهش تعداد سلولهای پیر موجود در موشها بود [39].
آگونیستهای PPARα
PPARα یک گیرنده هورمون هستهای است که اکسیداسیون و انتقال اسیدهای چرب را تنظیم میکند. فنوفیبرات، یک آگونیست PPARα است که برای درمان اختلالات تنظیم سطح چربی در انسان استفاده میشود. اخیراً نشان داده شده است که این دارو خواص درمانی در استئوآرتریت و تحلیل غضروف دارد [40]. در ادامه مشخص شد فنوفیبرات باعث افزایش آپوپتوز و اتوفاژی در سلولهای پیر میشود و سطح بیان ژنهای التهابی IL-6 ،CXCL8 ،CCL2 و CDKN2A را در سلولهای پیر کاهش میدهد. علاوهبراین مشاهده شد بیان PPARα با افزایش سن در موشها کاهش مییابد که این دادهها در کنار هم میتوانند آگونیستهای PPARα را بهعنوان یک داروی جدید سنولیتیک مطرح کنند [41].
CAR-T cells
باتوجهبه اختصاصیت بالای CAR-T cellsها در هدف قرار دادن مولکولهای سطحی سلولهای مختلف، به نظر میرسد این راهکار درمانی در از بین بردن انتخابی سلولهای پیر کارآمد باشد [9]. در یک مطالعه موشی، ابتدا بهمنظور شناسایی یک هدف پروتئینی مناسب که بهطور گسترده و اختصاصی بر روی سطح سلولهای پیر بیان شد، مجموعه دادههای RNAseq مشتقشده از سه مدل القای پیری شامل 1. پیری ناشی از درمان در آدنوکارسینوم ریه موش، 2. پیری ناشی از انکوژن در سلولهای کبدی موش و 3. پیری ناشی از کشت سلولهای ستارهای کبدی موش بررسی شد و uPAR بهعنوان یک پروتئین که بر روی سلولهای پیر به میزان زیاد بیان میشود و نقش حیاتی در سلولهای نرمال ندارد و اساسا ًدر اکثر سلولهای طبیعی بیان نمیشود، انتخاب شد. همچنین مشاهده شد uPAR در بافتهای بیماران مبتلا به اختلالات مرتبط با پیری به میزان بالایی بیان میشود. سپس برای ارزیابی اینکه آیا سلولهای uPAR- CAR میتوانند بهعنوان یک سنولیتیک واقعی در داخل بدن عمل کنند، از مدل موشی با پیری ناشی از انکوژن استفاده شد و مشاهده گردید که uPAR-CAR توانایی پاکسازی مؤثر سلولهای کبدی پیر را دارد. تجزیهوتحلیلهای بافتشناسی تأیید کرد که در کبد موشهای تحت درمان با سلولهای uPAR- CAR، تعداد سلولهای بیانکننده SA-β-Gal بهطور قابلتوجهی کاهش یافته است [42].
در ادامه، در مطالعهای دیگر این گروه با تمرکز بر اختلال متابولیک بهعنوان یکی از آسیبهای مرتبط با پیری، نشان دادند که نسبت سلولهای uPAR مثبت با افزایش سن افزایش مییابد. تزریق سلولهای uPAR- CAR T به مدلهای موشی پیر با بهبود هموستاز گلوکز و بهبود متابولیسم همراه بود. همچنین سلولهای uPAR-CAR Tپس از تجویز یک دُز سبب کاهش متابولیتهای ناشی از افزایش سن و رژیم غذایی، با اثرات طولانیمدتی شد. درواقع، نتایج این مطالعه یک اثر محافظتی بیش از 1 ساله را در برابر پیری فیزیولوژیک در گونهای از موش با میانگین طول عمر 2 سال نشان داد [43]. در مطالعهای دیگر مشاهده شد که بیان NKG2DLsدر سلولهای پیر افزایش مییابد برایناساس، یک NKG2D- CAR T cells که NKG2DL را هدف قرار میداد سنتز شد و مشاهده شد که بهطور انتخابی سلولهای پیرانسانی را در شرایط آزمایشگاهی هدف قرار میدهند. در ادامه، هدف قرار دادن سلولهای پیر موشی در شرایط in vivo مورد بررسی قرار گرفت و مشاهد شد که آسیبهای بافتی متعدد مرتبط با پیری کاهش یافته و عملکرد فیزیکی در موشهای پیری بهبود مییابد. سپس با مطالعه بر پستانداران غیرانسانی (Rhesus و (cynomolgus macaques نتایج مشابه و بدون هیچگونه عوارض جانبی مشاهده شده شد [44].
آنتیبیوتیکها
به دنبال مطرح شدن این نظریه که شاید آنتیبیوتیکها خاصیت سینولیز داشته باشند، در یک مطالعه با هدف شناسایی و استفاده بهعنوان سنولیتیک، 15 آنتیبیوتیک تأییدشده توسط FDA مورد بررسی قرار گرفتند. در این مطالعه، بهطور خلاصه از BrdU بهعنوان یک عامل آسیبرسان به DNA، برای القای پیری بر روی دو رده سلولی فیبروبلاست انسانی MRC-5 و BJ استفاده شد و سپس توانایی هدف قرار دادن جمعیت سلولی پیر توسط آنتیبیوتیکها با استفاده از یک سیستم سنجش سنولیتیک مورد ارزیابی قرار گرفت. در این غربالگری، آزیترومایسین و روکسیترومایسین بهعنوان دو داروی سنولیتیک شناسایی شدند [45]. همچنین در مطالعهای دیگر نیجریسین که یک آنتیبیوتیک محلول در چربی و واسطه تبادل الکتریکی H+ و K+ میباشد مورد بررسی قرار گرفت و مشاهده شد این آنتیبیوتیک به کاهش K+ داخل سلولی و متعاقب آن القای پیروپتوز در سلولهای پیر منجر میشود [46]. بااینحال، هنوز مطالعه حیوانی یا انسانی تأییدکننده یافتههای فوق در دست نیست.
مهارکنندههای اینتگراز
Raltegravir یک دارروی مهارکننده اینتگراز است و از دسته مواد ضدویروسی است که اینتگراز ویروس HIV را هدف قرار میدهد، در یک مطالعهای که بر روی 48 بیمار مبتلا به HIV انجام شده بود، مشاهده شد این دارو بهطور قابلتوجهی باعث کاهش زیرگروههای لنفوسیتهای T پیر میشود [47].
محدودیت کالری
اگرچه محدودیت کالری یک مداخله دارویی محسوب نمیشود اما باتوجهبه نتایج حاصل از مطالعات حیوانی و انسانی میتواند تأثیرات مشابه با داروهای سینولیتک داشته باشد. درواقع، روزهداری یا محدود کردن مصرف کالری بدون سوء تغذیه یکی از مؤثرترین راهها برای به تأخیر انداختن فنوتیپ پیری در سلولها محسوب میشود. اخیراًً مشاهده شده است محدودیت کالری میتواند از تجمع سلولهای پیر در انسان و موش جلوگیری کند [48]. در یک مطالعه که بر روی 15 فرد میان سال که بهطور میانگین بیش از 9 سال تحت رژیم محدودیت کالری بودند انجام شد، مشاهده شد این افراد پروفایل بیان ژن جوانتری در عضلات اسکلتی نسبت به افراد گروه کنترل نشان میدهند و بیان ژنهای PI3K و PKB در این افراد بهطور قابلتوجهی کاهش یافته است [49]. در مطالعهای دیگر که بر روی 12 فرد که بهطور میانگین بهمدت 10سال تحت رژیم محدودیت کالری بودند انجام شد، بیان فاکتورهای SASP (p16، MMP9، IL-1A، IL-6 و IL-1a) در مخاط کولون نسبت به افراد گروه کنترل کاهش معنیداری نشان داد [50]. مکانیسم دیگری که محدودیت کالری میتواند از طریق آن تأثیرگذار باشد جلوگیری از تولید ضایعات DNA و کمک به ترمیم آنها میباشد. در مطالعهای که بر روی موشهای صحرایی انجام شد مشاهده گردید محدودیت کالری کاهش وابسته به سن فعالیت اتصال انتهایی غیرهمولوگ (NHEJ) را در بافت موش کاهش میدهد که این ویژگی، ترمیم شکستگیهای DNA دو رشتهای را بهبود میبخشد [51].
بحث
باتوجهبه پیری روزافزون جمعیت و افزایش آمار بیماریهای مزمن ناشی از اختلال عملکرد سلولهای دچار پیری، نیاز به ابداع راه کارهای جدیدی در زمینه کاهش عوارض پیری بافتها وجود دارد. بدین منظور، روشهای گوناگونی برای حذف انتخابی سلولهای پیر پیشنهاد شده که در مراحل مختلف تحقیقاتی هستند و بعضاً نتایج قابلتوجهی در محیطهای in vitro، در مطالعات حیوانی و کارآزماییهای بالینی نشان دادهاند.
داروهای سنولیتیک نامی است که طی سالهای اخیر به این مجموعه راهکارهای درمانی اطلاق میشود و قطعاً در آینده دستههای دیگری نیز به این گروه دارویی اضافه خواهند شد. نظر به نوپا بودن این حوزه پژوهشی هنوز دارویی بهطور قطعی برای درمان عوارض کهنسالی تأیید نشده است اما افزایش دادهها بهویژه یافتههای منتج از کارآزماییهای بالینی در حال انجام است و در آینده نزدیک به پیشنهاد رژیمهای دارویی استاندارد برای پیشگیری از ایجاد عوارض پیری در جمعیت خواهد انجامید. بنابراین به افزایش اطلاعات جامعه پزشکی ازاین داروها و منافع و عوارض آنها نیاز است.
در مقاله حاضر، مروری کلی بر دستههای داروهای سنولیتیک که تاکنون پیشنهاد شدهاند شده است. برخی ازاین دستهها موردمطالعه بیشتری بوده و به این دلیل که قبلاً استفادههای درمانی دیگری داشتهاند جهت انجام کارآزمایی بالینی مناسبتر و قابلقبولتر بودهاند. از این دسته میتوان به ترکیب داساتینیب و کوئرستین یا به اختصار D+Q اشاره کرد.
داساتینیب بهعنوان دارویی که در درمان برخی سرطانهای خونی کاربرد دارد شناخته شده و کوئرستین نیز یک ماده طبیعی از عصاره گیاهان مختلف بوده و میتواند در رژیم غذایی روزمره افراد وجود داشته باشد. ترکیب این دو ماده در از بین بردن عوارض پیری سلولی نتایج جالب توجهی داشته که برخی از آنها ازجمله کاهش فیبروز ریوی و بهبود بیماریهای مزمن کلیوی منتشر شده [13، 14] و مطالعات دیگری در زمینه کنترل آلزایمر و اختلالات اسکلتی و حرکتی کهنسالی و همچنین کاهش عوارض ثانویه در درمانهای سنگینی همچون پیوند سلولهای بنیادی خونساز، شیمیدرمانی سرطان و عمل بایپس قلب در حال انجام میباشد [6].
ماده سنولیتیک دیگری که در حال حاضر تحت کارآزماییهای متعددی میباشد فیستین است که یک فلاونول زیست فعال گیاهی بوده و فازهای 1 و 2 کارآزمایی درباره اثربخشی و عوارض آن در کنترل استئوآرتریت و تحلیل غضروفی مربوطه، عوارض پس از پیوند سلولهای بنیادی و التهاب ناشی از کووید-19 در حال انجام است [6]. دستههای دیگر سنولیتیکها شامل مهارکنندههای خانواده پروتئینهای Bcl2 و ثباتدهندههای p53 نیز در حال بررسی بالینی میباشند و بهویژه اثربخشی UBX0101 در کنترل عوارض استخوانی، عضروفی و اسکلتی ناشی از افزایش سن در فازهای 1 و 2 کارآزماییهای بالینی در حال مطالعه بر روی بیماران است [6].
مهارکنندههای پروتئینهای شوک حرارتی، مهارکنندههای خانواده پروتئینی BET، آگونیستهای PPARα و استروئیدهای قلبی نیز در فاز مطالعات پیشبالینی بوده و نتایج امیدوارکنندهای در جلوگیری از عوارض پیری در مدلهای موشی نشان دادهاند [37-41]. بهعلاوه، CAR-T cells که برای از بین بردن انتخابی سلولهای سرطانی در بیماران تحت بررسی هستند، باتوجهبه قابلیت نابود کردن سلولهای پیر با مارکرهای اختصاصی بیانشونده در پیری، بهعنوان گزینهای مناسب در طراحی داروهای سنولیتیک در فاز مطالعات حیوانی قرار دارند [43, 44]. دراینمیان داروهایی مهارکنندههای اینتگراز که برای درمان عفونتهای ویروسی کاربرد دارند آثار سنولیتیک مانند از بین بردن لنفوسیتهای T با فنوتیپ پیری از خود نشان دادهاند اما هنوز مطالعه اختصاصی برای بررسی مستقیم کارایی آنها در سنولیز ردههای دیگر سلولی صورت نگرفته است [47]. همچنین آنتیبیوتیکهای مختلف ازلحاظ کیفیت سنولیتیک در حال بررسی میباشند، اما به نظر میرسد این تئوری عمدتاً براساس یافتههای تصادفی در زمینه آثار ثانویه آنتیبیوتیکها استوار است و مکانیسم مولکولی شناختهشدهای برای انتخاب نوع خاصی از آنتیبیوتیکها به این منظور ارائه نشده است [45]. نهایتاً محدودیت کالری مصرفی که از دیرباز بهعنوان یک درمان سنتی برای کاهش عوارض پیری و کنترل التهاب پیشنهاد میشد، بهعنوان راهکاری برای جلوگیری از القای فنوتیپ پیری در سلولها مورد مطالعه میباشد.
بااینحال، راه پیشرو هنوز پر از چالشها و پرسشهایی است که نیازمند پاسخهای دقیق و جامع هستند. تحقیقات دقیقتر درزمینه طول مدت اثر، عوارض جانبی، ایمنی در درازمدت و اثربخشی در شرایط مختلف فیزیولوژیک و پاتولوژیک از اهمیت فراوانی برخوردار است. در آینده، امیدواریم که کاربرد داروهای سنولیتیک در پزشکی، بهعنوان یک راهکار نوین در بهبود سلامت سالمندی و کاهش بار بیماریهای مرتبط با کهنسالی مؤثر باشد. با پیشرفت تحقیقات، انتظار داریم این داروها به یک دوره جدید از پزشکی سالمندی منجر شوند و راهکاری به سوی پیری بهتر و سالمتر باشند.
نتیجهگیری نهایی
داروهای سنولیتیک که شامل دستههای مولکولی متعددی مانند داروهای شیمیدرمانی، آنتیبیوتیکها، مهارکنندههای مولکولهای ضدآپوپتوز و ثباتدهندههای مولکولهای تقویتکننده آپوپتوز، CAR-T سلها و همچنین فراوردههای طبیعی گیاهی و محدودیت کالری غذایی میباشند، تاکنون نتایج امیدوارکنندهای درزمینه کنترل عوارض پیری در مدلهای مختلف تحقیقاتی نشان دادهاند اما هنوز رژیم دارویی استانداردی در این زمینه پیشنهاد نشده است و مطالعات همچنان ادامه دارند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله مرور نظاممند میباشد که بر روی نمونههای انسانی و حیوانی انجام نشده است. برایناساس نیاز به کد اخلاق نبود و تمام قوانین اخلاق در پژوهش رعایت شده است.
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
نگارش متن: سارا اسدی اصل؛ جستوجوی مقالات و جمعآوری دادهها: سپهر صافدل؛ بازبینی و ویرایش متن: محمدحسین نیک نام.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
References
1.World Health Organization. WHO clinical consortium on healthy ageing 2022: Report of consortium meeting, 5-6 December 2022. Geneva: World Health Organization; 2023. [Link]
2.Zhu Y, Tchkonia T, Pirtskhalava T, Gower AC, Ding H, Giorgadze N, et al. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015; 14(4):644-58. [DOI:10.1111/acel.12344] [PMID]
3.Gonzales MM, Garbarino VR, Kautz TF, Palavicini JP, Lopez-Cruzan M, Dehkordi SK, et al. Senolytic therapy in mild Alzheimer’s disease: A phase 1 feasibility trial. Nature Medicine. 2023; 29(10):2481-8. [DOI:10.1038/s41591-023-02543-w] [PMID]
4.Riessland M, Orr ME. Translating the biology of aging into new therapeutics for Alzheimer’s Disease: Senolytics. The Journal of Prevention of Alzheimer’s Disease. 2023; 10(4):633-46. [DOI:10.14283/jpad.2023.104] [PMID]
5.Muñoz-Espín D, Serrano M. Cellular senescence: From physiology to pathology. Nature Reviews Molecular Cell Biology. 2014; 15(7):482-96. [DOI:10.1038/nrm3823] [PMID]
6.Chaib S, Tchkonia T, Kirkland JL. Cellular senescence and senolytics: The path to the clinic. Nature Medicine. 2022; 28(8):1556-68. [DOI:10.1038/s41591-022-01923-y] [PMID]
7.Kirkland JL, Tchkonia T. Cellular senescence: A translational perspective. EBioMedicine. 2017; 21:21-8. [DOI:10.1016/j.ebiom.2017.04.013] [PMID]
8.Kang C. Senolytics and senostatics: A two-pronged approach to target cellular senescence for delaying aging and age-related diseases. Molecules and Cells. 2019; 42(12):821-7. [PMID]
9.Carney EF. Use of CAR T cells as senolytic agents. Nature Reviews Nephrology. 2020; 16(9):485. [DOI:10.1038/s41581-020-0324-3] [PMID]
10.Assadiasl S, Fatahi Y, Mosharmovahed B, Mohebbi B, Nicknam MH. Baricitinib: From Rheumatoid Arthritis to COVID‐19. The Journal of Clinical Pharmacology. 2021; 61(10):1274-85. [DOI:10.1002/jcph.1874] [PMID]
11.Arora A, Scholar EM. Role of tyrosine kinase inhibitors in cancer therapy. Journal of Pharmacology and Experimental Therapeutics. 2005; 315(3):971-9. [DOI:10.1124/jpet.105.084145] [PMID]
12.Talpaz M, Shah NP, Kantarjian H, Donato N, Nicoll J, Paquette R, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. New England Journal of Medicine. 2006; 354(24):2531-41. [DOI:10.1056/NEJMoa055229] [PMID]
13.Justice JN, Nambiar AM, Tchkonia T, LeBrasseur NK, Pascual R, Hashmi SK, et al. Senolytics in idiopathic pulmonary fibrosis: Results from a first-in-human, open-label, pilot study. EBioMedicine. 2019; 40:554-63. [DOI:10.1016/j.ebiom.2018.12.052] [PMID]
14.Hickson LJ, Prata LGL, Bobart SA, Evans TK, Giorgadze N, Hashmi SK, et al. Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine. 2019; 47:446-56. [DOI:10.1016/j.ebiom.2019.08.069] [PMID]
15.Khan N, Syed DN, Ahmad N, Mukhtar H. Fisetin: A dietary antioxidant for health promotion. Antioxidants & Redox Signaling. 2013; 19(2):151-62. [DOI:10.1089/ars.2012.4901] [PMID]
16.Hambright WS, Mu X, Gao X, Guo P, Kawakami Y, Mitchell J, et al. The senolytic drug fisetin attenuates bone degeneration in the zmpste24-/- progeria mouse model. Journal of Osteoporosis. 2023; 2023:5572754. [DOI:10.1155/2023/5572754] [PMID]
17.Mahoney SA, Venkatasubramanian R, Darrah MA, Ludwig KR, VanDongen NS, Greenberg NT, et al. Intermittent supplementation with fisetin improves arterial function in old mice by decreasing cellular senescence. Aging Cell. 2024; 23(3):e14060. [DOI:10.1111/acel.14060] [PMID]
18.Verdoorn BP, Evans TK, Hanson GJ, Zhu Y, Langhi Prata LGP, Pignolo RJ, et al. Fisetin for COVID‐19 in skilled nursing facilities: Senolytic trials in the COVID era. Journal of the American Geriatrics Society. 2021; 69(11):3023-33. [DOI:10.1111/jgs.17416] [PMID]
19.Cherif H, Bisson DG, Jarzem P, Weber M, Ouellet JA, Haglund L. Curcumin and o-Vanillin exhibit evidence of senolytic activity in human IVD cells in vitro. Journal of Clinical Medicine. 2019; 8(4):433. [DOI:10.3390/jcm8040433] [PMID]
20.Lee DY, Lee SJ, Chandrasekaran P, Lamichhane G, O'Connell JF, Egan JM, et al. Dietary Curcumin Attenuates Hepatic Cellular Senescence by Suppressing the MAPK/NF-κB Signaling Pathway in Aged Mice. Antioxidants. 2023; 12(6):1165. [DOI:10.3390/antiox12061165] [PMID]
21.Troiani M, Colucci M, D’Ambrosio M, Guccini I, Pasquini E, Varesi A, et al. Single-cell transcriptomics identifies Mcl-1 as a target for senolytic therapy in cancer. Nature Communications. 2022; 13(1):2177. [DOI:10.1038/s41467-022-29824-1] [PMID]
22.Mohamad Anuar NN, Nor Hisam NS, Liew SL, Ugusman A. Clinical review: Navitoclax as a pro-apoptotic and anti-fibrotic agent. Frontiers in Pharmacology. 2020; 11:564108. [DOI:10.3389/fphar.2020.564108] [PMID]
23.Jia K, Dai Y, Liu A, Li X, Wu L, Lu L, et al. Senolytic agent navitoclax inhibits angiotensin II-induced heart failure in mice. Journal of Cardiovascular Pharmacology. 2020; 76(4):452-60. [DOI:10.1097/FJC.0000000000000878] [PMID]
24.Yang H, Chen C, Chen H, Duan X, Li J, Zhou Y, et al. Navitoclax (ABT263) reduces inflammation and promotes chondrogenic phenotype by clearing senescent osteoarthritic chondrocytes in osteoarthritis. Aging (Albany NY). 2020; 12(13):12750. [DOI:10.18632/aging.103177] [PMID]
25.Sharma AK, Roberts RL, Benson RD Jr, Pierce JL, Yu K, Hamrick MW, et al. The senolytic drug navitoclax (ABT-263) causes trabecular bone loss and impaired osteoprogenitor function in aged mice. Frontiers in Cell and Developmental Biology. 2020; 8:354. [DOI:10.3389/fcell.2020.00354] [PMID]
26.Tarantini S, Balasubramanian P, Delfavero J, Csipo T, Yabluchanskiy A, Kiss T, et al. Treatment with the BCL-2/BCL-xL inhibitor senolytic drug ABT263/Navitoclax improves functional hyperemia in aged mice. GeroScience. 2021; 43(5):2427-40. [DOI:10.1007/s11357-021-00440-z] [PMID]
27.González-Gualda E, Pàez-Ribes M, Lozano-Torres B, Macias D, Wilson JR 3rd, González-López C, et al. Galacto‐conjugation of Navitoclax as an efficient strategy to increase senolytic specificity and reduce platelet toxicity. Aging Cell. 2020; 19(4):e13142. [DOI:10.1111/acel.13142] [PMID]
28.Chin AF, Han J, Clement CC, Choi Y, Zhang H, Browne M, et al. Senolytic treatment reduces oxidative protein stress in an aging male murine model of post‐traumatic osteoarthritis. Aging Cell. 2023; 22(11):e13979. [DOI:10.1111/acel.13979] [PMID]
29.Hsu B, Visich J, Lane N, Li L, Mittal J, An M, et al. Safety, tolerability, pharmacokinetics, and clinical outcomes following treatment of painful knee osteoarthritis with senolytic molecule UBX0101. Osteoarthritis and Cartilage. 2020; 28:S479-S80. [DOI:10.1016/j.joca.2020.02.752]
30.Lane N, Hsu B, Visich J, Xie B, Khan A, Dananberg J. A phase 2, randomized, double-blind, placebo-controlled study of senolytic molecule UBX0101 in the treatment of painful knee osteoarthritis. Osteoarthritis and Cartilage. 2021; 29(1):S52-3. [DOI:10.1016/j.joca.2021.02.077]
31.Wiley CD, Schaum N, Alimirah F, Lopez-Dominguez JA, Orjalo AV, Scott G, et al. Small-molecule MDM2 antagonists attenuate the senescence-associated secretory phenotype. Scientific Reports. 2018; 8(1):2410. [DOI:10.1038/s41598-018-20000-4] [PMID]
32.Le HH, Cinaroglu SS, Manalo EC, Ors A, Gomes MM, Sahbaz BD, et al. Molecular modelling of the FOXO4-TP53 interaction to design senolytic peptides for the elimination of senescent cancer cells. EBioMedicine. 2021; 73:103646. [DOI:10.1016/j.ebiom.2021.103646] [PMID]
33.Fuhrmann-Stroissnigg H, Ling YY, Zhao J, McGowan SJ, Zhu Y, Brooks RW, et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 2017; 8(1):422. [DOI:10.1038/s41467-017-00314-z] [PMID]
34.Limbad C, Doi R, McGirr J, Ciotlos S, Perez K, Clayton ZS, et al. Senolysis induced by 25-hydroxycholesterol targets CRYAB in multiple cell types. iScience. 2022; 25(2):103848. [DOI:10.1016/j.isci.2022.103848] [PMID]
35.Cheung KL, Kim C, Zhou MM. The functions of BET Proteins In Gene Transcription Of Biology And Diseases. Frontiers in Molecular Biosciences. 2021; 8:728777. [DOI:10.3389/fmolb.2021.728777] [PMID]
36.Wakita M, Takahashi A, Sano O, Loo TM, Imai Y, Narukawa M, et al. A BET family protein degrader provokes senolysis by targeting NHEJ and autophagy in senescent cells. Nature Communications. 2020; 11(1):1935. [DOI:10.1038/s41467-020-15719-6] [PMID]
37.Go S, Kang M, Kwon SP, Jung M, Jeon OH, Kim BS. The senolytic drug JQ1 removes senescent cells via ferroptosis. Tissue Engineering and Regenerative Medicine. 2021; 18(5):841-50. [DOI:10.1007/s13770-021-00346-z] [PMID]
38.Triana-Martínez F, Picallos-Rabina P, Da Silva-Álvarez S, Pietrocola F, Llanos S, Rodilla V, et al. Identification and characterization of Cardiac Glycosides as senolytic compounds. Nature Communications. 2019; 10(1):4731. [DOI:10.1038/s41467-019-12888-x] [PMID]
39.Guerrero A, Herranz N, Sun B, Wagner V, Gallage S, Guiho R, et al. Cardiac glycosides are broad-spectrum senolytics. Nature Metabolism. 2019; 1(11):1074-88. [DOI:10.1038/s42255-019-0122-z] [PMID]
40.Nogueira-Recalde U, Lorenzo-Gómez I, Blanco FJ, Loza MI, Grassi D, Shirinsky V, et al. Fibrates as drugs with senolytic and autophagic activity for osteoarthritis therapy. EBioMedicine. 2019; 45:588-605. [DOI:10.1016/j.ebiom.2019.06.049] [PMID]
41.Del Rey MJ, Valín Á, Usategui A, Ergueta S, Martín E, Municio C, et al. Senescent synovial fibroblasts accumulate prematurely in rheumatoid arthritis tissues and display an enhanced inflammatory phenotype. Immunity & Ageing : I & A. 2019; 16:29. [DOI:10.1186/s12979-019-0169-4] [PMID]
42.Amor C, Feucht J, Leibold J, Ho YJ, Zhu C, Alonso-Curbelo D, et al. Senolytic CAR T cells reverse senescence-associated pathologies. Nature. 2020; 583(7814):127-32. [DOI:10.1038/s41586-020-2403-9] [PMID]
43.Amor C, Fernández-Maestre I, Chowdhury S, Ho YJ, Nadella S, Graham C, et al. Prophylactic and long-lasting efficacy of senolytic CAR T cells against age-related metabolic dysfunction. Nature Aging. 2024; 4:336–49. [Link]
44.Yang D, Sun B, Li S, Wei W, Liu X, Cui X, et al. NKG2D-CAR T cells eliminate senescent cells in aged mice and nonhuman primates. Science Translational Medicine. 2023; 15(709):eadd1951. [DOI:10.1126/scitranslmed.add1951] [PMID]
45.Ozsvari B, Nuttall JR, Sotgia F, Lisanti MP. Azithromycin and Roxithromycin define a new family of “senolytic” drugs that target senescent human fibroblasts. Aging (Albany NY). 2018; 10(11):3294-307. [DOI:10.18632/aging.101633] [PMID]
46.Deryabin PI, Shatrova AN, Borodkina AV. Targeting multiple homeostasis-maintaining systems by ionophore Nigericin Is a novel approach for senolysis. International Journal of Molecular Sciences. 2022; 23(22):14251. [DOI:10.3390/ijms232214251] [PMID]
47.Torres B, Guardo A, Squarcia M, Diaz A, Fabra A, Caballero M, et al. Impact of switching to raltegravir and/or adding losartan in lymphoid tissue fibrosis and inflammation in people living with HIV. A randomized clinical trial. HIV Medicine. 2021; 22(8):674-81. [DOI:10.1111/hiv.13114] [PMID]
48.Fontana L, Nehme J, Demaria M. Caloric restriction and cellular senescence. Mechanisms of Ageing and Development. 2018; 176:19-23. [DOI:10.1016/j.mad.2018.10.005] [PMID]
49.Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell. 2013; 12(4):645-51. [DOI:10.1111/acel.12088] [PMID]
50.Fontana L, Mitchell SE, Wang B, Tosti V, van Vliet T, Veronese N, et al. The effects of graded caloric restriction: XII. Comparison of mouse to human impact on cellular senescence in the colon. Aging Cell. 2018; 17(3):e12746. [DOI:10.1111/acel.12746] [PMID]
51.Ke Z, Firsanov D, Spencer B, Seluanov A, Gorbunova V. Short-term calorie restriction enhances DNA repair by non-homologous end joining in mice. NPJ Aging and Mechanisms of Disease. 2020; 6:9. [DOI:10.1038/s41514-020-00047-2] [PMID]
1.World Health Organization. WHO clinical consortium on healthy ageing 2022: Report of consortium meeting, 5-6 December 2022. Geneva: World Health Organization; 2023. [Link]
2.Zhu Y, Tchkonia T, Pirtskhalava T, Gower AC, Ding H, Giorgadze N, et al. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015; 14(4):644-58. [DOI:10.1111/acel.12344] [PMID]
3.Gonzales MM, Garbarino VR, Kautz TF, Palavicini JP, Lopez-Cruzan M, Dehkordi SK, et al. Senolytic therapy in mild Alzheimer’s disease: A phase 1 feasibility trial. Nature Medicine. 2023; 29(10):2481-8. [DOI:10.1038/s41591-023-02543-w] [PMID]
4.Riessland M, Orr ME. Translating the biology of aging into new therapeutics for Alzheimer’s Disease: Senolytics. The Journal of Prevention of Alzheimer’s Disease. 2023; 10(4):633-46. [DOI:10.14283/jpad.2023.104] [PMID]
5.Muñoz-Espín D, Serrano M. Cellular senescence: From physiology to pathology. Nature Reviews Molecular Cell Biology. 2014; 15(7):482-96. [DOI:10.1038/nrm3823] [PMID]
6.Chaib S, Tchkonia T, Kirkland JL. Cellular senescence and senolytics: The path to the clinic. Nature Medicine. 2022; 28(8):1556-68. [DOI:10.1038/s41591-022-01923-y] [PMID]
7.Kirkland JL, Tchkonia T. Cellular senescence: A translational perspective. EBioMedicine. 2017; 21:21-8. [DOI:10.1016/j.ebiom.2017.04.013] [PMID]
8.Kang C. Senolytics and senostatics: A two-pronged approach to target cellular senescence for delaying aging and age-related diseases. Molecules and Cells. 2019; 42(12):821-7. [PMID]
9.Carney EF. Use of CAR T cells as senolytic agents. Nature Reviews Nephrology. 2020; 16(9):485. [DOI:10.1038/s41581-020-0324-3] [PMID]
10.Assadiasl S, Fatahi Y, Mosharmovahed B, Mohebbi B, Nicknam MH. Baricitinib: From Rheumatoid Arthritis to COVID‐19. The Journal of Clinical Pharmacology. 2021; 61(10):1274-85. [DOI:10.1002/jcph.1874] [PMID]
11.Arora A, Scholar EM. Role of tyrosine kinase inhibitors in cancer therapy. Journal of Pharmacology and Experimental Therapeutics. 2005; 315(3):971-9. [DOI:10.1124/jpet.105.084145] [PMID]
12.Talpaz M, Shah NP, Kantarjian H, Donato N, Nicoll J, Paquette R, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. New England Journal of Medicine. 2006; 354(24):2531-41. [DOI:10.1056/NEJMoa055229] [PMID]
13.Justice JN, Nambiar AM, Tchkonia T, LeBrasseur NK, Pascual R, Hashmi SK, et al. Senolytics in idiopathic pulmonary fibrosis: Results from a first-in-human, open-label, pilot study. EBioMedicine. 2019; 40:554-63. [DOI:10.1016/j.ebiom.2018.12.052] [PMID]
14.Hickson LJ, Prata LGL, Bobart SA, Evans TK, Giorgadze N, Hashmi SK, et al. Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine. 2019; 47:446-56. [DOI:10.1016/j.ebiom.2019.08.069] [PMID]
15.Khan N, Syed DN, Ahmad N, Mukhtar H. Fisetin: A dietary antioxidant for health promotion. Antioxidants & Redox Signaling. 2013; 19(2):151-62. [DOI:10.1089/ars.2012.4901] [PMID]
16.Hambright WS, Mu X, Gao X, Guo P, Kawakami Y, Mitchell J, et al. The senolytic drug fisetin attenuates bone degeneration in the zmpste24-/- progeria mouse model. Journal of Osteoporosis. 2023; 2023:5572754. [DOI:10.1155/2023/5572754] [PMID]
17.Mahoney SA, Venkatasubramanian R, Darrah MA, Ludwig KR, VanDongen NS, Greenberg NT, et al. Intermittent supplementation with fisetin improves arterial function in old mice by decreasing cellular senescence. Aging Cell. 2024; 23(3):e14060. [DOI:10.1111/acel.14060] [PMID]
18.Verdoorn BP, Evans TK, Hanson GJ, Zhu Y, Langhi Prata LGP, Pignolo RJ, et al. Fisetin for COVID‐19 in skilled nursing facilities: Senolytic trials in the COVID era. Journal of the American Geriatrics Society. 2021; 69(11):3023-33. [DOI:10.1111/jgs.17416] [PMID]
19.Cherif H, Bisson DG, Jarzem P, Weber M, Ouellet JA, Haglund L. Curcumin and o-Vanillin exhibit evidence of senolytic activity in human IVD cells in vitro. Journal of Clinical Medicine. 2019; 8(4):433. [DOI:10.3390/jcm8040433] [PMID]
20.Lee DY, Lee SJ, Chandrasekaran P, Lamichhane G, O'Connell JF, Egan JM, et al. Dietary Curcumin Attenuates Hepatic Cellular Senescence by Suppressing the MAPK/NF-κB Signaling Pathway in Aged Mice. Antioxidants. 2023; 12(6):1165. [DOI:10.3390/antiox12061165] [PMID]
21.Troiani M, Colucci M, D’Ambrosio M, Guccini I, Pasquini E, Varesi A, et al. Single-cell transcriptomics identifies Mcl-1 as a target for senolytic therapy in cancer. Nature Communications. 2022; 13(1):2177. [DOI:10.1038/s41467-022-29824-1] [PMID]
22.Mohamad Anuar NN, Nor Hisam NS, Liew SL, Ugusman A. Clinical review: Navitoclax as a pro-apoptotic and anti-fibrotic agent. Frontiers in Pharmacology. 2020; 11:564108. [DOI:10.3389/fphar.2020.564108] [PMID]
23.Jia K, Dai Y, Liu A, Li X, Wu L, Lu L, et al. Senolytic agent navitoclax inhibits angiotensin II-induced heart failure in mice. Journal of Cardiovascular Pharmacology. 2020; 76(4):452-60. [DOI:10.1097/FJC.0000000000000878] [PMID]
24.Yang H, Chen C, Chen H, Duan X, Li J, Zhou Y, et al. Navitoclax (ABT263) reduces inflammation and promotes chondrogenic phenotype by clearing senescent osteoarthritic chondrocytes in osteoarthritis. Aging (Albany NY). 2020; 12(13):12750. [DOI:10.18632/aging.103177] [PMID]
25.Sharma AK, Roberts RL, Benson RD Jr, Pierce JL, Yu K, Hamrick MW, et al. The senolytic drug navitoclax (ABT-263) causes trabecular bone loss and impaired osteoprogenitor function in aged mice. Frontiers in Cell and Developmental Biology. 2020; 8:354. [DOI:10.3389/fcell.2020.00354] [PMID]
26.Tarantini S, Balasubramanian P, Delfavero J, Csipo T, Yabluchanskiy A, Kiss T, et al. Treatment with the BCL-2/BCL-xL inhibitor senolytic drug ABT263/Navitoclax improves functional hyperemia in aged mice. GeroScience. 2021; 43(5):2427-40. [DOI:10.1007/s11357-021-00440-z] [PMID]
27.González-Gualda E, Pàez-Ribes M, Lozano-Torres B, Macias D, Wilson JR 3rd, González-López C, et al. Galacto‐conjugation of Navitoclax as an efficient strategy to increase senolytic specificity and reduce platelet toxicity. Aging Cell. 2020; 19(4):e13142. [DOI:10.1111/acel.13142] [PMID]
28.Chin AF, Han J, Clement CC, Choi Y, Zhang H, Browne M, et al. Senolytic treatment reduces oxidative protein stress in an aging male murine model of post‐traumatic osteoarthritis. Aging Cell. 2023; 22(11):e13979. [DOI:10.1111/acel.13979] [PMID]
29.Hsu B, Visich J, Lane N, Li L, Mittal J, An M, et al. Safety, tolerability, pharmacokinetics, and clinical outcomes following treatment of painful knee osteoarthritis with senolytic molecule UBX0101. Osteoarthritis and Cartilage. 2020; 28:S479-S80. [DOI:10.1016/j.joca.2020.02.752]
30.Lane N, Hsu B, Visich J, Xie B, Khan A, Dananberg J. A phase 2, randomized, double-blind, placebo-controlled study of senolytic molecule UBX0101 in the treatment of painful knee osteoarthritis. Osteoarthritis and Cartilage. 2021; 29(1):S52-3. [DOI:10.1016/j.joca.2021.02.077]
31.Wiley CD, Schaum N, Alimirah F, Lopez-Dominguez JA, Orjalo AV, Scott G, et al. Small-molecule MDM2 antagonists attenuate the senescence-associated secretory phenotype. Scientific Reports. 2018; 8(1):2410. [DOI:10.1038/s41598-018-20000-4] [PMID]
32.Le HH, Cinaroglu SS, Manalo EC, Ors A, Gomes MM, Sahbaz BD, et al. Molecular modelling of the FOXO4-TP53 interaction to design senolytic peptides for the elimination of senescent cancer cells. EBioMedicine. 2021; 73:103646. [DOI:10.1016/j.ebiom.2021.103646] [PMID]
33.Fuhrmann-Stroissnigg H, Ling YY, Zhao J, McGowan SJ, Zhu Y, Brooks RW, et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 2017; 8(1):422. [DOI:10.1038/s41467-017-00314-z] [PMID]
34.Limbad C, Doi R, McGirr J, Ciotlos S, Perez K, Clayton ZS, et al. Senolysis induced by 25-hydroxycholesterol targets CRYAB in multiple cell types. iScience. 2022; 25(2):103848. [DOI:10.1016/j.isci.2022.103848] [PMID]
35.Cheung KL, Kim C, Zhou MM. The functions of BET Proteins In Gene Transcription Of Biology And Diseases. Frontiers in Molecular Biosciences. 2021; 8:728777. [DOI:10.3389/fmolb.2021.728777] [PMID]
36.Wakita M, Takahashi A, Sano O, Loo TM, Imai Y, Narukawa M, et al. A BET family protein degrader provokes senolysis by targeting NHEJ and autophagy in senescent cells. Nature Communications. 2020; 11(1):1935. [DOI:10.1038/s41467-020-15719-6] [PMID]
37.Go S, Kang M, Kwon SP, Jung M, Jeon OH, Kim BS. The senolytic drug JQ1 removes senescent cells via ferroptosis. Tissue Engineering and Regenerative Medicine. 2021; 18(5):841-50. [DOI:10.1007/s13770-021-00346-z] [PMID]
38.Triana-Martínez F, Picallos-Rabina P, Da Silva-Álvarez S, Pietrocola F, Llanos S, Rodilla V, et al. Identification and characterization of Cardiac Glycosides as senolytic compounds. Nature Communications. 2019; 10(1):4731. [DOI:10.1038/s41467-019-12888-x] [PMID]
39.Guerrero A, Herranz N, Sun B, Wagner V, Gallage S, Guiho R, et al. Cardiac glycosides are broad-spectrum senolytics. Nature Metabolism. 2019; 1(11):1074-88. [DOI:10.1038/s42255-019-0122-z] [PMID]
40.Nogueira-Recalde U, Lorenzo-Gómez I, Blanco FJ, Loza MI, Grassi D, Shirinsky V, et al. Fibrates as drugs with senolytic and autophagic activity for osteoarthritis therapy. EBioMedicine. 2019; 45:588-605. [DOI:10.1016/j.ebiom.2019.06.049] [PMID]
41.Del Rey MJ, Valín Á, Usategui A, Ergueta S, Martín E, Municio C, et al. Senescent synovial fibroblasts accumulate prematurely in rheumatoid arthritis tissues and display an enhanced inflammatory phenotype. Immunity & Ageing : I & A. 2019; 16:29. [DOI:10.1186/s12979-019-0169-4] [PMID]
42.Amor C, Feucht J, Leibold J, Ho YJ, Zhu C, Alonso-Curbelo D, et al. Senolytic CAR T cells reverse senescence-associated pathologies. Nature. 2020; 583(7814):127-32. [DOI:10.1038/s41586-020-2403-9] [PMID]
43.Amor C, Fernández-Maestre I, Chowdhury S, Ho YJ, Nadella S, Graham C, et al. Prophylactic and long-lasting efficacy of senolytic CAR T cells against age-related metabolic dysfunction. Nature Aging. 2024; 4:336–49. [Link]
44.Yang D, Sun B, Li S, Wei W, Liu X, Cui X, et al. NKG2D-CAR T cells eliminate senescent cells in aged mice and nonhuman primates. Science Translational Medicine. 2023; 15(709):eadd1951. [DOI:10.1126/scitranslmed.add1951] [PMID]
45.Ozsvari B, Nuttall JR, Sotgia F, Lisanti MP. Azithromycin and Roxithromycin define a new family of “senolytic” drugs that target senescent human fibroblasts. Aging (Albany NY). 2018; 10(11):3294-307. [DOI:10.18632/aging.101633] [PMID]
46.Deryabin PI, Shatrova AN, Borodkina AV. Targeting multiple homeostasis-maintaining systems by ionophore Nigericin Is a novel approach for senolysis. International Journal of Molecular Sciences. 2022; 23(22):14251. [DOI:10.3390/ijms232214251] [PMID]
47.Torres B, Guardo A, Squarcia M, Diaz A, Fabra A, Caballero M, et al. Impact of switching to raltegravir and/or adding losartan in lymphoid tissue fibrosis and inflammation in people living with HIV. A randomized clinical trial. HIV Medicine. 2021; 22(8):674-81. [DOI:10.1111/hiv.13114] [PMID]
48.Fontana L, Nehme J, Demaria M. Caloric restriction and cellular senescence. Mechanisms of Ageing and Development. 2018; 176:19-23. [DOI:10.1016/j.mad.2018.10.005] [PMID]
49.Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell. 2013; 12(4):645-51. [DOI:10.1111/acel.12088] [PMID]
50.Fontana L, Mitchell SE, Wang B, Tosti V, van Vliet T, Veronese N, et al. The effects of graded caloric restriction: XII. Comparison of mouse to human impact on cellular senescence in the colon. Aging Cell. 2018; 17(3):e12746. [DOI:10.1111/acel.12746] [PMID]
51.Ke Z, Firsanov D, Spencer B, Seluanov A, Gorbunova V. Short-term calorie restriction enhances DNA repair by non-homologous end joining in mice. NPJ Aging and Mechanisms of Disease. 2020; 6:9. [DOI:10.1038/s41514-020-00047-2] [PMID]
نوع مطالعه: پژوهشي |
موضوع مقاله:
طب سالمندی
دریافت: 1402/10/16 | پذیرش: 1402/12/13 | انتشار: 1404/1/12
دریافت: 1402/10/16 | پذیرش: 1402/12/13 | انتشار: 1404/1/12
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |